- 2021-07-08 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届高考一轮复习人教版化学反应速率与化学平衡规范答题模板(四)平衡移动原理的应用学案(11)
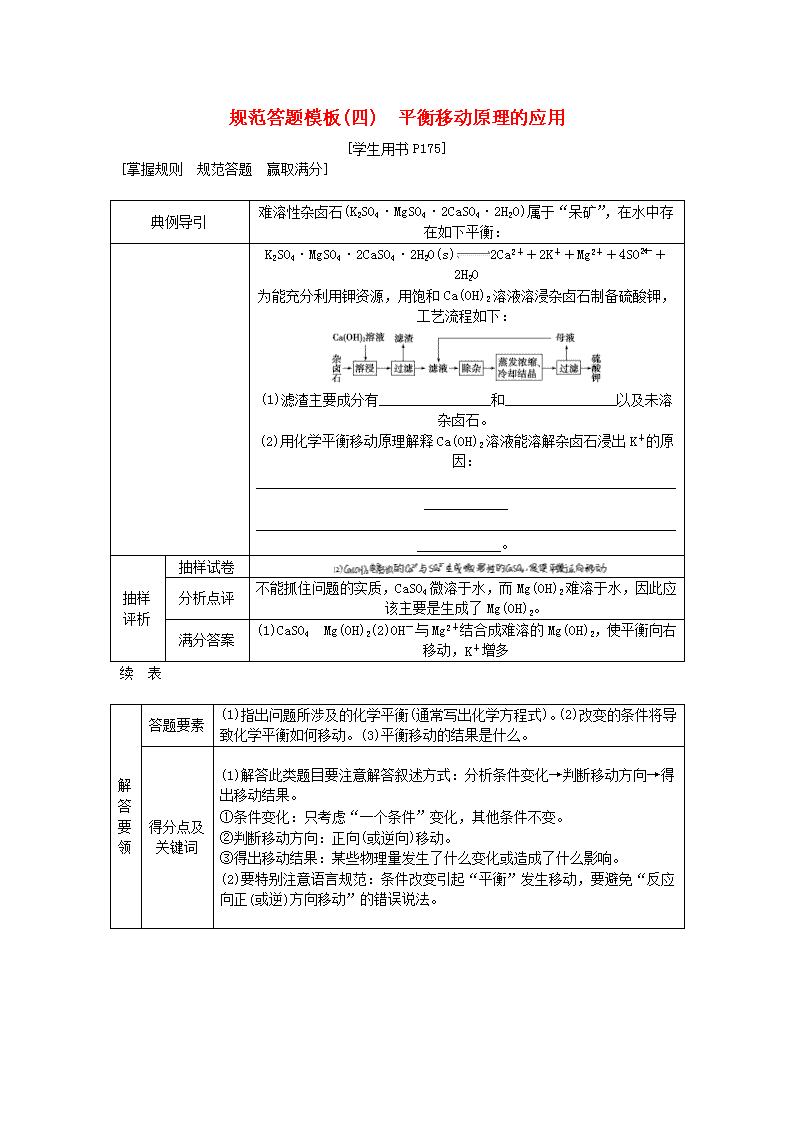
规范答题模板(四) 平衡移动原理的应用 [学生用书P175] [掌握规则 规范答题 赢取满分] 典例导引 难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡: K2SO4·MgSO4·2CaSO4·2H2O(s)2Ca2++2K++Mg2++4SO+2H2O 为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下: (1)滤渣主要成分有________________和________________以及未溶杂卤石。 (2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:________________________________________________________________________ ________________________________________________________________________。 抽样评析 抽样试卷 分析点评 不能抓住问题的实质,CaSO4微溶于水,而Mg(OH)2难溶于水,因此应该主要是生成了Mg(OH)2。 满分答案 (1)CaSO4 Mg(OH)2(2)OH-与Mg2+结合成难溶的Mg(OH)2,使平衡向右移动,K+增多 续 表 解答要领 答题要素 (1)指出问题所涉及的化学平衡(通常写出化学方程式)。(2)改变的条件将导致化学平衡如何移动。(3)平衡移动的结果是什么。 得分点及关键词 (1)解答此类题目要注意解答叙述方式:分析条件变化→判断移动方向→得出移动结果。 ①条件变化:只考虑“一个条件”变化,其他条件不变。 ②判断移动方向:正向(或逆向)移动。 ③得出移动结果:某些物理量发生了什么变化或造成了什么影响。 (2)要特别注意语言规范:条件改变引起“平衡”发生移动,要避免“反应向正(或逆)方向移动”的错误说法。 类题试解 氯气在298 K、100 kPa时,在1 L水中可溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题: (1)该反应的离子方程式为________________________________________________________________________; (2)估算该反应的平衡常数________________________________________________________________________(列式计算); (3)在上述平衡体系中加入少量NaOH固体,平衡将向________移动; (4)如果增大氯气的压强,氯气在水中的溶解度将________(填“增大”“减小”或“不变”),平衡将向________移动。 解析:(1)Cl2溶于水时与水反应,生成HClO和HCl,反应的离子方程式为Cl2+H2OH++Cl-+HClO。 (2)按1 L水中溶解0.09 mol Cl2进行计算,有0.09 mol×=0.03 mol Cl2参加反应: Cl2+H2OH++Cl-+HClO 开始(mol) 0.09 0 0 0 转化(mol) 0.03 0.03 0.03 0.03 平衡(mol) 0.06 0.03 0.03 0.03 则平衡常数K===4.5×10-4。 (3)加入少量NaOH固体,OH-与H+反应生成H2O,OH-与HClO反应生成ClO-和H2O,生成物的浓度减小,平衡向正反应方向移动。 (4)增大Cl2的压强,Cl2在水中的溶解度增大,溶液中c(Cl2)增大,平衡向正反应方向移动。 答案:(1)Cl2+H2OH++Cl-+HClO (2)K== =4.5×10-4 (3)正反应方向 (4)增大 正反应方向 排查落实练六 化学反应速率与化学平衡[学生用书单独成册] 一、化学反应速率与化学平衡正误判断题 (一)化学反应速率正误判断 1.决定化学反应速率的内在因素是反应物本身的性质。( ) 2.固体和纯液体的浓度是固定的,增加固体或纯液体的用量,反应速率保持不变。( ) 3.可逆反应达到平衡,反应就不再进行。 ( ) 4.增大反应物浓度,化学反应速率一定加快。 ( ) 5.在恒温条件下,增大压强,化学反应速率一定加快。 ( ) 6.在一定条件下,增加反应物的量,化学反应速率一定加快。 ( ) 7.其他条件不变,温度越高,反应速率越快。 ( ) 8.正反应为吸热反应的可逆反应达到平衡时,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动。 ( ) 9.加入催化剂加快了反应速率,改变了反应吸收或放出的热量。 ( ) 10.同一反应,在相同时间间隔内,用不同物质表示的反应速率,其数值和意义都不一定相同。 ( ) 11.5 mol·L-1·s-1的反应速率一定比1 mol·L-1·s-1的反应速率大。 ( ) 12.对于某可逆反应,反应进行的净速率是正、逆反应速率之差。 ( ) 答案:1.√ 2.√ 3.× 4.× 5.× 6.× 7.√ 8.× 9.× 10.× 11.× 12.√ (二)化学平衡正误判断 1.正反应速率增大,平衡向正反应方向移动。 ( ) 2.在恒容条件下,有两个平衡体系:A(g)2B(g);2A(g)B(g),都增加A的量,A转化率都变小。( ) 3.在一定条件下,平衡向正反应方向移动,正反应速率变大。 ( ) 4.由温度或压强改变引起的平衡正向移动,反应物的转化率一定增大。 ( ) 5.平衡向正反应方向移动,反应物的转化率都增大。 ( ) 6.对于N2(g)+3H2 (g)2NH3(g) ΔH<0达到平衡后,改变条件。 (1)保持体积不变,充入N2,平衡向正反应方向移动,其转化率增大。 ( ) (2)保持体积不变,充入NH3,则NH3的体积分数减小。 ( ) (3)保持温度不变,压缩体积,平衡向正反应方向移动,N2、H2的转化率均增大,其体积分数均减小,NH3的体积分数增大,N2、H2的浓度增大,NH3的浓度减小。 ( ) 7.对于C(s)+H2O(g)CO(g)+H2(g)反应,在一定条件下达到平衡,增加或减少C(s)的量平衡不移动。 ( ) 8.对于2SO2(g)+O2 (g)2SO3 (g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志。 ( ) 9.对于C(s)+CO2(g)2CO(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均能作为达到化学平衡状态的标志。 ( ) 10.对于2SO2(g)+O2(g)2SO3 (g)和I2(g)+H2(g)2HI(g)反应,在恒温恒容条件下,当压强保持不变时,均能说明上述反应达到化学平衡状态。 ( ) 11.对于I2(g)+H2(g)2HI(g)反应,加入催化剂或增大压强均能缩短达到平衡所用时间,但HI的百分含量保持不变。 ( ) 12.对于C(s)+H2O(g)CO(g)+H2(g)反应,其平衡常数为K=。( ) 13.H2(g)+I2(g)2HI(g)平衡常数为K1,HI(g)H2(g)+I2(g)平衡常数为K2,则K 1·K2=1。( ) 14.化学平衡常数越大,说明正反应进行的程度越大,即该反应进行的越完全,反应物的转化率越大;化学平衡常数越小,说明正反应进行的程度越小,即该反应进行的就越不完全,转化率就越小。 ( ) 15.化学平衡常数只受温度影响,与反应物或生成物的浓度变化无关;温度越高,化学平衡常数越大。 ( ) 答案:1.× 2.× 3.× 4.× 5.× 6.(1)× (2)× (3)× 7.√ 8.× 9.√ 10.× 11.√ 12.× 13.× 14.√ 15.× 二、化学反应速率与化学平衡简答题 1.压强改变,反应速率是否一定改变? 答案:不一定。①对于固体和纯液体参加的反应,压强对其体积的影响很小,固体和纯液体的浓度可看作不变。压强对无气体参加的化学反应的速率无影响;②一定温度下,对于有气体物质参与的化学反应,若保持反应容器体积不变,充入与反应无关的气体,体系压强增大,但原有气体物质的浓度不变,化学反应速率不变。 2.固体或纯液体的浓度是一个常数,因此在任何情况下都不会影响化学反应速率。这种说法是否正确?为什么? 答案:这种说法不正确。固体或纯液体的浓度是一个常数,因此改变固体或纯液体的量不会影响化学反应速率。但是对于固体而言,其颗粒的大小影响反应物接触面积的大小,也就会影响单位时间内发生有效碰撞的次数,因而影响化学反应速率,颗粒越小,接触面积越大,反应速率越快。 3.对已达平衡的可逆反应,当减小生成物浓度时,平衡向正反应方向移动,正反应速率加快。这种说法是否正确?为什么? 答案:不正确。平衡向正反应方向移动的充要条件是正反应速率大于逆反应速率(正反应速率未必增大),而不能想当然地认为平衡向正反应方向移动的充要条件是正反应速率增大。若借助速率—时间图像(如图所示)分析则会一目了然。 在t1时刻减小生成物浓度,逆反应速率立即减小,而此刻反应物浓度不变,正反应速率不变,随后平衡发生移动,反应物浓度减小,生成物浓度增大,正反应速率减小,逆反应速率增大,最终达到新平衡,显然新平衡的正反应速率比原平衡的小。 4.把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气产生的速率随时间变化情况如图所示。其中t1~t2阶段和t2~t3阶段速率变化的主要原因分别是什么? 答案:t1~t2阶段,反应放热使反应体系温度升高,所以反应速率加快。t2~t3阶段,随着反应的进行,H+浓度减小,所以反应速率逐渐减慢。 5.对于反应FeCl3+3KSCNFe(SCN)3+3KCl,在一定条件下达到平衡,当加入KCl固体时,平衡是否发生移动?为什么? 答案:平衡不移动,该反应的离子方程式为Fe3++3SCN-Fe(SCN)3,K+、Cl-实质没有参与反应,所以加入KCl(s),平衡不移动。 6.25 ℃时,合成氨反应的热化学方程式为N2(g)+3H2 (g)2NH3(g) ΔH=-92.4 kJ·mol-1,在该温度下,取1 mol N2和3 mol H2放入密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4 kJ,为什么? 答案:该反应是可逆反应,1 mol N2和3 mol H2不能完全化合生成2 mol NH3,所以反应放出的热量总是小于92.4 kJ。 7.在一体积可变的容器中,对于反应A(g)2B(g)+C(g),当减小压强时,平衡向正反应方向移动,因此物质B的浓度增大,这种说法是否正确?为什么? 答案:不正确。温度不变,减小压强时,平衡向正反应方向移动,在生成物B的物质的量增加的同时,反应混合物的总体积也增大了,并且反应混合物体积增大的倍数要大于B的物质的量增大的倍数,结果是物质B的浓度减小。 8.在一密闭容器中,aA(g)bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的60%,则物质A的转化率减小。这种说法是否正确?为什么? 答案:不正确。容器容积增大一倍的那一刻B的浓度应为原来的50%,而新平衡建立后B的浓度却为原来的60%,即由于容器容积增大一倍使平衡向正反应方向移动了,故A的转化率增大。查看更多