2019届一轮复习人教版水的电离和溶液的pH学案
第27讲 水的电离和溶液的pH
1.电离方程式
水是一种极弱的电解质,电离方程式为2H2O??H3O++OH-,简写为H2O??H++OH-。
2.水的离子积常数
Kw=c(H+)·c(OH-)。
3.外界因素对水的电离平衡的影响
结论:
(1)加热,促进水的电离,Kw增大。
(2)加入酸或碱,抑制水的电离,Kw不变。
4.溶液的酸碱性
溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
c(H+)>c(OH-),溶液呈酸性,25 ℃时,pH<7。
c(H+)=c(OH-),溶液呈中性,25 ℃时,pH=7。
c(H+)
7。
5.溶液的pH
(1)定义式:pH=-lg_c(H+)。
(2)溶液的酸碱性跟pH的关系
室温下:
(3)pH的测定
①用pH试纸测定
把小片试纸放在表面皿上,用玻璃棒蘸取待测液点在干燥的pH试纸上,试纸变色后,与标准比色卡对比即可确定溶液的pH。
注意:a.pH试纸使用前不能用蒸馏水湿润,否则待测液因被稀释可能会产生误差。
b.用广泛pH试纸读出的pH只能是整数。
②pH计测定:可精确测定溶液的pH。
1.正误判断,正确的画“√”,错误的画“×”。
(1)纯水中c(H+)随着温度的升高而降低。( )
(2)向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变。( )
(3)25 ℃的NH4Cl溶液的Kw小于100 ℃ NaCl溶液的Kw。( )
(4)水的离子积常数与温度和溶液的浓度有关。( )
(5)任何温度下,利用H+和OH-浓度的相对大小均可判断溶液的酸碱性。( )
(6)某溶液的c(H+)>10-7 mol·L-1,则该溶液呈酸性。( )
(7)常温时,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合后,滴入石蕊溶液呈红色。( )
(8)常温下用pH试纸测得0.05 mol·L-1的稀硫酸的pH等于1.3。
( )
答案 (1)× (2)× (3)√ (4)× (5)√ (6)× (7)√ (8)×
2.教材改编题
(据人教选修四P52 T6)常温下pH为3的稀盐酸,其中由水电离出的c(H+)为( )
A.0.1 mol/L B.0.3 mol/L
C.10-3 mol/L D.10-11 mol/L
答案 D
考点1 水的电离及水的离子积常数
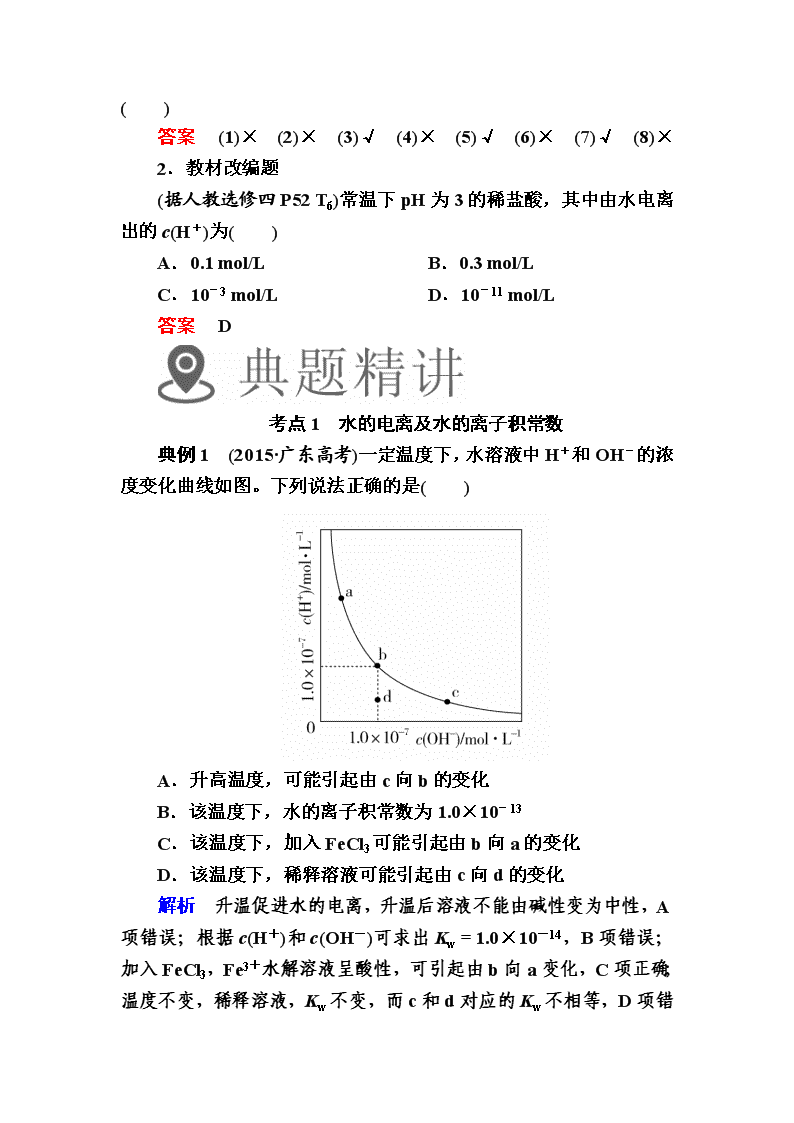
典例1 (2015·广东高考)一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
解析 升温促进水的电离,升温后溶液不能由碱性变为中性,A项错误;根据c(H+)和c(OH-)可求出Kw=1.0×10-14,B项错误;加入FeCl3,Fe3+水解溶液呈酸性,可引起由b向a变化,C项正确;温度不变,稀释溶液,Kw不变,而c和d对应的Kw不相等,D
项错误。
答案 C
名师精讲
1.酸或碱对水的电离均起抑制作用
(1)只要酸的pH相等(不论强弱、不论几元)对水的抑制程度相等,碱也同理。
(2)若酸溶液的pH与碱溶液的pOH相等,则两种溶液中水的电离程度相等。
2.溶液中由水电离出的c(H+)永远等于由水电离出的c(OH-)
(1)酸溶液中:c(H+)水=c(OH-)。
(2)碱溶液中:c(OH-)水=c(H+)。
例如:室温下,pH=3的盐酸,由水电离出的c(H+)水=c(OH-)水= mol·L-1=10-11 mol·L-1。
1.下列有关水电离情况的说法正确的是( )
A.100 ℃时,Kw=10-12,此温度下pH=7的溶液一定呈中性
B.NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用
C.25 ℃时,pH=12的烧碱溶液与纯碱溶液,水的电离程度相同
D.如图为水的电离平衡曲线,若从A点到C点,可采用升高温度的方法
答案 D
解析 100 ℃时,Kw=c(H+)·c(OH-)=10-12,中性溶液中c(H+)=c(OH-)==10-6 mol·L-1,即pH=6,此温度下pH=7的溶液呈碱性,A项错误;NH4Cl、CH3COONa、NaHCO3促进水的电离,NaHSO4抑制水的电离,B项错误;烧碱是NaOH,抑制水的电离,纯碱是Na2CO3,促进水的电离,C项错误;图中A点到C点,c(H+)与c(OH-)同等程度增大,说明是温度升高的结果,D项正确。
2.常温下,1 L pH=6的AlCl3溶液中,由水电离出的H+物质的量为n1 mol;1 L pH=6的HCl溶液中,由水电离出的H+物质的量为n2 mol。则的值是( )
A.1 B.100 C.1000 D.10000
答案 B
解析 1 L pH=6的AlCl3溶液中,H+完全由水提供,故n1=10-6;1 L pH=6的HCl溶液中,H+的来源有两个,一个是水,一个是盐酸,而OH-只来自于水的电离,而且水所电离出的c(H+)=c(OH-),HCl溶液中c(H+)=10-6 mol/L,根据水的离子积Kw=c(H+)·c(OH-)=10-14,得出c(OH-)=10-8 mol/L,所以在1 L pH=6的HCl溶液中,由水电离出的H+的物质的量为10-8 mol,即n2=10-8,则n1∶n2=10-6∶10-8=100,B正确。
考点2 溶液酸碱性及pH计算
典例2 (全国卷)已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH
等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)= mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
解析 判断溶液呈中性的依据是溶液中c(H+)=c(OH-)。混合溶液中c(H+)= mol·L-1,则c(H+)=c(OH-),可判定该溶液呈中性。
答案 C
典例3 求下列溶液的pH(常温条件下,混合溶液忽略体积的变化)。
(1)0.005 mol·L-1H2SO4溶液
(2)0.1 mol·L-1 CH3COOH溶液(已知CH3COOH的电离常数Ka=1.8×10-5)
(3)0.1 mol·L-1NH3·H2O溶液(NH3·H2O的电离度为α=1%)
(4)将pH=8的NaOH与pH=10的NaOH溶液等体积混合
(5)常温下,将pH=5的盐酸与pH=9的NaOH溶液以体积比11∶9混合
(6)将pH=3的HCl与pH=3的H2SO4等体积混合
(7)0.001 mol·L-1NaOH溶液
(8)pH=2的盐酸与等体积的水混合
(9)pH=2的盐酸加水稀释1000倍
解析 (2)CH3COOH ?? CH3COO-+H+
c(初始): 0.1 mol·L-1 0 0
c(电离): c(H+) c(H+) c(H+)
c(平衡): 0.1-c(H+) c(H+) c(H+)
Ka==1.8×10-5
c(H+)=1.3×10-3mol·L-1
pH=-lgc(H+)=-lg(1.3×10-3)=2.9
(3) NH3·H2O??OH- + NH
: 0.1 0 0
: 0.1×1% 0.1×1% 0.1×1%
c(OH-)=0.1×1% mol·L-1=10-3mol·L-1
c(H+)=10-11mol·L-1,pH=-lgc(H+)=11
(5)pH=5的盐酸中c(H+)=10-5mol·L-1,pH=9的氢氧化钠溶液中c(OH-)=10-5mol·L-1,两者以体积比11∶9混合,则酸过量,混合液的pH小于7。
c(H+)=mol·L-1=1.0×10-6mol·L-1,pH=-lg(1.0×10-6)=6。
答案 (1)2 (2)2.9 (3)11 (4)9.7 (5)6 (6)3 (7)11 (8)2.3 (9)5
名师精讲
1.溶液酸碱性的判断规律
(1)判断溶液酸碱性的依据是c(H+)与c(OH-)的相对大小,若c(H+)=c(OH-),则溶液呈中性。
(2)pH=7或c(H+)=10-7mol·L-1的溶液不一定呈中性,因水的电离平衡与温度有关。常温时,pH=7呈中性;100 ℃时,pH=6呈中性。
(3)等浓度等体积一元酸与一元碱混合的溶液
(4)室温下,已知酸和碱pH之和的溶液等体积混合
①两强混合
a.若pH之和等于14,则混合后溶液显中性,pH=7。
b.若pH之和大于14,则混合后溶液显碱性,pH>7。
c.若pH之和小于14,则混合后溶液显酸性,pH<7。
②一强一弱混合——“谁弱显谁性”
pH之和等于14时,一元强酸和一元弱碱等体积混合呈碱性;一元弱酸和一元强碱等体积混合呈酸性。
2.溶液稀释的pH计算
注意:室温下,酸溶液稀释时,pH增大,但无论稀释多大倍数,pH只会无限接近于7,不会大于7或等于7。碱溶液稀释时,pH减小,但无论稀释多大倍数,pH只会无限接近于7,不会小于或等于7。
3.混合溶液的pH计算
(1)两强酸混合后pH的计算
由c(H+)混=先求出混合后的c(H+)混,再根据公式pH=-lg c(H+)求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。
(2)两强碱混合后pH的计算
由c(OH-)混=先求出混合后的c(OH-)混,再通过Kw求出混合后c(H+),最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH大的减0.3。如
pH=9和pH=11的烧碱溶液等体积混合后,pH=10.7。
(3)强酸与强碱混合后pH的计算
强酸与强碱混合的实质是中和反应即H++OH-===H2O,中和后溶液的pH有以下三种情况:
①若恰好中和,pH=7。
②若剩余酸,先求中和后的c(H+),再求pH。
③若剩余碱,先求中和后的c(OH-),再通过Kw求出c(H+),最后求pH。
3.常温下,关于溶液稀释的说法正确的是( )
A.将1 L 0.1 mol·L-1的Ba(OH)2溶液加水稀释为2 L,pH=13
B.pH=3的醋酸溶液加水稀释100倍,pH=5
C.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol·L-1
D.pH=8的NaOH溶液加水稀释100倍,其pH=6
答案 A
解析 A项,将1 L 0.1 mol·L-1的Ba(OH)2溶液加水稀释为2 L,Ba(OH)2溶液的物质的量浓度变为0.05 mol·L-1,氢氧根离子浓度为0.1 mol·L-1,pH=13,正确;B项,加水稀释醋酸溶液,促进酸的电离,因此稀释100倍后,其pH<5,错误;C项,pH=4的H2SO4溶液加水稀释100倍,溶液中的c(H+)=1×10-6 mol·L-1,由水电离产生的c(H+)≈c(OH-)=1×10-8 mol·L-1,错误;D项,pH=8的NaOH溶液加水稀释100倍,其pH应接近7,但不会小于7,错误。
4.判断下列溶液在常温下的酸碱性(在括号中填“酸性”“碱性”或“中性”)。
(1)相同浓度的HCl和NaOH溶液等体积混合。( )
(2)相同浓度的CH3COOH和NaOH溶液等体积混合。( )
(3)相同浓度NH3·H2O和HCl溶液等体积混合。( )
(4)pH=2的HCl和pH=12的NaOH溶液等体积混合。( )
(5)pH=3的HCl和pH=10的NaOH溶液等体积混合。( )
(6)pH=3的HCl和pH=12的NaOH溶液等体积混合。( )
(7)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合。( )
(8)pH=2的HCl和pH=12的NH3·H2O等体积混合。( )
答案 (1)中性 (2)碱性 (3)酸性 (4)中性
(5)酸性 (6)碱性 (7)酸性 (8)碱性
解析 (1)两者混合,恰好生成NaCl溶液,呈中性;
(2)两者混合,恰好生成CH3COONa,水解呈碱性;
(3)两者混合,恰好生成NH4Cl,水解呈酸性;
(4)两者混合,恰好完全反应生成NaCl溶液,呈中性;
(5)两者混合,HCl过量,溶液呈酸性;
(6)两者混合,NaOH过量,溶液呈碱性;
(7)两者混合,CH3COOH过量,溶液呈酸性;
(8)两者混合,NH3·H2O过量,溶液呈碱性。
5.计算下列溶液的pH。
(1)常温下,pH=2的HCl与pH=4的H2SO4溶液等体积混合后,溶液的pH=________。
(2)常温下,pH=8的NaOH溶液与pH=10的KOH溶液等体积混合后,溶液的pH=________。
(3)常温下,pH=5的盐酸与pH=9的NaOH溶液以体积比11∶9混合后,溶液的pH=________。
(4)常温下,将0.1 mol·L-1的盐酸与0.06 mol·L-1的Ba(OH)2溶液等体积混合后,溶液的pH=________。
(5)常温下,将0.02 mol·L-1的Ba(OH)2溶液100 mL和0.02 mol·L-1 NaHSO4溶液100 mL混合,忽略溶液体积变化,则混合后溶液的pH=________。
(6)室温下,取浓度相同的NaOH和HCl溶液,以3∶2
体积比混合,所得溶液的pH=12,则原溶液的浓度为________。
答案 (1)2.3 (2)9.7 (3)6 (4)12 (5)12
(6)0.05 mol·L-1
解析 (1)pH=2的HCl中,c(H+)=10-2 mol·L-1,pH=4的H2SO4中,c(H+)=10-4 mol·L-1,两者等体积混合后,c(H+)= mol·L-1≈0.005 mol·L-1,pH=-lg c(H+)=2.3。
(2)pH=8,c(OH-)=10-6 mol·L-1,pH=10,c(OH-)=10-4 mol·L-1,两者等体积混合后,c(OH-)= mol·L-1≈ mol·L-1,c(H+)=2×10-10 mol·L-1,pH=9.7。
(3)pH=5的盐酸溶液中,c(H+)=10-5 mol·L-1,pH=9的NaOH溶液中,c(OH-)=10-5 mol·L-1,两者以体积比11∶9混合,盐酸过量,c(H+)=
mol·L-1=1×10-6 mol·L-1,pH=-lg c(H+)=6。
(4)两者混合后碱过量,
c(OH-)==0.01 mol·L-1,c(H+)=1×10-12 mol·L-1,pH=12。
(5)两者混合后碱过量,c(OH-)=
=0.01 mol·L-1,pH=12。
(6)混合溶液的pH=12,说明反应的NaOH过量,设原溶液的浓度为c,则=0.01 mol·L-1,c=0.05 mol·L-1。
(建议用时:40分钟)
一、选择题(每题6分,共72分)
1.25 ℃时,相同物质的量浓度的下列溶液:①NaCl;②NaOH;③H2SO4;④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是( )
A.④>③>②>① B.②>③>①>④
C.④>①>②>③ D.③>②>①>④
答案 C
解析 盐类的水解促进水的电离,酸碱抑制水的电离,H2SO4为二元酸抑制水的电离程度最大。
2.某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。下列对该溶液的叙述不正确的是( )
A.该温度高于25 ℃
B.由水电离出来的H+的浓度为1×10-10 mol·L-1
C.加入NaHSO4晶体抑制水的电离
D.取该溶液加水稀释100倍,溶液中的c(OH-)减小
答案 D
解析 该温度下蒸馏水中c(H+)=1×10-6 mol·L-1,大于25 ℃时纯水中c(H+),故温度高于25 ℃,A项正确;此温度下Kw=1×10-12,故该NaHSO4溶液中c(OH-)==1×10-10 mol·L-1,由水电离出的c(H+)与溶液中的c(OH-)相等,B项正确;加入NaHSO4后,NaHSO4电离出的H+抑制了水的电离,C项正确;加水稀释时,c(H+)减小,而Kw不变,故c(OH-)增大,D项错误。
3.常温下,下列说法正确的是( )
A.某物质的溶液中,由水电离出的c(H+)=1×10-a mol·L-1,若a>7,则该溶液的pH为a或14-a
B.pH=b的NH3·H2O溶液稀释10倍后,其pH=b-1
C.pH均为9的NaOH和NaClO溶液中,水的电离程度相同
D.pH=2的CH3COOH溶液与pH=12的NaOH
溶液等体积混合后,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
答案 A
解析 a>7时,水的电离受到抑制,溶液可能为酸性也可能呈碱性,若为酸性,pH=14-a,若为碱性,pH=a,A项正确;NH3·H2O是弱电解质,稀释时电离程度增大,故pH=b的NH3·H2O溶液稀释10倍后,pH>b-1,B项错误;NaOH抑制水的电离,NaClO促进水的电离,C项错误;两者等体积混合后,CH3COOH过量,溶液显酸性,c(H+)>c(OH-),D项错误。
4.T ℃时水的离子积常数为Kw,该温度下,将浓度为a mol·L-1的H2SO4与b mol·L-1的一元碱AOH等体积混合。则可判断溶液呈中性的是( )
A.混合溶液的pH=7
B.c(SO)=c(A+)
C.混合溶液中c(H+)·c(OH-)=Kw
D.混合溶液中c(OH-)= mol·L-1
答案 D
解析 因温度不一定是25 ℃,故pH=7时溶液不一定呈中性;由电荷守恒可知,当溶液呈中性时c(H+)=c(OH-),即c(SO)=c(A+);无论溶液呈酸性、中性还是碱性,混合溶液中总存在c(H+)·c(OH-)=Kw;混合溶液中c(OH-)= mol·L-1说明混合溶液中c(H+)=c(OH-),则溶液一定呈中性。
5.(2017·金版原创)下列说法正确的是( )
A.100 ℃时,任何水溶液中都存在c(H+)·c(OH-)=1×10-14
B.用标准NaOH溶液滴定CH3COOH溶液时,可选用甲基橙做指示剂
C.pH相同且等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积相等
D.某温度下,pH=11的氨水加水稀释100倍,溶液的pH
随溶液体积变化的如图曲线Ⅱ所示
答案 D
解析 温度越高,Kw越大,所以100 ℃时,Kw=c(H+)·c(OH-)>1×10-14,A项错误;反应生成CH3COONa,溶液呈碱性,应选用酚酞作指示剂,B项错误;pH相同且等体积的盐酸和醋酸溶液,醋酸浓度更大,醋酸与足量锌粒反应产生的H2更多,C项错误;由于NH3·H2O是弱电解质,稀释100倍后,溶液的pH>9,所以曲线Ⅱ为氨水的稀释曲线,D项正确。
6.某温度下,向一定体积0.1 mol·L-1氨水溶液中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lg c(OH-)]与pH的变化关系如图所示,下列说法不正确的是( )
A.此温度下,水的离子积常数为1.0×10-2a
B.X点和Z点所示溶液中H2O的电离程度相同
C.X、Y、Z三点所示的溶液中:c(NH)+c(H+)=c(Cl-)+c(OH-)
D.Y点消耗盐酸的体积等于氨水的体积
答案 D
解析 溶液中pH=-lg c(H+)、pOH=-lg c(OH-),由图可知,pH=pOH=a时,溶液呈中性,此时c(H+)=c(OH-)=10-a mol·L-1,水的离子积常数为Kw=c(H+)·c(OH-)=10-a×10-a=10-2a,A项正确;由图可知,X点pH=b,Z点pOH=b,则X点溶液c(H+)=10-b mol·L-1,Z点溶液c(OH-)=10-b mol·L-1,X和Z点溶液对水的电离抑制程度相同,B项正确;X、Y、Z三点溶液均呈电中性,据电荷守恒可得c(NH)+c(H+)=c(Cl-)+c(OH-),C项正确;等浓度、等体积氨水与盐酸混合,恰好完全反应生成NH4Cl,由于NH发生水解反应而使溶液呈酸性,而Y点溶液呈中性,显然V(氨水)稍大于V(盐酸),D项错误。
7.25 ℃时,在等体积的①pH=0的H2SO4溶液;②0.05 mol·L-1的Ba(OH)2溶液;③pH=10的Na2S溶液;④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1∶10∶1010∶109 B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109 D.1∶10∶104∶109
答案 A
解析 ①pH=0的H2SO4溶液中c(H+)=1 mol·L-1,c(OH-)=10-14 mol·L-1,H2SO4溶液抑制H2O的电离,则由H2O电离出的c(H+)=10-14 mol·L-1;②0.05 mol·L-1的Ba(OH)2溶液中c(OH-)=0.1 mol·L-1,c(H+)=10-13 mol·L-1,Ba(OH)2溶液抑制H2O的电离,则由H2O电离出的c(H+)=10-13mol·L-1;③pH=10的Na2S溶液促进H2O的电离,由H2O电离出的c(H+)=10-4mol·L-1;④pH=5的NH4NO3溶液促进H2O的电离,由H2O电离出的c(H+)=10-5mol·L-1。4种溶液中电离的H2O的物质的量等于H2O电离产生的H+的物质的量,其比为10-14∶10-13∶10-4∶10-5=1∶10∶1010∶109。
8.已知100 ℃时,Kw=1.0×10-12,在100 ℃将pH=9的NaOH
溶液与pH=4的硫酸溶液混合,若所得溶液pH=7,则NaOH溶液与硫酸溶液的体积比为( )
A.1∶9 B.9∶1 C.10∶1 D.1∶10
答案 A
解析 反应后pH=7,即溶液显碱性,则c(OH-)== mol·L-1=10-5 mol·L-1,设NaOH溶液的体积为V1 L,硫酸的体积为V2 L,溶液中
=10-5 mol·L-1,解得V1∶V2=1∶9。
9.某温度下Kw=10-13,在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,下列说法正确的是( )
A.若所得混合液为中性,且a=12,b=2,则Va∶Vb=1∶1
B.若所得混合液为中性,且a+b=12,则Va∶Vb=100∶1
C.若所得混合液pH=10,且a=12,b=2,则Va∶Vb=1∶9
D.若所得混合液pH=10,且a=12,b=2,则Va∶Vb=101∶99
答案 C
解析 当所得混合液为中性时,Va·10a-13=Vb·10-b,则=1013-(a+b),故A选项,Va∶Vb=1∶10,错误;B选项,Va∶Vb=10∶1,错误;当所得溶液pH=10时,=10-3,即=,故C选项,Va∶Vb=1∶9,正确;D选项错误。
10.25 ℃时,重水(D2O)的离子积为1.6×10-15,也可用pH一样的定义来规定其酸碱度:pD=-lgc(D+),下列有关pD的叙述,正确的是( )
①中性D2O的pD=7 ②在1 L D2O中,溶解0.01 mol NaOD,其pD=12 ③1 L 0.01 mol·L-1的DCl的重水溶液,pD=2 ④在
100 mL 0.25 mol·L-1DCl的重水溶液中,加入50 mL 0.2 mol·L-1NaOD的重水溶液,反应后溶液的pD=1
A.①② B.③④
C.①③④ D.①②③④
答案 B
解析 由于重水的离子积常数为1.6×10-15,因此重水中c(D+)=4×10-8,对应的pD=7.4,故①错;在0.01 mol·L-1NaOD的重水溶液中,c(OD-)=0.01 mol·L-1,根据重水离子积常数,可推知c(D+)=1.6×10-13 mol·L-1, pD不等于12,故②错;在0.01 mol·L-1DCl的重水溶液中,c(D+) =0.01 mol·L-1,因此pD=2,③正确;n(DCl)=0.25 mol·L-1×0.1 L=0.025 mol,n(NaOD)=0.2 mol·L-1×0.05 L=0.01 mol,c(DCl)==0.1 mol·L-1,因此对应溶液的pD=1,④正确。
11.下列说法不正确的是( )
A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是a>c>b
B.常温下,浓度均为0.1 mol·L-1的①醋酸、②盐酸、③醋酸钠溶液,水的电离程度的顺序为③>①>②
C.常温下,将相同体积的pH=3的硫酸和pH=11的一元碱BOH溶液混合,所得溶液可能为中性,也可能为酸性
D.物质的量浓度相同的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH的顺序为③>①>②
答案 C
解析 碱溶液稀释时.pH逐渐变小,稀释相同倍数时,氢氧化钠溶液的pH变化幅度较大,氨水继续发生电离,pH变化幅度较小,A项正确;醋酸钠为强碱弱酸盐,发生水解反应,促进水的电离,醋酸和盐酸抑制水的电离,由于盐酸是强酸,完全电离,氢离子浓度大,对水的电离的抑制程度大,B项正确;常温下,将相同体积的pH=3的硫酸和pH=11的一元强碱BOH
溶液混合,所得溶液呈中性,常温下,将相同体积的pH=3的硫酸和pH=11的一元弱碱BOH溶液混合,碱过量,所得溶液呈碱性,C项错误;(NH4)2SO4和NH4Cl水解,使溶液呈酸性,(NH4)2SO4中H+较多,pH较小,NH4HCO3中HCO水解消耗了H+,结果使其溶液pH大于NH4Cl溶液,D项正确。
12.水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数,下列说法错误的是( )
A.图中温度T1>T2
B.图中五点Kw间的关系:B>C>A=D=E
C.曲线a、b均代表纯水的电离情况
D.若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显碱性
答案 C
解析 由图像可知,A点在T2时的曲线上,而B点在T1时的曲线上,因为A、B点水电离产生的氢离子与氢氧根离子的浓度相等,所以是纯水的电离,B点的电离程度大于A点,所以温度T1>T2,故A正确;由图像可知,A、E、D都是T2时曲线上的点,Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,则B>A=D=E,由C点c(OH-)×c(H+)可知,C点的Kw大于A点,则B>C>A=D=E,故B正确;由E和D点c(H+)≠c(OH-)可知其不是纯水的电离,故C错误;B点时,Kw=1×10-12,pH=2的硫酸中c(H+)=0.01 mol·L-1,与pH=12的KOH溶液中c(OH-)=
1 mol·L-1等体积混合后,溶液显碱性,故D正确。
二、非选择题(共28分)
13.(2017·长沙模拟)(14分)Ⅰ.在25 ℃时,有一pH=12的NaOH溶液100 mL,欲使它的pH降为11:
(1)如果加入蒸馏水,就加入________mL;
(2)如果加入pH=10的NaOH溶液,应加入________mL;
(3)如果加入0.008 mol·L-1 HCl溶液,应加入________mL。
Ⅱ.在25 ℃时,有pH为a的盐酸和pH为b的NaOH溶液等体积混合:
(1)若a+b=14,则溶液呈________性;
(2)若a+b=13,则溶液呈________性;
(3)若a+b>14,则溶液呈________性。
答案 Ⅰ.(1)900 (2)1000 (3)100
Ⅱ.(1)中 (2)酸 (3)碱
解析 Ⅰ.(1)pH=12的NaOH溶液中,c(OH-)=0.01 mol·L-1,pH=11的NaOH溶液中,c(OH-)=0.001 mol·L-1,设加入水的体积是V1,0.01 mol·L-1×0.1 L=0.001 mol·L-1×(0.1+V1)L,V1=-0.1 L=0.9 L=900 mL。
(2)pH=12的NaOH溶液中c(OH-)=0.01 mol·L-1,pH=10的NaOH溶液中c(OH-)=0.0001 mol·L-1,设加入pH=10的NaOH溶液的体积是V2,0.01 mol·L-1×0.1 L+0.0001 mol·L-1×V2=0.001 mol·L-1×(0.1+V2),V2=1 L=1000 mL。
(3)0.008 mol·L-1 HCl溶液中c(H+)=0.008 mol·L-1,设加入盐酸的体积为V3,c(OH-)=
=0.001 mol·L-1,解得:V3=100 mL。
Ⅱ.pH=a的盐酸中c(H+)=10-a mol·L-1 ,pH=b的NaOH溶液中c(OH-)=10b-14 mol·L-1,两溶液等体积混合后:(1)若a+b=14,
c(H+)=c(OH-),溶液呈中性;(2)若a+b=13,c(H+)>c(OH-),溶液呈酸性;(3)若a+b>14,c(H+)”“<”或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
假设溶液混合前后的体积不变,则a=________,实验②所得溶液中由水电离产生的c(OH-)= __________mol·L-1。
(3)在此温度下,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液显________(填“酸”“碱”或“中”)性。
②写出按乙方式混合后,反应的离子方程式:________________________________________________________________________________________________________________________________________________。
③按甲方式混合后,所得溶液的pH为________(混合时,忽略溶液体积的变化)。
答案 (1)1.0×10-12 > (2)4 1.0×10-7
(3)①中 ②Ba2++OH-+H++SO===BaSO4↓+H2O ③11
解析 (1)Kw=c(H+)·c(OH-)=1.0×10-(x+y),根据图像可知x+y=12,故Kw=1.0×10-12。根据温度越高,H2O的电离程度越大,Kw也越大,可知此时的T>25 ℃。
(2)此条件下,pH =6时溶液呈中性。根据表中实验①的数据可得c(OH-)=1.0×10-4 mol·L-1,根据表中实验③的数据有22.00×10-3 L×1.0×10-4 mol·L-1=22.00×10-3 L×1.0×10-a mol·L-1,可得a=4,即pH=4。实验②中,所得溶液pH=7,Ba(OH)2过量,溶液呈碱性,由H2O电离产生的c(OH-)等于由水电离产生的c(H+),即由水电离产生的c(OH-)=1.0×10-7 mol·L-1。
(3)①按丁方式混合时,Ba(OH)2提供的OH-与NaHSO4提供的H+相等,混合后溶液呈中性。②按乙方式混合时,反应前:n(Ba2+)=1.0×10-3 mol,n(OH-)=2.0×10-3 mol,n(H+)=n(SO)=1.0×10-3 mol,实际反应的Ba2+、OH-、H+、SO均为1.0×10-3 mol
,故反应的离子方程式为Ba2++OH-+H++SO===BaSO4↓+H2O。③按甲方式混合时,OH-过量,反应后溶液中c(OH-)= mol·L-1=0.1 mol·L-1,c(H+)=1.0×10-11 mol·L-1,pH=11。