甘肃省兰州市第一中学2020届高三冲刺模拟考试(一)化学试题 Word版含解析
甘肃省兰州市第一中学2020届高三冲刺模拟考试(一)
理科综合化学试题
1.化学与生活、生产、能源、环境和社会可持续发展等密切相关。下列说法正确的是
A. 废旧电池属于有害垃圾,因含有重金属,故采用深挖填埋的方式进行处理
B. 以高纯硅制成的光导纤维内窥镜可直接窥视有关器官部位的变化
C. “梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花相同
D. 国产大型客机C919上采用了大量先进复合材料、铝锂合金等,其中铝锂合金属于金属材料,是将金属铝、锂混合后在空气中熔合制得的
【答案】C
【解析】
【详解】A.废旧电池属于有害垃圾,因含有重金属,不可以用深挖填埋的方式进行处理,会污染水源、土壤,故A错误;
B.制光导纤维的原材料为二氧化硅,故B错误;
C. “梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花的相同,都是纤维素,故C正确;
D.金属铝、锂性质活泼,易被空气中的氧气氧化,应该将金属铝、锂混合后在隔绝空气熔合制得,故D错误;
答案选C。
2.有机物G()能添加在牙膏、口香糖中以增强香气。下列关于G的说法错误的是( )
A. 分子式为C11H14O
B. 一氯代物有8种(不考虑立体异构)
C. 所有碳原子可能在同一平面上
D. 能发生取代、加成、氧化反应
【答案】C
【解析】
【详解】A. 根据有机物G的结构简式,该有机物分子式为C11H14O,故A说法正确;
B. 该有机物中有8种不同环境的氢原子,则一氯代物有8种,故B说法正确;
- 18 -
C. 标记中的碳原子为sp3杂化,与它连接的三个碳原子不共面,即该有机物中所有碳原子不在同一平面上,故C说法错误;
D. 该有机物能发生取代反应,碳碳双键和羰基,能发生加成反应,碳碳双键能使酸性高锰酸钾溶液褪色,即发生氧化反应,故D说法正确;
答案:C。
3.NA是阿伏加德罗常数的值,下列说法不正确的是
A. 2gH2分别与足量的Cl2和N2充分反应后转移的电子数均为2NA
B. 1.4gCO和N2的混合气体中含有的质子数为0.7NA
C. 14.0gFe发生吸氧腐蚀生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
D. 常温下,1L0.1mol·L-1NH4NO3溶液中含有的氮原子数为0.2NA
【答案】A
【解析】
【详解】A.2gH2的物质的量为1mol,不论与足量的Cl2反应,还是与足量的N2充分反应,氢元素都是由0价变为+1价,1mol H2与足量的C12完全反应,转移的电子数均为2NA,H2和N2反应是可逆反应,反应后转移的电子数小于2NA,故A错误;
B.CO和N2的摩尔质量都为28g/mol,质子数均为14,则1.4gCO和N2的混合气体的物质的量为=0.05mol,则含有的质子数为=0.7NA,故B正确;
C.铁发生吸氧腐蚀电极反应式:Fe−2e−=Fe2+,14.0gFe物质的量为=0.25mol,转移电子数为:0.25mol×2×NA=0.5NA,故C正确;
D.一个硝酸铵中含有两个单原子,常温下,1L0.1mol/L 的NH4NO3溶液含有硝酸铵物质的量为:0.1mol/L×1L=0.1mol,含氮原子数为0.2NA,故D正确;
答案选A。
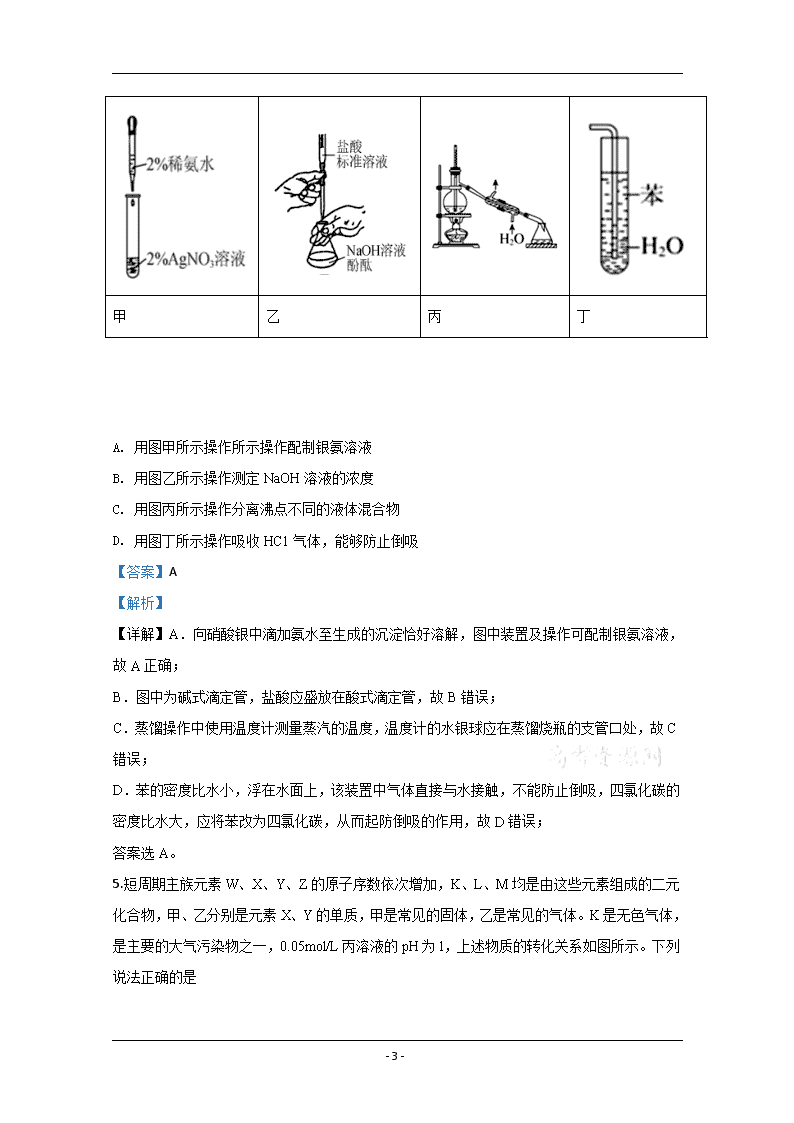
4.用下列实验操作或装置进行相应实验,正确的是
- 18 -
甲
乙
丙
丁
A. 用图甲所示操作所示操作配制银氨溶液
B. 用图乙所示操作测定NaOH溶液的浓度
C. 用图丙所示操作分离沸点不同的液体混合物
D. 用图丁所示操作吸收HC1气体,能够防止倒吸
【答案】A
【解析】
【详解】A.向硝酸银中滴加氨水至生成的沉淀恰好溶解,图中装置及操作可配制银氨溶液,故A正确;
B.图中为碱式滴定管,盐酸应盛放在酸式滴定管,故B错误;
C.蒸馏操作中使用温度计测量蒸汽的温度,温度计的水银球应在蒸馏烧瓶的支管口处,故C错误;
D.苯的密度比水小,浮在水面上,该装置中气体直接与水接触,不能防止倒吸,四氯化碳的密度比水大,应将苯改为四氯化碳,从而起防倒吸的作用,故D错误;
答案选A。
5.短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是
- 18 -
A. 原子半径:W
Y>X
C. 化合物XZ2中所有原子均满足8电子稳定结构
D. X、 Z的单质分别直接与Y的单质反应,都能生成两种氧化物。
【答案】C
【解析】
【分析】
0.05mol/L丙溶液的pH为l,可知丙为二元强酸,应为H2SO4,K是无色气体,是主要的大气污染物之一,且可生成H2SO4,则应为SO2,可知乙为O2,L为H2O,乙是常见的气体,且与浓硫酸和甲反应生成,可知甲为C,M为CO2,则W为H元素,X为C元素,Y为O元素,Z为S元素,以此解答该题。
【详解】由题意分析可知,W为H元素,X为C元素,Y为O元素,Z为S元素,
A.同周期元素原子半径从左到右逐渐减小,电子层越多原子半径越大,则原子半径为C>O>H,即W<Y<X,故A错误;
B.同主族元素从上到下非金属性减弱,且碳酸的酸性小于硫酸,可知非金属性为O>S>C,即Y>Z>X,故B错误;
C.X为C元素,Z为S元素,化合物XZ2为CS2,电子式为,其中所有原子均满足8电子稳定结构,故C正确;
D.X为C元素,Z为S元素,Y为O元素,C与氧气反应可生成CO和CO2,S与氧气反应只能生成SO2,故D错误;
答案选C。
【点睛】二硫化碳的性质与二氧化碳的结构相似,电子式相似。
6.某废水含Na+、K+、Mg2+、Cl-和SO42-等离子。利用微生物电池进行废水脱盐的同时处理含OCN-的酸性废水,装置如图所示。下列说法错误的是
- 18 -
A. 好氧微生物电极N为正极
B. 膜1、膜2依次为阴离子、阳离子交换膜
C. 通过膜1和膜2的阴离子总数一定等于阳离子总数
D. 电极M的电极反应式为2OCN--6e-+2H2O=2CO2↑+N2↑+4H+
【答案】C
【解析】
【详解】A.由物质转化知,OCN-中C为+4价,N为-3价,在M极上N的化合价升高,说明M极为负极,N极为正极,A项正确;
B.在处理过程中,M极附近电解质溶液正电荷增多,所以阴离子向M极迁移,膜1为阴离子交换膜,N极反应式为O2+4e-+2H2O=4OH-,N极附近负电荷增多,阳离子向N极迁移,膜2为阳离子交换膜,B项正确;
C.根据电荷守恒知,迁移的阴离子、阳离子所带负电荷总数等于正电荷总数,但是离子所带电荷不相同,故迁移的阴、阳离子总数不一定相等,C项错误;
D.M极发生氧化反应,水参与反应,生成了H+,D项正确;
答案选C。
7.25 ℃时,向10 mL 0.1 mol·L-1一元弱碱XOH溶液中逐滴滴加0.1 mol·L-1的盐酸,溶液的AG[AG=lg]变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是( )
A. 若a=-8,则Kb(XOH)≈10-6
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
【答案】AB
【解析】
- 18 -
【详解】A. a点表示0.1 mol·L-1的XOH,若a=−8,则c(OH−)=10−3 mol·L-1,所以Kb(XOH)= ≈10−5,A项错误;
B. M点AG=0,则溶液中c(OH−)=c(H+),溶液呈中性,所以溶液中为XOH、XCl,二者没有恰好反应,B项错误;
C. 若R点恰好为XCl时,根据物料守恒可得:c(X+)+c(XOH)=c(C1−),C项正确;
D. M点的溶质为XOH和XCl,继续加入盐酸,直至溶质全部为XCl时,该过程水的电离程度增大,然后XCl溶液中再加入盐酸,水的电离程度减小,所以从M点N点,水的电离程度先增大后减小,D项正确;
答案选AB。
8.实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:
有关物质的物理性质见下表。
物质
沸点(℃)
密度(g·cm−3,20℃)
溶解性
环己醇
161.1(97.8)*
0.96
能溶于水和醚
环己酮
155.6(95.0)*
0.95
微溶于水,能溶于醚
水
100.0
1.0
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为___________________。
(2)实验时加入沸石的作用_______________,若加热后发现未加沸石,应采取的正确操作是_______________。
- 18 -
(3)蒸馏不能分离环己酮和水的原因是_______________。
(4)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤正确顺序是_______________;
②b中水层用乙醚萃取的目的是_______________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、漏斗外,还需要的玻璃仪器有_______________,操作d中,加入NaCl固体的作用是_______________。
(5)恢复至室温时,分离得到纯产品5.7g,则环已酮的产率_______________(计算结果精确到0.1%)。
【答案】 (1). (直形)冷凝管 (2). 防暴沸 (3). 立刻停止加热,待液体冷却后补加沸石,再继续实验 (4). 环己酮和水形成具有固定组成的恒沸物一起蒸出 (5). dbeca (6). 使水层中少量的有机物进一步被提取,提高产品的产量 (7). 玻璃棒、分液漏斗 (8). 降低环己酮的溶解度,增加水层的密度,有利于分层 (9). 60.6%
【解析】
分析】
本实验的目的是制备环己酮,装置A中利用酸性Na2Cr2O7溶液将环己醇在55 ~ 65℃ 时氧化得到环己酮,反应完成后,加入适量水,蒸馏,收集95 ~ 100C的馏分,得到主要含环己酮粗品和水的混合物;之后进行提纯,首先往液体中加入NaCl固体至饱和,从而降低环己酮的溶解度,并且增加水层的密度,静置后分液;分液后水层用乙醚萃取进一步提取水层中环己酮并入有机层;之后用无水硫酸镁除去有机物中少量的水分,过滤后蒸馏分离乙醚,得到纯净的环己酮。
【详解】(1)装置D的名称是(直形)冷凝管,具有冷凝蒸汽作用;
(2)实验时加入沸石的作用防止液体暴沸,若加热后发现未加沸石,应采取的正确操作是立刻停止加热,待液体冷却后补加沸石,再继续实验;
(3)由于环己酮和水形成具有固定组成恒沸物,环己酮和水会一起蒸出,导致蒸馏不能分离环己酮和水;
- 18 -
(4)①环己酮的提纯:首先往液体中加入NaCl固体至饱和,从而降低环己酮的溶解度,并且增加水层的密度,静置后分液;分液后水层用乙醚萃取进一步提取水层中环己酮并入有机层;之后用无水硫酸镁除去有机物中少量的水分,过滤后蒸馏分离乙醚,得到纯净的环己酮,所以,提纯步骤的正确顺序是 dbeca;
②环己酮在乙醚中的溶解度大于在水中的溶解度,且乙醚微溶于水,则乙醚能作萃取剂,能将水中的环己酮萃取到乙醚中,从而提高产品产量;
③过滤需要由漏斗组成的过滤器,分液需要的主要仪器为分液漏斗;NaCl能增加水层的密度,降低环己酮的溶解,有利于分层;
(5)环己醇的质量为10mL×0.96g/mL=9.6g,理论上得到环己酮质量=×98g/mol=9.408g,恢复至室温时,分离得到纯产品体积为6mL,由表中的密度可以算出环己酮的实际质量为0.95g/mL×6mL=5.7g ,所以环己酮的产率为:×100%=60.6%。
【点睛】对于陌生物质的制备,关键是理解题目所给的有关该物质的性质,将这些性质充分利用到解题过程中。
9.废旧锌锰电池含有锌、锰元素,主要含有ZnO、ZnMn2 O4、MnO、Mn2 O3、Mn3 O4、MnO2。利用废旧锌锰电池回收锌和制备二氧化锰、硫酸的工艺流程如图:
回答下列问题:
(1)步骤②“粉碎”的主要目的是______。
(2)步骤③“酸浸”发生了一系列反应:
ZnO+ H2SO4= ZnSO4 + H2O;MnO+ H2SO4= MnSO4 + H2O;
ZnMn2O4+2H2SO4=ZnSO4 + MnSO4 +2H2O+MnO2;
MnO2 + H2SO4 + H2C2O4=MnSO4 + 2CO2 ↑+2H2O。
推测 Mn2O3 与硫酸反应的离子方程式为______。
(3)如图分别表示“酸浸”时选用不同浓度硫酸和草酸对 Zn、Mn 浸出率的影响。
- 18 -
①为保证 Zn、Mn 的浸出率均大于 90%,步骤③需控制的 c(H2SO4) = ____mol/L。H2C2O4 浓度对 Mn 的浸出率影响程度大于 Zn,其原因是_____。
②假设“酸浸”所得溶液中Zn2+、Mn2+浓度相等。当 c(H2C2O4)>0.25 mol/L 时,Zn、Mn 的浸出率反而下降、且Zn 的浸出率下降先于Mn,其原因可能是_____(填序号)。
a.随着反应进行 c(H+)降低
b.Zn2+、Mn2+与 C2O42- 生成沉淀
c.溶解度:ZnC2O4<MnC2O4
(4)步骤⑤用惰性电极电解 ZnSO4 、MnSO4 的混合溶液,除生成 Zn、MnO2、H2SO4 外, 还可能生成 H2、O2 或其混合物。
①生成 MnO2 的电极反应式为_____ 。
②若 n (H2) :n (O2)=2:1,则参加反应的 n (Zn2+):n (Mn2+) = ______。
③该工艺流程中可循环利用的物质是________。
【答案】 (1). 增大接触面积,提高浸出率 (2). Mn2O3 +2H+=Mn2++H2O+ MnO2 (3). 0.5 (4). Zn元素浸出时不需要还原剂,而+4价Mn (MnO2、Mn2O3、Mn3O4)需加入H2C2O4作还原剂更有利浸出或MnO2+H2SO4+H2C2O4=MnSO4+2CO2↑+2H2O (5). a、b、c (6). Mn2+ +2H2O-2e-=MnO2 +4H+ (7). 1∶1 (8). H2SO4或硫酸
【解析】
【分析】
将废旧锌锰电池机械分离,为增加浸出率,对内部固体残渣(主要含有ZnO、ZnMn2 O4、MnO、Mn2 O3、Mn3 O4、MnO2)粉碎,加入足量H2SO4和草酸对残渣进行溶浸,发生ZnO+ H2SO4= ZnSO4 + H2O;MnO+ H2SO4= MnSO4 + H2O;ZnMn2O4+2H2SO4=ZnSO4 + MnSO4 +2H2O+MnO2;MnO2 + H2SO4 + H2C2O4=MnSO4 + 2CO2 ↑+2H2O等一系列反应,得到主要含有Mn2+、Zn2+、SO42-等离子的酸浸液,对酸浸液过滤除杂精制,对含有Mn2+、Zn2+、SO42-等离子的精制液电解得到硫酸、二氧化锰、单质锌,据此分析解答。
- 18 -
【详解】(1)增大接触面积,提高浸出率;
(2)ZnMn2O4可用氧化物的形式表示ZnO · Mn2O3,ZnO·Mn2O3 +2H2SO4=ZnSO4+ MnSO4+2H2O+ MnO2可知Mn2O3 +2H+=Mn2++H2O+ MnO2;
(3)①由图可知,当c(H2SO4)=0.5 mol/L时,Mn的浸出率等于90%,Zn的浸出率大于90%。由ZnO+H2SO4=ZnSO4+H2O、MnO+H2SO4=MnSO4+ H2O、ZnMn2O4 + 2H2 SO4=ZnSO4 + MnSO4+2H2O + MnO2、MnO2 + H2SO4 + H2C2O4=MnSO4+2CO2↑+2H2O可知,Zn的浸出只需H2SO4即可,所以Zn元素浸出时不需要还原剂,而+4价Mn(MnO2、Mn2O3、Mn3O4)需加入H2C2O4作还原剂更有利Mn的浸出。或MnO2 + H2SO4+H2C2O4=MnSO4+2CO2↑+2H2O;
②a.结合①的分析,Mn、Zn的浸出率与c(H+ )有关,如果c(H+)减小,浸出率下降,故a正确;
b.c(H2C2O4)>0.25mol/L时,如果Zn2+、Mn2+与C2O生成沉淀,浸出率下降,故b正确;
c.如果溶解度ZnC2O4
查看更多