- 2021-07-06 发布 |
- 37.5 KB |
- 31页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版高二化学乙醇课件(共二课时)课件
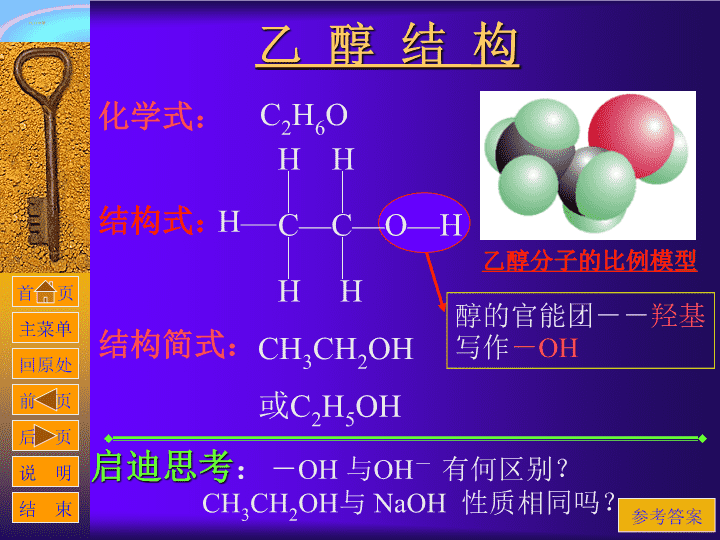
乙醇俗称酒精 跟我们日常生活密切联系 《 乙 醇 》 主菜单 知识总结 化学性质 乙醇结构 乙醇用途 结束退出 物理性质 乙醇制法 启迪思考 精选练习 课件制作 C—C—O—H H H H H H 结构式: CH 3 CH 2 OH 或C 2 H 5 OH 醇的官能团-- 羟基 写作 - OH 乙醇分子的比例模型 化学式: 启迪思考 : - OH 与 OH - 有何区别? CH 3 CH 2 OH 与 NaOH 性质相同吗? 乙 醇 结 构 C 2 H 6 O 结构简式: 参考答案 让 我 好好想想 ??? 物 理 性 质 颜 色 : 气 味 : 状 态: 密 度 : 溶解性: 挥发性: 无色 透明 特殊香味 液体 比水小 20 0 C 时的密度是 0.7893g/cm 3 跟水以任意比互溶 能够溶解多种无机物和有机物 易挥发 乙醇俗称 酒精 启迪思考 : 如何分离水和酒精? 工业上如何制取无水的乙醇? 参考答案 酒的 知识 化 学 性 质 结构与性质分析 与金属反应 与氢卤酸反应 氧化反应 脱水反应 化 学 性 质 结构与性质分析 C—C—O—H H H H H H 官能团-- 羟基(- OH ) - C 原子 - C 原子 乙醇分子是由乙基( —C 2 H 5 ) 和羟基( —OH ) 组成的,羟基比较活泼,它决定着乙醇的主要性质。在处均可断键反应。 在后面的化学性质中要注意是在哪里断键的。 ① ② ④ ③ 化 学 性 质 2C 2 H 5 OH+2Na 2C 2 H 5 ONa+H 2 与金属反应 (演示实验同时做钠与水反应比较实验) 分析 : 乙醇跟金属钠反应,生成乙醇钠,并放出氢气。与水跟金属钠的反应相比,乙醇跟钠的反应要缓和得多。 其它活泼金属如 钾、镁、铝 等也能够把乙醇的羟基里的氢取代出来。 乙醇分子可以看作是水分子里的一个氢原子被乙基所取代的产物,但乙醇在水溶液里比水还难于电离。 启迪思考 : 试比较 乙醇和 水的酸性强弱 ? 能否通过此反应测定有机物的羟基数目? 参考答案 化 学 性 质 与氢卤酸反应 乙醇可与氢卤酸发生作用,反应时乙醇分子里的羟基键断裂,卤素原子取代了羟基的位置而生成卤代烃,同时生成水。 C—C—H H H H H O—H C 2 H 5 Br+H 2 O C 2 H 5 OH+H Br 溴乙烷 羟基被取代 启迪思考 : 上述反应是什么类型反应? 若将乙醇、食盐、浓硫酸 (1 : 1) 混合加热时,反应中硫酸的作用是什么?有关反应是什么? 参考答案 化 学 性 质 氧化反应 :(一) 乙醇在空气里能够燃烧,发出淡蓝色的火焰,同时放出大量的热。 因此: 乙醇可用作内燃机的燃料,实验 室里也常用它作为燃料。 启迪思考 : 在有机化学中通常用反应物的得氧或得氢来判断氧化还原反应。 得氧或失氢叫做氧化反应;得氢或失氧叫做还原反应。 乙醇被氧化成别的物质呢? 且 看下 页 分解 2CO 2 +3H 2 O + 热 C 2 H 5 OH + 3 O 2 点燃 分析: 乙醇在加热和有催化剂( Cu 或 Ag ) 存在的条件下,能够被空气氧化,生成乙醛。工业上根据这个原理,可以由乙醇制造乙醛。 化 学 性 质 氧化反应 :(二) 演示实验 : 将热铜丝插入乙醇中,反复多次,闻液体气味变化 。 现象: 气味变成刺激性气味。 2CH 3 CH 2 OH + O 2 2CH 3 CHO + 2H 2 O 催化剂 C—C—H H H H H O—H --C 被氧化还原 两个氢脱去与 O 结合成水 启迪思考 : 当 --C 上 没有氢或只有一个氢的情况又如何氧化呢? 提示 化 学 性 质 脱水反应--(分子内脱水) 乙醇和浓硫酸加热到 170℃ 左右,每一个乙醇分子会脱去一个水分子而生成乙烯。 实验室里可以用这个方法制取乙烯。 浓 H 2 SO 4 170 0 C H C C H CH 2 =CH 2 +H 2 O H H H OH 实验 : 如图(乙醇与浓硫酸混合加热) 羟基和氢 脱去 结合成水 分子内脱水--制乙烯: 像乙醇的分子内脱水反应: 有机化合物在适当的条件下,由一个分子脱去一个小分子(如水、卤化氢等分子),而生成不饱和(双键或叁键)化合物的反应,叫做 消去反应 。 化 学 性 质 C—C—H H H H H O—H 消去(脱水) - - 启迪思考 : 能发生消去反应的醇的分子结构特点是什么? 是不是所有的醇都能发生消去反应? 我要看 答案 乙醇能脱水主要是由于乙醇分子里含有羟基。如果反应条件(例如温度)不同,乙醇脱水的方式也不同,以致生成物也不同。例如乙醇和浓硫酸共热到 140℃ 左右,那么每两个乙醇分子间会脱去一个水分子而生成乙醚。 脱水反应--(分子间脱水) 2CH 3 CH 2 OH CH 3 CH 2 OCH 3 CH 2 + H 2 O 浓 H 2 SO 4 140 0 C 化 学 性 质 启迪思考 : 通过分子内脱水反应和分子间脱水反应,试比较这两个反应的异同点,有什么心得? 参考提示 所以,我们可以根据物质的化学性质,按照实际需要,控制 反应条件 ,使化学反应朝着我们所需要的方向进行。 学以致用 乙 醇 用 途 乙醇有相当广泛的用途: 用作燃料,如酒精灯等 制造饮料和香精外,食品加工业 一种重要的有机化工原料,如制造乙酸、乙醚等。 乙醇又是一种有机溶剂,用于溶解树脂,制造涂料。 医疗上常用 75 %(体积分数)的酒精作消毒剂。 乙 醇 制 法 1 、发酵法 发酵法是制取乙醇的一种重要方法,所用原料是含糖类很丰富的各种农产品,如高梁、玉米、薯类以及多种野生的果实等,也常利用废糖蜜。这些物质经过发酵,再进行分馏,可以得到 95 %(质量分数)的乙醇。 2 、乙烯水化法 以石油裂解产生的乙烯为原料,在加热、加压和有催化剂(硫酸或磷酸) 存在的条件下,使乙烯跟水反应,生成乙醇。这种方法叫做乙烯水化法。用乙烯水化法生产乙醇,成本低,产量大,能节约大量粮食,所以随着石油化工的发展,这种方法发展很快。 CH 2 =CH 2 +H 2 O CH 3 CH 2 OH 催化剂 加热加压 知 识 总 结 乙醇结构:化学式、结构式和结构简式 官能团与性质关系。 物理性质:色、味、态、溶解度和挥发性 化学性质 : (1) 与活泼金属反应 (1) 与氢卤酸反应 (1) 氧化反应--燃烧与制醛 (1) 脱水反应--分子内脱水 -- 分子间脱水 乙醇用途: 乙醇制法:发酵法和乙烯水化法 3 、如何分离水和酒精? 4 、工业上如何制取无水的乙醇? 参考 : 由于水和酒精是互溶的,所以通常用蒸馏的方法分离水和酒精。 参考 : 先加生石灰,生石灰与水反应生成氢氧化钙,然后加热蒸馏分离乙醇。 启 迪 思 考 题 5 、试比较 乙醇和 水的酸性强弱 ? 6 、能否通过此反应测定有机物的羟基数目? 参考 : 乙醇和水都呈中性,但水中能电离出 H + 离子,而乙醇则不能。 参考 : 能。 让钠与醇反应,通过钠与醇的物质的量作比较则可有结果。 启 迪 思 考 题 7 、乙醇与氢卤酸的反应是什么类型反应? 8 、 若将乙醇、食盐、浓硫酸 (1 : 1) 混合加热时, 反应中硫酸的作用是什么?有关反应是什么? 参考 : 是个取代反应。可看作是卤素原子取代了乙醇中的羟基(- OH )。 参考 : 硫酸是作为反应物制氢卤酸。 C 2 H 5 OH + HCl C 2 H 5 Cl + H 2 O NaCl + H 2 SO 4 NaHSO 4 + HCl 启 迪 思 考 题 参考 : 与- OH 相连 的碳原子必须有 H 才能被氧化。 9 、当 - C 上氢原子数目与醇的氧化有何关系? C—C—H H H H H O—H --C 被氧化还原 两个氢脱去与 O 结合成水 ① 在 --C 碳上有 2 个 H 时 ② 在 --C 碳 上只有 1 个 H 时 做 练习 一 启 迪 思 考 题 RCH O RCH=O H H Cu ~300 0 C 生成醛 C O C=O R R R R H H Cu ~300 0 C 生成酮 参考 : 能发生消去反应的条件有: ① 连有- OH 的碳原子周围有碳原子。 如 CH 3 OH 则 不能发生消去反应。 11 、能发生消去反应的醇的分子结构特点是什 么? 是不是所有的醇都能发生消去反应? CH 3 CH 3 CH 3 C—C—H H O—H ② 与连有- OH 的碳原子 相邻的碳原子上有氢 原子。如右物质则不 能发生消去反应。 启 迪 思 考 题 参考 : 它们都是脱去一个水分子; 不同的是:分子内脱水反应属于消去反应,而分子间反应属于取代反应;反应条件也不同。 所以,我们可以根据物质的化学性质,按照实际需要,控制反应条件,使化学反应朝着我们所需要的方向进行。 12 、通过分子内脱水反应和分子间脱水反应, 试比较这两个反应的异同点,有什么心得? 启 迪 思 考 题 练 习 题 C—C—O—H H H H H H ① ② ④ ③ 1 : 与钠反应时在何处断键。 A: ① 2 : 发生消去反应时在何处断键。 A: ① ④ B: ② B: ① ③ C: ③ C: ② ④ D: ④ D: ② ④ 练 习 题 3 、 把质量为 m g 的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红,而且质量仍为 m g 的是: A : 稀硫酸 B : 酒 精 C : 稀 硝酸 D: CO 4 、 能用来检验酒精中是否含有水的试剂是: A: CuSO 4 · · 5H 2 O B : 无水硫酸铜 C : 浓 硫酸 D : 金属钠 5 、 相同质量的下列醇,与足量钠反应放出氢气最多的是: A : 甲 醇 B : 乙 醇 C : 乙二醇 D : 甘 油 练 习 题 6 、 在下列物质中加入溴水数滴,振荡,溴水 不褪色的是: A : 浓硫酸 B :浓 NaOH 溶液 C : 碱 石灰 D : 无水氯化钙 7 、 酒精完全燃烧后,生成的产物可用一种物质完全吸收,这种物质是: A : NaOH 溶液 B : 酒 精 C : SO 2 溶液 D : 氢硫酸溶液 乙醚是醚类中最重要的一种。凡是两个烃基通过一个氧原子连结起来的化合物叫做醚。醚的通式是 R—O—R' , R 和 R' 都是烃基,可以相同,也可以不同。 乙醚是一种无色易挥发的液体,沸点是 4.51 ℃ ,有特殊的气味。吸入一定量的乙醚蒸气,会引起全身麻醉,所以纯乙醚可用作外科手术时的麻醉剂。 乙醚微溶于水,易溶于有机溶剂,它本身是一种优良溶剂,能溶解许多有机物。乙醚蒸气很容易着火,空气中如果混有一定比的乙醚蒸气,遇火就会发生爆炸,所以使用乙醚时要特别小心。 乙醚 软件使用说明 采用非线性结构,方便老师调用 鼠标左键或键盘 任意键 可逐步显示屏幕内容 单击各种按钮、热字可实现交互跳转 单击动画画面可暂停或继续播放该动画 任意时刻均可按 返首页 任意时刻均可按 到主菜单 任意时刻均可按 回到原处 任意时刻均可按 到默认上一张幻灯片 任意时刻均可按 到默认下一张幻灯片 任意时刻均可按 到本帮助说明 任意时刻均可按 结束幻灯片放映 前 页 后 页 结 束 首 页 主菜单 说 明 回 原处 乙醇是发生在生活中较熟悉的一种醇,本节主要介绍了乙醇的结构式、性质和用途, 由于在初中化学教材中对乙醇有过初步介绍,因此建议本节可从学生熟悉的内容谈起,再剖析乙醇的结构简式及结构特点,推测可能具有性质,结合具体演示实验分析乙醇的物理及化学性质。 本节教学的重点为乙醇的性质和用途。在讲述乙醇的化学性质时,要抓住官能团的特性,也要注意乙基对羟基的影响。 在化学反应中表现出一系列的化学性质,由此也体现出“结构决定性质”的重要规律。 在教学中,要做好演示实验(教师最好在教材基础上加以补充和改进),加深印象,利于对知识的掌握,从而突破难点。也要将乙醇的性质与生活实际联系起来,避免空洞、抽象地说教,有利于培养学生的兴趣,也利于培养学生的能力。查看更多