- 2021-07-06 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年内蒙古集宁一中高一12月月考化学试题
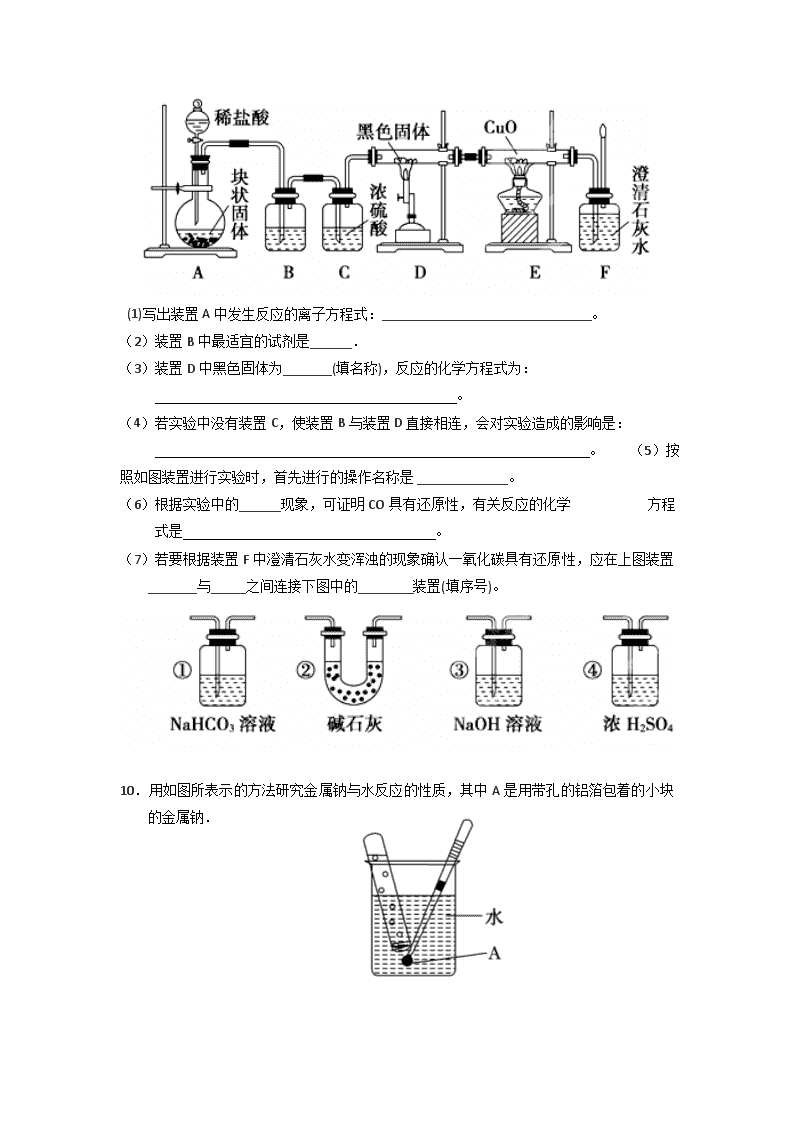
2018-2019学年内蒙古集宁一中高一12月月考化学试题 本试卷满分:100分 可能用到的原子相对质量: Mg:24 C:12 N:14 O:16 Na:23 S:32 K:39 Cl:35.5 Al:27 Cu:64 第Ⅰ卷(选择题 共42分) 一、选择题(每小题6分,共42分。每小题只有一个正确答案) 1.化学与生活、生产密切相关。下列说法中错误的是( ) A.过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 B.氢氧化铝可用于中和过多的胃酸 C.金属钠性质非常活泼,可用钠与硫酸铜溶液反应制得金属铜 D.氧化铝熔点很高,也很坚固,是一种比较好的耐火材料,可以用来制造耐火坩埚 2.歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中的“铜绿”即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜).铜在潮湿的空气中生锈的化学反应为:2Cu+O2+CO2+H2O═Cu2(OH)2CO3.下列有关该反应的说法正确的是( ) A.该反应不是氧化还原反应 B.该反应中氧元素和碳元素化合价发生变化,所以是氧化还原反应 C.该反应中铜得电子,O2失电子,所以是氧化还原反应 D.该反应是氧化还原反应,变价的只有两种元素 3.将磁性氧化铁放入稀HNO3中可发生如下反应: 3Fe3O4 + 28HNO3 = 9Fe(NO3)x + NO↑ + 14H2O.下列判断合理的是( ) A.Fe (NO3)x中的x为2 B.反应中每生成0.2 mol 还原产物,就有0.6 mol 电子转移 C.稀HNO3 在反应中只作氧化剂 D.磁性氧化铁中的铁元素全部被氧化 4.对于反应:NaH+H2O NaOH+H2↑,有下列判断:①NaOH是氧化产物;②H2只是还原产物;③H2O是氧化剂;④NaH中的氢元素被还原;⑤此反应中的氧化产物与还原产物的分子个数之比为1∶1,其中正确的是( ) A. ①③ B. ②④ C. ①④ D. ③⑤ 5. 已知I-、Fe2+、SO2、Cl- 和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应中不能发生的是( ) A. H2O2+H2SO4══SO2↑+O2↑+2H2O B. I2+SO2+2H2O══H2SO4+2HI C.2Fe2++Cl2══2Fe3++2Cl- D.2Fe3++SO2+2H2O══2Fe2++SO42-+4H+ 6.某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成。将该粉末与足量的盐酸反应有气体逸出,将气体通过足量的NaOH溶液后体积缩小一部分(同温同压下)。若将原混合物粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合物粉末的质量。下列判断正确是( ) A.粉末中一定有Na2O、Na2O2、NaHCO3 B.粉末中一定不含有Na2CO3和NaCl C.粉末中一定不含有Na2O2和NaCl D.无法肯定粉末中是否含有Na2O、Na2CO3和NaCl 7.铝分别与足量的氢氧化钠和稀盐酸溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的NaOH和HCl物质的量之比为( ) A.2:1 B.3:1 C.1:1 D.1:3 第Ⅱ卷(非选择题 共58分) 二、请按要求填空:(每空2分,共58分) 8.酒后驾车是马路上的第一大杀手。已知酒精(C2H5OH)能与K2Cr2O7和H2SO4的混合溶液在一定条件下发生如下反应: 2K2Cr2O7+3C2H5OH+8H2SO4 2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,且知Cr2O72-和Cr3+在溶液中分别显橙色和绿色,回答下列问题: (1)该反应________(填“是”或“不是”)离子反应。 (2)写出Cr2(SO4)3的电离方程式:______________________________________。 (3)该反应________(填“是”或“不是”)氧化还原反应,判断的依据是_________________________________。 (4)你认为能否用这一反应来检测司机是否酒后驾车?________(填“能”或“不能” ),简述其原理______________________________________________。 9.某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。 (1)写出装置A中发生反应的离子方程式:______________________________。 (2)装置B中最适宜的试剂是______. (3)装置D中黑色固体为_______(填名称),反应的化学方程式为: 。 (4)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是: 。 (5)按照如图装置进行实验时,首先进行的操作名称是 _____________。 (6)根据实验中的______现象,可证明CO具有还原性,有关反应的化学 方程式是 。 (7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置_______与_____之间连接下图中的________装置(填序号)。 10.用如图所表示的方法研究金属钠与水反应的性质,其中A是用带孔的铝箔包着的小块的金属钠. (1)从大块钠上取下的小块钠要用滤纸擦一擦,这样做的目的是_______________。 (2)包裹钠块的铝箔要预先扎上足够多的小孔,若孔数不够,可能出现的不良后果是 .假如在实验刚开始就将镊子松开拿出水面,A表现出的现象是 ,出现这种现象的原因是________________________________________________。 (3)据预测,钠与水反应生成氢气和氢氧化钠. 证明生成氢氧化钠的实验方法和相应的现象是______________________; (4)已知反应结束后铝箔和钠均消失,请写出相关反应的离子方程式: 11.医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量回答下列问题: 配平以下离子方程式,并用单线桥表示电子转移的方向和数目. ______ + _____ _____ _____ _____ ______ 该反应中的还原剂是 ______ . 反应转移了电子,则消耗的物质的量为 ______ mol. (4) 将一定质量的镁、铝合金投入100 mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5 mol·L-1 NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液体积关系如下图。 ①原合金中铝的质量分数是 。 ②盐酸的物质的量浓度是 。查看更多