- 2021-07-02 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
唐山市外国语学校高二期中考试理科化学(无答案)
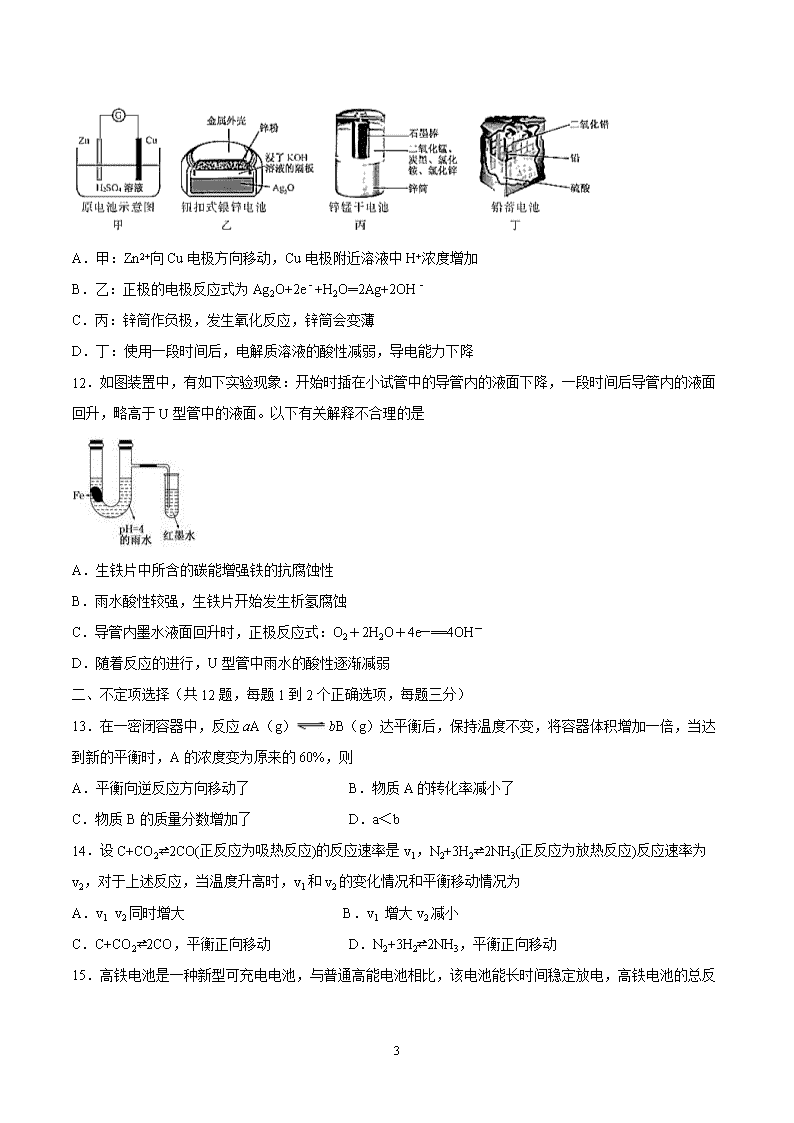
绝密★启用前 2020-2021学年度第一学期期中考试(高二年级) 理科化学试卷 满分100分,考试时间:90分钟 可能用到的原子量有: H-1 C-12 N-14 O-16 Pb-207 第I卷(60分) 一、单选题 1.下列人们在生活、生产、实验的相关措施中。不是用来调控化学反应速率的是() A.将食物存放在温度较低的地方 B.火力发电厂将烟囱建的很高 C.实验时,通常将颗粒状的固体药品研细混匀后进行反应 D.将固体试剂溶于水配成溶液后再进行化学实验 2.下列对化学反应方向的叙述,正确的是 A.室温下不能自发进行的反应,在高温下有可能自发进行 B.熵增加有利于反应的自发进行,熵减少的反应常温下都不会自发进行 C.非自发反应在任何情况下都不会发生 D.凡是放热反应都是自发的,吸热反应都是非自发的 3.在密闭容器进行如下反应:X2(g)+Y2(g)2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能( ) A.Z为0.5mol/L B.Y2为0.35mol/L C.X2为0.2mol/L D.Z为0.4mol/L 4.对已达化学平衡的下列反应 2X(g)+Y(s)2Z(g)减小压强时,对反应产生的影响是 A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 C.正、逆反应速率都减小,平衡向逆反应方向移动 D.正、逆反应速率都增大,平衡向正反应方向移动 5.下列事实中,与电化学腐蚀无关的是 A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀 B.在空气中,金属银的表面生成一层黑色物质 C.镀银铁制品,镀层部分受损后,露出的铁表面易被腐蚀 7 D. 为保护海轮的船壳,常在船壳上镶入锌块 6.当可逆反应2SO2(g)+O2(g)2SO3(g)达平衡后,通入18O2气体再次达到平衡时18O存在于( ) A.SO3中 B.O2中 C.SO2、O2、SO3中 D.O2、SO3中 7.在密闭容器中,反应2HIH2+I2 (正反应吸热),当达到平衡时,欲使混合气体颜色加深,可采取的措施有 A.减小容器体积 B.降低温度 C.加入催化剂 D.恒容下充入H2气体 8.对于反应2A+B ⇄ 3C(g),改变下列条件一定能使化学平衡向正反应方向移动的是 A.增大反应物的量 B.减小反应容器的体积 C.减少生成物浓度 D.升高温度 9.下列说法或表示方法不正确的是 A.盖斯定律实质上是能量守恒定律的体现 B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H = -57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ C.由一定条件下石墨合成金刚石吸热,可知石墨比金刚石稳定 D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H = –285.8kJ/mol 10.根据如图所示的各物质能量变化关系,判断下列热化学方程式正确的是 A.C(s,金刚石)+O2(g)===CO2(g) ΔH1=a kJ/mol(a<0) B.C(s,石墨)+O2(g)===CO2(g) ΔH2=b kJ/mol(b>0) C.C+O2===CO2(g) ΔH3=c kJ/mol(c<0) D.C(s,金刚石)===C(s,石墨) ΔH4=d kJ/mol(d>0) 11.化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是( ) 7 A.甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加 B.乙:正极的电极反应式为Ag2O+2e﹣+H2O═2Ag+2OH﹣ C.丙:锌筒作负极,发生氧化反应,锌筒会变薄 D.丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降 12.如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不合理的是 A.生铁片中所含的碳能增强铁的抗腐蚀性 B.雨水酸性较强,生铁片开始发生析氢腐蚀 C.导管内墨水液面回升时,正极反应式:O2+2H2O+4e—==4OH- D.随着反应的进行,U型管中雨水的酸性逐渐减弱 二、不定项选择(共12题,每题1到2个正确选项,每题三分) 13.在一密闭容器中,反应aA(g)bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则 A.平衡向逆反应方向移动了 B.物质A的转化率减小了 C.物质B的质量分数增加了 D.a<b 14.设C+CO2⇄2CO(正反应为吸热反应)的反应速率是v1,N2+3H2⇄2NH3(正反应为放热反应)反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况和平衡移动情况为 A.v1 v2同时增大 B.v1 增大v2减小 C.C+CO2⇄2CO,平衡正向移动 D.N2+3H2⇄2NH3,平衡正向移动 15. 7 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间稳定放电,高铁电池的总反应为。下列叙述不正确的是 A.放电时负极反应为 B.充电时阳极反应为 C.放电时每转移3mol电子,正极有1mol被氧化 D.放电时正极附近溶液的碱性增强 16.可逆反应A+B(s)C达到平衡后,无论加压或降温,A的转化率都增大,则下列结论正确的 A.A为固体,C为气体,正反应为放热反应 B.A为气体,C为固体,正反应为放热反应 C.A为气体,C为固体,正反应为吸热反应 D.A、C均为气体,正反应为吸热反应 17.在一定温度、不同压强(p1查看更多