- 2021-06-24 发布 |
- 37.5 KB |
- 20页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
辽宁省丹东市2020届高三上学期期末教学质量监测 理综试题
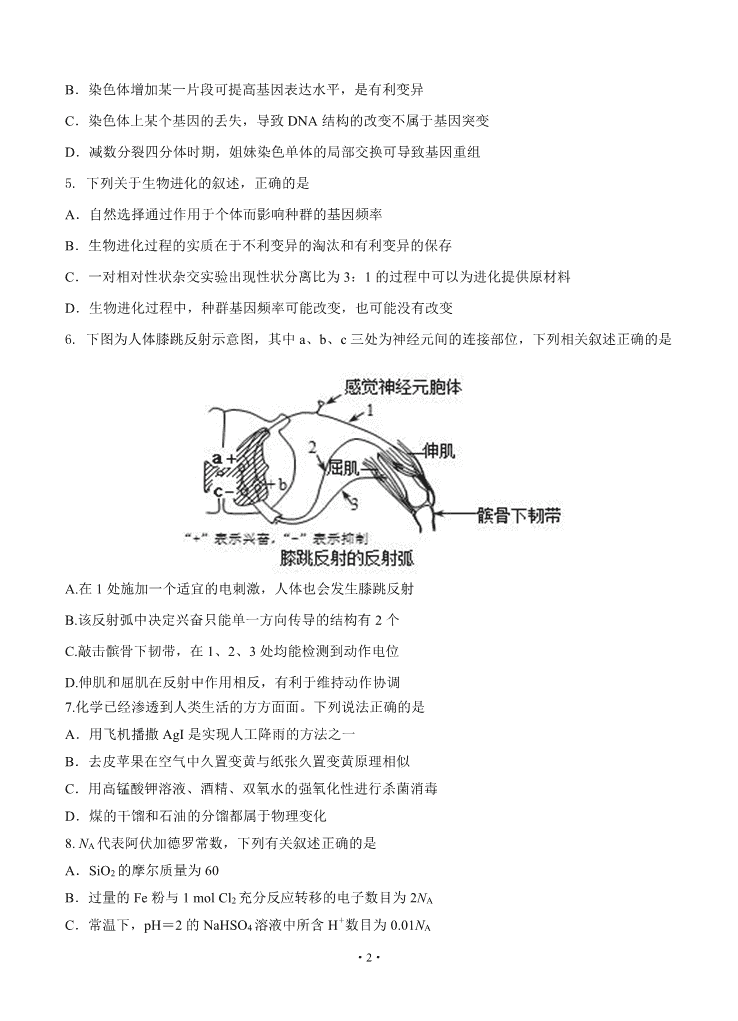
·1· 2019~2020 学年度(上)期末质量监测 高三理科综合 本试卷分第Ⅰ卷和第Ⅱ卷两部分。共 300 分,考试用时 150 分钟。 可能用到的数据 H 1 C 12 N 14 O 16 Na 23 Cl 35.5 S 32 Cu 64 第 I 卷 (选择题共 126 分) 一、选择题:本题共 13 小题,每小题 6 分,在每小题给出的四个选项中,只有一项是符合题目要求 的。 1. 下列关于细胞中有机物的叙述中,正确的是 A.组成抗体和载体的基本单位相同,但是合成方式不同 B.组成性激素和维生素 D 的基本单位相同,但是功能不同 C.组成 DNA 和 RNA 的磷酸种类相同,但是核糖种类不同 D.组成纤维素和糖原的基本单位相同,但是分布范围不同 2. 下列有关细胞结构与功能的叙述,正确的是 A.内质网参与蛋白质的合成和加工,并对其进行分类和包装 B.存在于真核细胞中的细胞骨架,能维持细胞形态并保持细胞内部结构的有序性 C.液泡中储存的营养物质与维持细胞内的渗透压无关 D.溶酶体中含有溶菌酶,能吞噬并杀死入侵细胞的多种病毒或病菌 3. 下列有关基因表达的叙述,正确的是 A.一个 DNA 分子可以转录出多种 mRNA B.所有 RNA 都可以作为蛋白质合成的模板 C.tRNA 分子中只含有与密码子互补配对的三个碱基 D.多聚核糖体的形成可以大大缩短每条肽链的合成时间 4. 下列有关生物体变异的叙述,正确的是 A.染色体组整倍性变化必然导致基因种类的增加 ·2· B.染色体增加某一片段可提高基因表达水平,是有利变异 C.染色体上某个基因的丢失,导致 DNA 结构的改变不属于基因突变 D.减数分裂四分体时期,姐妹染色单体的局部交换可导致基因重组 5. 下列关于生物进化的叙述,正确的是 A.自然选择通过作用于个体而影响种群的基因频率 B.生物进化过程的实质在于不利变异的淘汰和有利变异的保存 C.一对相对性状杂交实验出现性状分离比为 3:1 的过程中可以为进化提供原材料 D.生物进化过程中,种群基因频率可能改变,也可能没有改变 6. 下图为人体膝跳反射示意图,其中 a、b、c 三处为神经元间的连接部位,下列相关叙述正确的是 A.在 1 处施加一个适宜的电刺激,人体也会发生膝跳反射 B.该反射弧中决定兴奋只能单一方向传导的结构有 2 个 C.敲击髌骨下韧带,在 1、2、3 处均能检测到动作电位 D.伸肌和屈肌在反射中作用相反,有利于维持动作协调 7.化学已经渗透到人类生活的方方面面。下列说法正确的是 A.用飞机播撒 AgI 是实现人工降雨的方法之一 B.去皮苹果在空气中久置变黄与纸张久置变黄原理相似 C.用高锰酸钾溶液、酒精、双氧水的强氧化性进行杀菌消毒 D.煤的干馏和石油的分馏都属于物理变化 8. NA 代表阿伏加德罗常数,下列有关叙述正确的是 A.SiO2 的摩尔质量为 60 B.过量的 Fe 粉与 1 mol Cl2 充分反应转移的电子数目为 2NA C.常温下,pH=2 的 NaHSO4 溶液中所含 H+数目为 0.01NA ·3· D.标准状况下,2.24 L HF 与 1.8 g H2O 所含电子数目均为 NA 9.五种短周期元素 X、Y、Z、W、M 的原子半径逐渐减小,元素 Z 与 W 位于同一主族,W 元素所在 族形成的化合物种类最多,Y 元素的单质既能与盐酸反应也能与 NaOH 溶液反应,M 的简单氢化物 可用作制冷剂,X 的氧化物可用作耐火材料。下列说法正确的是 A.Z 的最高价氧化物能与水反应生成相应的酸 B.简单离子半径由大到小的顺序:Y>X>M C.工业上常用单质 W 还原 Y 的氧化物制取单质 Y D.化合物 XW2 中既含有离子键,也含有非极性共价键 10. 某课外实验小组设计的下列实验合理的是 11.硫元素的几种化合物存在下列转化关系: 下列判断正确的是 A.反应①中生成的 SO2 具有还原性,故可作漂白剂 B.反应④中当消耗 1mol 稀硫酸时,电子转移为 6mol C.可以用 CS2 清洗做过实验③后附着在试管壁上的硫 D.反应④生成 S 的原子利用率是 100% 12.下列关于甲、乙、丙、丁四个图像的说法中,正确的是 ·4· A.图甲表示向乙酸溶液中通入 NH3 过程中溶液导电性的变化 B.由图乙可知若除去 CuSO4 溶液中的 Fe3+可采用向溶液中加入适量 CuO 至 pH 在 4 左右 C.图丙表示 25 ℃时,用 0.1 mol·L-1 盐酸滴定 20 mL 0.1 mol·L-1 氨水,溶液的 pH 随加入盐酸体积 的变化 D.图丁表示向 Al2(SO4)3 溶液中滴入 NaOH 溶液,生成 Al(OH)3 沉淀的量随 NaOH 溶液体积的变化 13.已知 H2A 为二元弱酸,25 ℃时,用 Na2A 溶液吸收 H2A,且最终吸收 H2A 的量小于原溶液中 Na2A 的物质的量,其吸收液 pH 随nHA- nA2- 变化的关系如图所示,以下说法不正确的是 A.向 Na2A 溶液加入 H2A 过程中,水电离的 c(OH-)不断增大 B.NaHA 溶液中:c(H+)>c(OH-) C.H2A 的第二步电离常数的数量级为 10-8 D.当吸收液呈中性时:c(Na+)=2c(A2-)+c(HA-) 二、选择题:本题共 8 小题,每小题 6 分,共 48 分。在每小题给出的四个选项中,第 14~18 题只 有一项符合题目要求,第 19~21 题有多项符合题目要求。全部选对的得 6 分,选对但不全的得 3 分, 有选错的得 0 分。 14.乌镇世界互联网大会期间,百度无人驾驶汽完成了一段 3.16 公里的开放城市道路的测试。无人 驾驶汽车车头装有一个激光雷达,就像车辆的“鼻子”,随时“嗅”着前方 80m 范围内车辆和行人的气 息。无人驾驶汽车以 v≤15 m/s 的速度前进,若雷达发现前方有静止障碍物,就会启动“全力自动刹车” ·5· 安全系统自动刹车,使汽车避免与障碍物相撞。已知此安全系统在不同路况下刹车加速度大小为 5m/s2~8m/s2 之间的某一值,则此系统自动刹车的最长时间约为 A.45s B.15s C.3s D.1.87s 15.登上火星是人类的梦想,“嫦娥之父”欧阳自远透露:中国计划于 2020 年登陆火星。2019 年 10 月 11 日,中国火星探测器首次公开亮相,暂命名为“火星一号”。假设火星探测器被火星引力捕获之 后,经减速精确进入距火星表面 h 高度的圆形轨道绕火星做匀速圆周运动,“火星一号”在该轨道上 运行的周期约为 T。已知万有引力常量 G,火星半径 R,利用以上数据估算火星质量的表达式正确的 是 A. 2gR G B. 2 3 2 4 ( )R h GT C. 2 3 2 4 h GT D. 2( )g R h G 16.中子 n、质子 p、氘核 D 的质量分别为 nm 、 pm 、 Dm ,现用光子能量为 E 的γ射线照静止氘核 使之分解,反应的方程为 npD ,若分解后中子、质子的动能可视为相等,则中子的动能是 A. Ecmmm nPD 2 2 1 B. Ecmmm nPD 2 2 1 C. Ecmmm nPD 2 2 1 D. Ecmmm nPD 2 2 1 17.如图甲中所示为电场中的一条电场线,在电场线上建立坐标轴,坐标轴上 OB 间各点的电势分布 如图乙所示,则 A.在 OB 间,场强先减小后增大 B.在 OB 间,场强方向一定发生了变化 C.若一负电荷从 O 点运动到 B 点,其电势能逐渐减小 D.若从 O 点静止释放一仅受电场力作用的正电荷,则该 电荷在 OB 间一直做加速运动 18.如图所示为理想变压器,四个灯泡 L1、L2、L3、L4 都标有“4V、4W”,变压器原、副线圈匝数 比 n1:n2=4:1。要求灯泡一个都不能烧毁,假设灯泡电阻不变,则 a、b 间交流电压的有效值不能超过 ·6· A.25V B.24V C.20V D.16V 19.如图所示,在平面直角坐标系中有一个垂直纸面向里的 圆形匀强磁场,其边界过原点 O 和 y 轴上的点 a(0,L)。一 质量为 m、电荷量为 e 的电子从 a 点以初速度 v0 平行于 x 轴正方向射入磁场,并从 x 轴上的 b 点射 出磁场,此时速度方向与 x 轴正方向的夹角为 60°。下列说法中正确的是 A.电子在磁场中运动的时间为 0v L B.电子在磁场中运动的时间为 03 2 v L C.磁场区域的圆心坐标为( 2 3L , 2 L ) D.电子在磁场中做圆周运动的圆心坐标为(0,-L) 20.如图所示,一个 m=3kg 的物体放在粗糙水平地面上,从 t=0 时刻起,物体在水平力 F 作用下由 静止开始做直线运动。在 0~3s 时间内物体的加速度 a 随时间 t 的变化规律如图所示,已知物体与地 面间的动摩擦因数处处相等。则 A.在 0~3s 时间内,物体的速度先增大后减小 B.0~3s 时间内,物体所受合外力的冲量大小为 30N·s C.0~2s 时间内,水平拉力 F 的平均功率为 48w D.前 2s 内物体做匀变速直线运动,力 F 大小保持不变 21.等离子气流(由高温高压等电量的正负离子组成)由左方连续以 v0 射入 P1 和 P2 两板间的匀强磁 场中,ab 直导线与 P1、P2 相连接,线圈 A 与直导线 cd 连接。线圈 A 内部有随图乙所示的变化磁场 且规定磁场 B 正方向水平向左,如图甲所示,则下列叙述正确的是 ·7· A.0~1s 内 ab、cd 导线互相排斥 B.1~2s 内 ab、cd 导线互相吸 C.2~3s 内 ab、cd 导线互相吸引 D.3~4s 内 ab、cd 导线互相排斥 第Ⅱ卷(非选择题共 174 分) 22.(6 分)探究“加速度 a 与物体所受合力 F 关系”的实验装置如图(a)所示,打点计时器使用的 交流电频率为 50 Hz。 (a) (b) (1)实验时, 甲、乙两同学所用小车的质量不同分别为 甲m 、 乙m 。根据实验数据及相关计算。 在同一个坐标中分别得到图(b)中甲、乙两条直线。由图可知 甲m 乙m 。(填“大于”、“小于”或 “等于”) (2)图(c)是某位同学在研究小车做匀变速直线运动时,通过打点计时器获得的一条纸带。A、B、 C、D、E 为连续计数点,相邻两个计数点之间还有四个点(未标出),测出相邻计数点间的距离分 别是 s1=3.02cm、s2=5.06cm、s3=7.08cm、s4=9.12cm。则打 D 点时小车的速度为 m/s,小车的加 速度为 m/s2。(保留两三有效数字) 23.(10 分)某实验室有下列器材: A.灵敏电流计 (量程 0~10mA,内阻约 50Ω) B.电压表 (量程 0~3V,内阻约 10kΩ); C.滑动变阻器 R1( 0~100Ω,1.5A); D.电阻箱 R0(0~999Ω) E.电源 E (电动势为 5.0V,内阻未知) F.电阻、电键、导线若干 ·8· (1) 某实验小组为测量灵敏电流计的内阻,设计了如图甲所示的电路,测得电压表示数为 2V,灵 敏电流计恰好满偏,电阻箱示数为 155Ω,则灵敏电流计的内阻为 Ω。 (2)为测量电源的内阻,需将灵敏电流计改装成大量程的电流表(量程扩大 10 倍),若将电阻箱与 灵敏电流计并联,则应将电阻箱 R0 的阻值调为 Ω;调好电阻箱后,连接成图乙所示的电路测 电源的电动势和内电阻,调节滑动变阻器,读出若干组电压和灵敏电流计示数,在坐标系中做出的 U-I 图象如图丙所示,则电源的内电阻 r= Ω。(电源的内电阻保留三位有效数字) (3)将该灵敏电流计改装成量程为 0~3V 的电压表,应将灵敏电流计与阻值为 Ω的电阻串联。 对改装的电压表进行校对时发现改装的电压表的示数比标准电压表的示数大,(灵敏电流计的内电阻 测量值准确),则改装表时,实际串联的电阻阻值比由理论计算得出应该串联的电阻阻值 (填 “大”或“小”) 。 24.(11 分)如图所示,物体 A 与 B(视为质点)通过光滑轻滑轮用轻绳相连,A 放在光滑水平桌面 上。物体 B 从距地面高 H 处由静止下落,当物体 B 下落 H5 3 时,物体 B 的动能与其重力势能相等。 若重力加速度为 g,求物体 B(落地前)运动的加速度大小。(A 始终未离开桌面,取地面为零时能 面) 25.(15 分)如图所示,光滑水平台面 MN 上放两个相同小物块 A,B,右端 N 处与水平传送带理想 连接,传送带水平部分长度 L=17m,沿逆时针方向以恒定速度 v0=4m/s 匀速转动。物块 A、B(大小 均不计,视为质点)与传送带间的动摩擦因数均为μ=0.2,物块 A,B 质量均为 m=1kg。开始时 A,B 静止,A,B 间压缩一轻质短弹簧。现解除锁定,弹簧弹开 A,B,弹开后 B 滑上传送带,A 掉落到 地面上的 Q 点,已知水平台面高 h=0.8m,Q 点与水平台面左端的距离 S=3.2m,g 取 10m/s2。求: ·9· (1)物块 A 脱离弹簧时速度的大小及开始时刻弹簧储存的弹性势能; (2)物块 B 在水平传送带上运动的时间。 26.(20 分)图甲为光滑金属导轨制成的“V”字型的斜面,导轨的间距为 L=1m,左侧斜面的倾角 θ=37°,右侧斜面的中间用阻值为 R=2Ω的电阻连接。在左侧斜面区域存在垂直斜面向下的匀强磁场, 磁感应强度大小为 B1=0.5T,右侧斜面轨道及其右侧区域中存在竖直向上的匀强磁场,磁感应强度为 B2=0.5T。在右侧斜面的顶端 e、f 两点分别用等长的轻质柔软细导线连接导体棒 ab。另一导体棒 cd 置于左侧斜面轨道上,与导轨垂直且接触良好,ab 棒和 cd 棒的质量均为 m=0.2kg,ab 棒的电阻为 r1=2Ω,cd 棒的电阻(接入电路)为 r2=4Ω。已知 t=0 时刻起,cd 棒在沿斜面向下的拉力作用下由静 止开始沿斜面向下做匀加速直线运动(cd 棒始终在左侧斜面上运动),而 ab 棒在水平拉力 F 作用下始 终处于静止状态,F 随时间变化的关系如图乙所示,ab 棒静止时细导线与竖直方向的夹角θ=37°。其 中导轨的电阻不计,图中的虚线为绝缘材料 制成的固定支架。(重力加速度 g 取 10 m/s2, sin 37°=0.6,cos 37°=0.8) (1)计算 cd 棒运动的加速度大小; (2)若 t=0 时刻起,求 2s 内 cd 受到拉力 的冲量大小; (3)3s 内电阻 R 上产生的焦耳热为 2.88J,则此过程中拉力对 cd 棒做了多少功? 27.(12 分)铁是应用最广泛的金属,铁的卤化物,氧化物以及高价铁的含氧酸盐均为重要化合物。 ·10· (1)铁元素在周期表中的位置为 。 (2)要确定铁的某氯化物 FeClx 的化学式,可利用离子交换和滴定的方法。实验中称取 0.54 g 的 FeClx 样品,溶解后先进行阳离子交换预处理,再通过含有饱和 OH-的阴离子交换柱,使 Cl-和 OH-发生 交换。交换完成后,流出溶液的 OH-用 0.40 mol·L-1 的盐酸滴定,滴至终点时消耗盐酸 25.0 mL。则 x=____________。 (3)实验室用铁氰化钾确定某铁的氯化物中是否含有 FeCl2,该反应的离子方程式为 。 (4)Fe(OH)3 固体与氢碘酸反应时可生成棕色物质的离子方程式为____________。 (5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3 和 KClO 在强碱 性条件下反应可制取 K2FeO4,其反应的离子方程式为_______________。 (6)实验室准确称取 1.44g 草酸亚铁固体,在空气中灼烧,得到 0.773g 铁的氧化物,写出该铁的氧 化物的化学式 。 28.(16 分)利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革 工业污泥中 Cr(Ⅲ)的处理工艺流程如下: 已知:酸浸取液中的金属离子主要是 Cr3+,其次是 Fe3+、Al3+、Ca2+和 Mg2+等。 (1)配制 500mL4.8mol/L 的稀硫酸溶液,需要的玻璃仪器除烧杯、玻璃棒外,还需要 。 (2)酸浸时,为了提高浸取率可采取的措施有________、________。 (答出两点) (3)H2O2 的作用是将滤液Ⅰ中的 Cr3+转化为 Cr2O2- 7 ,则此反应中 氧化剂和还原剂的物质的量之比为________。控制其他条件不变, 反应温度对 Cr3+转化率的影响如右图所示。请分析温度超过 70 ℃ 时,Cr3+转化率下降的原因是__________ 。 (4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的 pH 如下: 阳离子 Fe3+ Al3+ Cr3+ 开始沉淀时的 pH 2.7 — — 沉淀完全时的 pH 3.7 5.4(>8 溶解) 9(>9 溶解) ①用 NaOH 调节溶液的 pH 不能超过 8,其理由是_____________________________。 ·11· ②当 pH=8 时,Mg2+是否开始沉淀(溶液中镁离子浓度约为 1 mol·L-1)________(填 “是”或“否”)。 已知 Ksp[Mg(OH)2]=1.8×10-11。 (5)上述流程中,加入 NaOH 溶液后,溶液呈碱性,Cr2O 2- 7 转化为 CrO2- 4 ,写出上述流程中用 SO2 进行还原反应生成 CrOH(H2O)5SO4 沉淀的离子方程式 。 (6)Cr(OH)3 和 Al(OH)3 类似,也是两性氢氧化物,写出向 CrCl3 溶液中逐滴加 NaOH 溶液至过量的 离子方程式 。 29.(16 分)根据题意请回答有关氮的氧化物和氢化物的问题: (1)随着人类社会的发展,氮氧化物的排放导致一系列问题。NO 形成硝酸型酸雨的化学方程式 为 。一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知: ①CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.1 kJ·mol-1, ②CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160.6 kJ·mol-1 则 CH4(g)+2NO2(g)==N2(g)+CO2(g)+2H2O(g) ΔH= 。 (2)肼(N2H4)可以用作燃料电池的原料。肼的电子式为 , 一种以液态肼为燃料的电池装置如图所示,该电池用空气中的氧气作为氧 化剂,KOH 溶液作为电解质溶液。b 电极是 极(填“正”或“负”),a 电极的电极反应式: 。 (3)25 ℃时,Kb(NH3·H2O)=1.8×10-5 mol·L-1,向含 a mol NH4NO3 的溶液 中滴加 b L 氨水呈中性,则所滴加氨水的浓度为 。 (4)在体积恒定的密闭容器中有可逆反应: 2NO(g)+O2(g) 2NO2(g) ΔH<0 ,NO 和 O2 的起始浓度之比为 2:1,反应经历相同时间, 测得不同温度下 NO 转化为 NO2 的转化率如右图, 则 150 ℃时,v(正) v(逆)(填“>”或“<”)。 (5)判断在恒温恒容条件下该反应已达到平衡状态的是 A.2v 正(NO2)=v 逆(O2) B.反应容器中压强不随时间变化而变化 C.混合气体颜色深浅保持不变 D.混合气体平均相对分子质量保持不变 30.(14 分)Cl2O 为国际公认的高效安全灭菌消毒剂之一,实验室可利用氯气和空气(氯气与空气体 积比为 1∶3,空气不参与反应)的混合气与含水 8%的碳酸钠反应制备,并用水吸收 Cl2O 制备次氯酸 溶液,所用实 验装置和 Cl2O 的 性质如下: ·12· (1)仪器 a 的名 称为________,所盛放的药 品是________。 (2)写出装置 A 中发生反应的离子方程式:______________________________。 (3)装置 C 的主要作用是__________________________________________________。 (4)装置 D、E 中都用到多孔球泡,其作用是_________________________________。 (5)写出装置 D 中 Cl2 与过量碳酸钠反应生成 Cl2O 的化学方程式:________。 (6)装置 E 采用棕色圆底烧瓶的原因是 。 (7)制备 Cl2O 装置中存在缺陷,请提出改进措施:___________________________。 31.(9 分)为找出更好的污染治理措施,科研人员做了相关研究。表中是对某地排污池下游河道中 几种生物的研究结果。请回答: 生物 毒素含量 ug/L 铵盐吸收率 有机物去除率 硅藻 0.1 52% 0 蓝藻 0.554 78% 0 红假单胞光合细菌 0 87% 92% (1)从生态系统的组成成分看,表中红假单胞光合细菌属于_________、_________。 (2)当排污池的下游河道受到轻微污染时,能通过__________、__________、微生物分解来消除 污染。 (3)据表分析,治理污水效果最好的生物是__________,理由是____________________。 (4)该水域中的线虫以藻类为食,鲫鱼以藻类和线虫为食。若去掉线虫,鲫鱼的总能量变化趋势 是__________,其原因是________________________________________。 颜色 棕黄色 状态 气体 气味 强刺激性 熔点 -116 ℃ 沸点 3.8 ℃ 水溶性 极易溶于水,与水反应生成次氯酸 热稳定性 42 ℃以上分解为 Cl2 和 O2 ·13· 32. (10 分)根据孟德尔的两对相对性状的杂交实验,回答下列问题: (1)在孟德尔两对相对性状的杂交实验中,F1 全为黄色圆粒,F1 自交后代 F2 表现为 9:3:3:1 的性状分离 比,据此实验孟德尔提出了对基因自由组合现象的假说,其主要内容是 F1 在产生配子时, _______________________________________ _________,并通过____________实 验验证其假说,从而总结出了该定律。 (2)有人提出孟德尔运用自交的方法也可进行验证,如下是相应的实验方案: 方法一:将 F1 进行自交,如果 F2 出现 9:3:3:1 的分离比,即可证明假说。 方法二:将 F1 自交得 F2,让 F2 植株分别自交,单株收获种子,并单独种植在一起成为一个株系。观 察并统计 F3 的性状。 认为方法一可行吗?_____________(填“可行”或“不可行”), 理由是:________________________________________________。 ②方法二实验结果分析:首先 F2 出现 9:3:3:1 的分离比。且 F2 的双显性植株自交后代中不发生性状分 离的占_______,出现 3:1 的占_____,出现 9:3:3:1 的占______;F2 单显性植株自交后代中出现性状 分离的占______,F2 中双隐性植株自交后代全部表现一致,则孟德尔的假说成立,若未出现上述情 况则不成立。 ③已知上述假设成立,发现 F2 自交得到 F3 的过程中有 1/4 比例的个体不发生性状分离;还有____ (比 例)的后代出现 3:1 的性状分离比,与该比例相对应的 F2 中共有____种基因型。 33.(10 分)下表格是黑暗和光照条件下旱冬瓜种子萌发率对比实验的结果;下图表示光照强度对不 同叶龄旱冬瓜幼苗叶片吸收 CO2 量的影响。请分析回答 (1) 早冬瓜种子萌发率实验的目的是__________________________ __。 分析表中数据可以得出的结论是____________________________________________。 (2)旱冬瓜种子萌发早期某阶段测得 CO2 释放量比 O2 吸收量多,这说明此时种子的呼吸方式是 ______________________,此时细胞内分解丙酮酸的场所是_______ _________。 ·14· (3)分析图,实验的自变量是____ ______;对 3 月龄苗的早冬瓜,限制 B 点的环境因素可能是 __________________等(至少写出两种),若光照强度在 3000Lux 持续 60s,再黑暗处理 180s,该叶 片______(填“能”或“不能”)正常生长。 (4)当光照强度为__ _Lux 时叶片的光合速率不受苗龄的影响,___ 月龄苗适于在遮阴条件下生长。 34.(10 分)糖尿病包括Ⅰ型糖尿病(胰岛素依赖型,患者体内的胰岛素含量低)和Ⅱ型糖尿病(非胰岛 素依赖型,患者体内的胰岛素含量正常或高于正常人)。下图显示胰岛 B 细胞和肝细胞在血糖平衡调 节过程中的作用。其中甲、乙、丙代表上述两种糖尿病患者的细胞,请据图回答下列问题: (1)图示内容体现了激素调节具有____________________________________特点。人体内需要源源不 断地产生激素,原因是_________________________________________。 (2)正常情况下,胰岛素会作用于图中的_____细胞,促进_____(填“a”或“b")过程等,而使血糖浓 度降低,而图中丙细胞因膜表面缺少________,而不能接受胰岛素的调节作用。 (3)图中属于Ⅰ型糖尿病患者的细胞是__________,在该患者的体液中能检测到抗胰岛 B 细胞的抗体, 原因是患者的免疫系统会将自身的胰岛 B 细胞当作_________。 (4)影响胰岛素分泌的主要因素是______________________。研究发现其一方面可以直接作用于胰岛 以调节胰岛素的分泌,此外也作用于胰岛组织中的神经末梢或血管内的感受器,反射性地引起胰岛 素分泌。因此血糖平衡的调节属于___________调节。 35.(15 分)动物被宰杀后,肉中的三磷酸腺苷(ATP) 经过降解生成对肉鲜味贡献最大的物质——肌苷酸 (IMP),但是在酸性的磷酸酶(ACP)作用下该物质会进 一步降解导致肉鲜味下降、风味变差。为了研究鱼类 ·15· 的保鲜方法,研究者欲研究 Na+、Zn2+、Ca2+对从草鱼肌肉中分离纯化得到的 ACP 活性的影响,实验 材料和操作如下(ACP 可催化磷酸苯二钠分解生成苯酚,苯酚在碱性条件下与 4—AAP 缩合,最终生 成红色化合物,通过颜色变化可测定酶活性) 实验材料:柠檬酸缓冲液(pH 为 5.0),碳酸盐缓冲液(pH 为 10.0),ACP 溶液,磷酸苯二钠溶液,不同 浓度的 Na+、Zn2+、Ca2+溶液,4—AAP 溶液等。 操作步骤:(1 )取若干洁净 的试管,用蒸馏水清洗 以去除自来水中的氯离 子,其目的是 ________________;各反应体系均加入等量的_________缓冲液,其目的是保证各反应体系的 pH 最 适宜且相同。 (2)在实验组试管中加入_____________________________、ACP 溶液、磷酸苯二钠溶液,对照组 试管加入___________________________________________。 (3)在最适温度下保温一段时间后,加入等量的碳酸盐缓冲液、________测定酶的活性。 (4)若实验得到的一组数据如下表,据表分析,对 ACP 活力有激活作用的离子是_________,可以 通过在鱼肉中添加微量的_________来抑制鱼肉鲜度的降解。 答 案 14.C 15.B 16.D 17.D 18.A 19.BCD 20.BD 21.BD 22.(6 分) (1)小于 (2 分) (2)0.81(2 分);2.0 (2 分)(两空皆保留两位) 或 0.810 ; 2.03 (两空皆保留三位) 23.(10 分) (1)45(2 分) (2)5 ;46.5 (每空 2 分) (3)255;小(每空 2 分) 24. (11 分) 解: (1) 根据系统动能定理可得 ·16· 22 2 1 2 1 vmvmghm ABB (4 分) )(2 1 2 hHgmvm BB (1 分) AB mm 2 (1 分) (2) amT A (2 分) amTgm BB (2 分) 得 ga 3 2 (1 分) 25.(15 分) 解: (1)A 作平抛运动,竖直方向: 21 2h gt , (1 分) 水平方向: As v t (1 分) 代入数据联立解得: 8 /Av m s (1 分) 解锁过程系统动量守恒,规定 A 的速度方向为正方向, 由动量守恒定律得: 0A Bmv mv , (1 分) 代入数据解得: 8 /Bv m s , (1 分) 由能量守恒定律得: 2 21 1 2 2P A BE mv mv , (1 分) 代入数据解得: 64JpE ; (1 分) (2)B 作匀变速运动,由牛顿第二定律有 mg ma , 解得 2 20.2 10 / 2 /a g m s m s ; (1 分) B 向右匀减速至速度为零,由 2 2B Bv as , (1 分) 16 17Bs m L m , (1 分) 设 B 向右匀减速的时间为 1t : 1Bv at ,解得: 1 4t s ; (1 分) 设 B 向左加速至与传送带共速的时间为 2 0 2 2 2t v at t s , , (1 分) ·17· 由 2 0 2 2v as ,解得: 2 4s m ; (1 分) 共速后做匀速运动的时间为 3t ,有: 2 0 3Bs s v t ; (1 分) 代入数据解得总时间: 1 2 3 9t t t t s ; (1 分) 26.(20 分) (1)设绳中拉力为T ,对导体棒 ab 分析,由平衡方程得: sinθF T BIl (1 分) cosθT mg (1 分) 解得: tanθ 1.5 0.5F mg BIl I (1 分) 由图乙可知: 1.5 0.2F t (1 分) 则有: 0.4I t (1 分) cd 棒上的电流为: (1 分) 设 t 时刻 cd 棒的速度为 v,则有: rR BLvI cd (1 分) 则 cd 棒运动的速度随时间变化的关系: 8v t 即 cd 棒在导轨上做 2/8 sma 的匀加速度直线运动。(1 分) (2) ab 棒上的电流为: 0.4I t 则在 2 s 内,平均电流为 0.4 A,通过的电荷量为 0.8 C,通过 cd 棒的电荷量为 1.6C (1 分) 由动量定理得: (3 分) 解得: sNI F 6.1 (1 分) (3)3 s 内电阻 R 上产生的的热量为 2.88JQ ,则 ab 棒产生的热量也为Q , cd 棒上产生的热量为8Q ,则整个回路中产生的总热量为 28.8 J,即 3 s 内克服安培力做功为 28.8J (2 分) 而重力做功为: (1 分) 对导体棒 cd ,由动能定理得: FW W 克安 2 2 G 1 02W mv (3 分) 由运动学公式可知导体棒的速度为 24 m/s 解得: JWF 2.43 (1 分) ·18· 2019~2020 学年度(上)期末质量监测 高三理科综合生物参考答案 选择题:1-6DBACAD 31.(9 分,除注明外,每空 1 分) (1)生产者 分解者 (二者无顺序要求) (2)物理沉降 化学分解 (二者无顺序要求) (3)红假单胞光合菌 不产毒素,对铵盐吸收率高,有机物的去除率高(2 分,只答出 1 点不给分,答出 2 点给 1 分,3 点 全对给 2 分) (4)增加 食物链缩短,能量消耗的少 32.答案:(10 分,每空 1 分) (1)每对遗传因子彼此分离,不同对的遗传因子可以自由组合 测交 (2)①不可行 让 F1 进行自交只是对实验进行了重复,并不能证明假说 ② 1/9 4/9 4/9 2/3 ③ 1/2 4 33.答案:(10 分,除注明外,每空 1 分) (1)探究种子萌发是否需要光照 光照是种子萌发的必要条件 (2)既进行有氧呼吸又进行无氧呼吸 细胞质基质、线粒体(2 分,缺一不可) (3)光照强度和叶龄 CO2 浓度、温度 不能 (4)0~50 3 34.答案:(10 分,除注明外,每空 1 分) (1)通过体液运输、作用于靶器官和靶细胞(2 分,答对一个给 1 分) 激素一经靶细胞接受并起作用后就被灭活了 (2)丁 a 胰岛素受体(或特异性受体) (3)甲 抗原 (4)血糖浓度 神经—体液 35.答案:(15 分,除注明外,每空 2 分) ·19· (1)排除氯离子对酶活性的影响 柠檬酸 (2)等量的不同浓度的 Na+、Zn2+、Ca2+溶液 等量的蒸馏水、ACP 溶液、磷酸苯二钠溶液(3 分) (3) 4-AAP 溶液 (4) Zn2+ Ca2+ 2019~2020 学年度(上)期末质量监测 高三化学参考答案 7.A 8.B 9.D 10.B 11.C 12B 13.A 27.(12 分,每空 2 分) (1)第四周期,第Ⅷ族 (2)3 (3)3Fe2++ 2[Fe(CN)6]3- ==2Fe3[Fe(CN)6]2 ↓ (4)2Fe(OH)3+6H+ +2I-===2Fe2++ I2+ 6H2O (5)2Fe(OH)3+ 3ClO-+ 4OH-===2FeO42-+ 5H2O + 3Cl- (或 2 Fe3++ 3ClO-+ 10OH-===2FeO42-+ 5H2O + 3Cl-) (6)Fe3O4 28.(16 分,除标注外,每空 2 分) (1)500moL 容量瓶 (1 分) 胶体滴管(1 分) (2)适当升高温度(加热) 搅拌 (答案合理即可)(每个 1 分) (3)3∶2 双氧水在较高温度下发生分解,浓度降低 (4)①pH 超过 8 会使部分 Al(OH)3 溶解生成 AlO - 2 ,最终影响 Cr 回收与再利用 ②否 (5)3SO2+2CrO 2- 4 +12H2O===2CrOH(H2O)5SO4↓+SO 2- 4 +2OH- (6)Cr3++3OH- ==Cr(OH)3↓ (1 分) Cr(OH)3+OH-== [Cr(OH)4]- [或 Cr(OH)3+OH-== CrO2 -+2H2O](1 分) 29.(16 分,每空 2 分) (1)2NO+O2 == 2NO2 3 NO2+H2O==2HNO3+NO(或 4NO+3O2+2H2O==4HNO3) ·20· -867.35 kJ·mol-1 (2) 正 N2H4+4OH--4e-===N2↑+4H2O (3) (4) > (5)BCD 30.(14 分,除标注外,每空 2 分) (1)球形干燥管 (1 分) 碱石灰 (1 分) (2)MnO2+4H++2Cl-===== △ Mn2++Cl2↑+2H2O (3)控制氯气和空气的体积比 (4)增大反应物接触面积,使反应充分进行 (5)2Cl2+2Na2CO3+H2O===2NaCl+Cl2O+2NaHCO3 (6)次氯酸光照易分解 (7)将装置 D 放在冷水浴中,以控制三颈烧瓶内的温度不超过 42 ℃查看更多