- 2021-05-14 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
崇明区高考化学二模
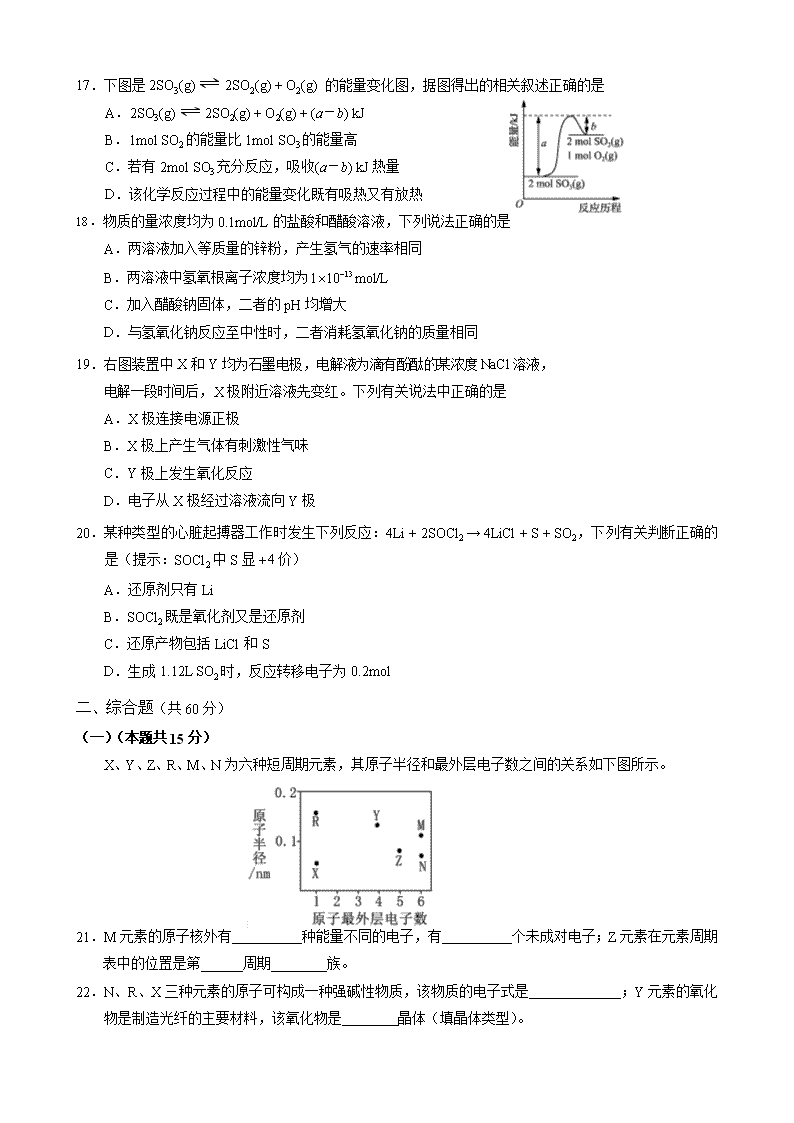
崇明区2018届第二次高考模拟考试试卷 化 学 可能用到的相对原子质量:H-1 C-12 O-16 Al-27 S-32 Cl-35.5 Ca-40 一、选择题(每小题2分,共40分,每题只有一个正确选项) 1.以下属于无机物的是 A.四氯化碳 B.石墨 C.无水醋酸钠 D.天然橡胶 2.某微粒结构示意图: ,有关该微粒的叙述正确的是 A.中子数为10 B.带12个单位正电荷 C.电子式为 D.最外层电子数为0 3.下列化工生产没有涉及氧化还原反应的是 A.工业合成氨 B.工业制纯碱 C.工业制烧碱 D.工业制盐酸 4.下列与化学键相关的叙述中正确的是 A.含共价键的化合物一定是共价化合物 B.离子化合物中一定含有离子键 C.离子键是阴阳离子的静电吸引 D.极性键与非极性键无法共存 5.下列烃的衍生物可以发生加成反应的是 A.乙醛 B.乙酸 C.乙醇 D.乙酸乙酯 6.生活中的下列应用,没有发生化学变化的是 A.氯气用作自来水的消毒剂 B.用醋酸除去热水瓶中水垢 C.二氧化硫用作纸浆漂白剂 D.活性炭用作卫生间除臭剂 7.少量金属钠投入下列试剂中,反应最缓慢的是 A.蒸馏水 B.0.1mol/L盐酸 C.0.1mol/L NaOH溶液 D.无水乙醇 8.下列气体能用浓硫酸干燥的是 A.SO2 B.SO3 C.HI D.H2S 9.同一短周期元素X、Y、Z、W形成的最高价含氧酸的酸性依次增强,下列有关叙述正确的是 A.单质沸点:X<Y<Z<W B.气态氢化物的稳定性:X>Y>Z>W C.原子序数:X>Y>Z>W D.最高正价:X<Y<Z<W 10.下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是 A.Na2O2和H2O B.Al和NaOH溶液 C.食盐和浓硫酸共热 D.铜片和浓硫酸共热 11.某学生配制 NaOH溶液时浓度偏小了,可能的原因是 A.容量瓶中有残留水 B.称好的NaOH发生潮解 C.漏掉洗涤操作步骤 D.摇匀后液面低于刻度线 12.下列装置或原理能达到实验目的的是 A.制取Cl2 B.除去Cl2中的HCl C.氯气的尾气处理 D.测氯水的pH 13.有7瓶氯盐溶液,阳离子分别是、、、、、、等离子的溶液,只用一种试剂即可鉴别,该试剂可能是 A.KMnO4溶液 B.KSCN溶液 C.NaOH溶液 D.NH3 · H2O溶液 14.反应A(g) + 3B(g) ⇌2C(g) + 2D(g) 在四种不同情况下的反应速率分别为: ①、 ②、 ③、 ④,该反应进行的快慢顺序为 A.①>③=②>④ B.①>②=③>④ C.②>①=④>③ D.①>④>②=③ 15.有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是 A.+→+ H2O B.Cl2 + H2O ⇌ H+++ HClO C.+→ CO2↑+H2O D.Ag++→ AgCl↓ 16.向如图所示装置中缓慢通入气体X,若打开活塞K,则品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊。X和Y可能是 选项 A B C D X SO2 Cl2 HCl Cl2 Y NaOH 溶液 饱和NaHCO3 溶液 饱和NaCl 溶液 Na2SO3 溶液 17.下图是2SO3(g) ⇌ 2SO2(g) + O2(g) 的能量变化图,据图得出的相关叙述正确的是 A.2SO3(g) ⇌ 2SO2(g) + O2(g) + (a-b) kJ B.1mol SO2的能量比1mol SO3的能量高 C.若有2mol SO3充分反应,吸收(a-b) kJ热量 D.该化学反应过程中的能量变化既有吸热又有放热 18.物质的量浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是 A.两溶液加入等质量的锌粉,产生氢气的速率相同 B.两溶液中氢氧根离子浓度均为mol/L C.加入醋酸钠固体,二者的pH均增大 D.与氢氧化钠反应至中性时,二者消耗氢氧化钠的质量相同 19.右图装置中X和Y均为石墨电极,电解液为滴有酚酞的某浓度NaCl溶液, 电解一段时间后,X极附近溶液先变红。下列有关说法中正确的是 A.X极连接电源正极 B.X极上产生气体有刺激性气味 C.Y极上发生氧化反应 D.电子从X极经过溶液流向Y极 20.某种类型的心脏起搏器工作时发生下列反应:4Li + 2SOCl2 → 4LiCl + S + SO2,下列有关判断正确的是(提示:SOCl2中S显价) A.还原剂只有Li B.SOCl2既是氧化剂又是还原剂 C.还原产物包括LiCl和S D.生成1.12L SO2时,反应转移电子为0.2mol 二、综合题(共60分) (一)(本题共15分) X、Y、Z、R、M、N为六种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。 21.M元素的原子核外有 种能量不同的电子,有 个未成对电子;Z元素在元素周期表中的位置是第 周期 族。 22.N、R、X三种元素的原子可构成一种强碱性物质,该物质的电子式是 ;Y元素的氧化物是制造光纤的主要材料,该氧化物是 晶体(填晶体类型)。 某化工生产的核心环节的反应为:2MN2(g) + N2(g) ⇌ 2 MN3(g) + Q(Q>0) 23.该反应的平衡常数表达式 ;欲使K值变大,可采取的措施是 。 24.该反应达到平衡后,在其他条件不变的情况下,若使得容器的体积扩大为原来的两倍,则平衡 。(选填“正向移动”、“逆向移动”或“不移动”) (二)(本题共15分) NH4Al(SO4)2是常见的焙烤食品添加剂;NH4HSO4在医药、电子工业中用途广泛。 请回答下列问题: 25.相同条件下, NH4Al(SO4)2中 (填“等于”“大于”或“小于”) NH4HSO4中。 NH4Al(SO4)2溶液的pH随温度变化的曲线如图甲所示: 26.图甲中符合 NH4Al(SO4)2的pH随温度变化的曲线是 (填字母)。 27.向100mL NH4Al(SO4)2溶液中滴入90ml NaOH溶液,产生白色沉淀 克。 28.写出NH4HSO4溶液中滴加足量NaOH溶液的化学方程式 ; 25℃时,向100mL NH4HSO4溶液中 滴加 NaOH溶液,得到的溶液pH与NaOH 溶液体积的关系曲线如图乙所示。 29.试分析图乙中a、b、c、d四个点,水的电离程度 最大的是 。 (三)(本题共15分) 资料显示:久置于潮湿环境中的漂白粉受热生成O2和少量Cl2;干燥的漂白粉加热后发生 反应Ca(ClO)2CaCl2 + O2↑。 学生甲利用下图装置进行实验:加热A中试管内装有的潮湿漂白粉样品时,观察到B中有大量气泡产生。 NaOH溶液 30.B中发生反应的离子方程式为 。 31.请写出实验室检验氯气的方法: 。 学生乙设计实验测定某干燥漂白粉样品中次氯酸钙的百分含量。实验步骤如下: ①称量坩埚的质量,为W1g。 ②坩埚中加入样品后再称,质量为W2g。 ③重复进行加热、冷却、称量,直到恒重,质量为W3g。 32.称量所用仪器名称为 ; 实验到达恒重的判断依据是 。 33.该漂白粉样品中次氯酸钙的百分含量为 (用W1、W2、W3表示); 若所用坩埚内壁沾有受热易分解的物质,则该实验测得的结果 。(选填“偏大”、“偏小”或“无影响”) (四)(本题共15分) 杨梅醛是常用的水果型食用香精,其合成路线如下: 已知:(CH3CO)2O是乙酸酐,也可写成 。 请回答下列问题: 34.写出反应类型:① ;③ 。 35.写出反应②的化学方程式: 。 36.写出两种符合下列条件的 的同分异构体: i. 含有苯环 ii. 含有醛基: 。 37.以下是检验ClCH2COOH中氯元素的实验方案,请把它补充完整。 取少量ClCH2COOH置于试管中, ,加热, , 滴加硝酸银溶液,观察是否产生白色沉淀。 38.根据上述合成路线,设计以CH3COOH和 为原料制备 的合成路线 (其它试剂任选)。 (合成路线常用的表示方式为: ) 参考答案 一、 选择题 1 2 3 4 5 6 7 8 9 10 B C B B A D D A D A 11 12 13 14 15 16 17 18 19 20 C A C D B B D C C A 二、综合题 (一)(本题共15分) 21.5 (1分) 2 (1分) 二(1分) ⅤA (1分) 22.(2分) 原子(2分) 23.[SO3]2/{ [SO2]2·[O2] } 或[MN3]2/{ [MN2]2·[N2] }(2分) 降温(2分) 24.逆向移动 (3分) (二)(本题共15分) 25.小于 (3分) 26.A (3分) 27.0.39g (3分) 28.NH4HSO4+NaOH → NH3·H2O+Na2SO4+H2O (3分) 29.a (3分); (三)(本题共15分) 30.Cl2+2OH—→Cl—+ClO—+H2O (3分)。 31.用湿润的KI淀粉试纸检验,若试纸变蓝,说明是氯气。(3分) 32.电子天平 (2分) 连续两次加热、冷却、称量的结果相差≤0.001g(2分) 33.(2分) 偏大 (3分) (四)(本题共15分) 34.取代(2分);取代(2分) 35.ClCH2COOH + CH3CH2OH ClCH2COOCH2CH3 + H2O(3分) 36.(任写两种,2分) 37.加入NaOH溶液(1分),加入过量硝酸(1分) 38.(4分)查看更多