- 2021-05-14 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考天津综合化学部分及答案
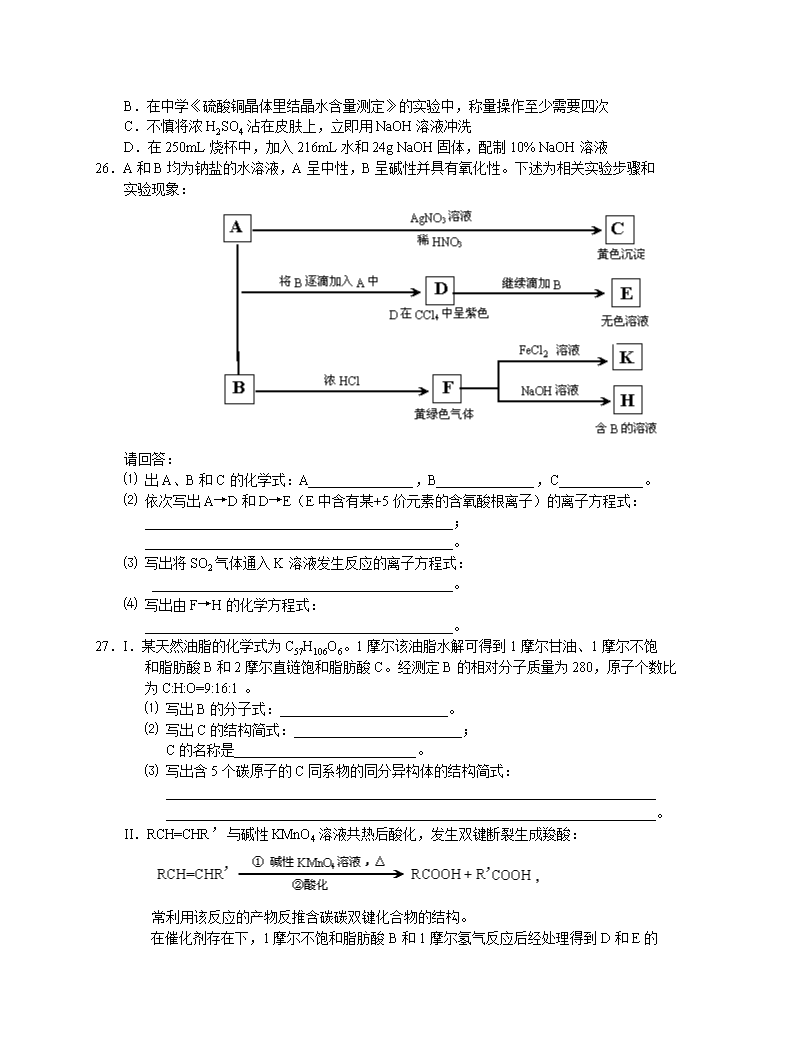
2005年高考天津理综化学部分及答案 7.下列说法正确的是 A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体; 甲醇、乙二醇和丙三醇互为同系物 B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 C.HI的相对分子质量大于HF,所以HI的沸点高于HF D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有 共价键的离子型化合物 8.下列各组离子在溶液中能大量共存的是 A.酸性溶液Na+、K+、MnO4—、Br— B.酸性溶液Fe3+、NH4+、SCN—、NO3— C.碱性溶液Na+、K+、AlO2—、SO42— D.碱性溶液Ba2+、Na+、CO32—、Cl— 9.在密闭容器中,在一定条件下,进行下列反应: NO(g) + CO(g) 1/2N2(g) + CO2(g);△H = -373.2 KJ/mol,达到平衡后,为提高该 反应的速率和NO的转化率,采取的正确措施是 A.加催化剂同时升高温度 B.加催化剂同时增大压强 C.升高温度同时充入N2 D.降低温度同时增大压强 10.下列除杂质的方法不可行的是 A.用过量氨水除去Al3+溶液中的少量Fe3+ B.将混合气体通过灼热的铜网除去N2中的少量O2 C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 D.用盐酸除去AgCl中少量的Ag2CO3 11.下列叙述正确的是 A.反应Na2O2 + 2HCl == 2NaCl + H2O2 为氧化还原反应 B.反应 仅涉及消去反应类型 C.10mL 0.02mol/L AgNO3溶液与10mL 0.02mol/L HCl溶液混合后,溶液的pH=2 (设溶液总体积不变) D.10mL 0.04mol/L HCl溶液与10mL 0.02mol/L Na2CO3溶液混合后,溶液的pH=7 (设溶液总体积不变) 12.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的 镍,下列叙述正确的是 (已知:氧化性Fe2+<Ni2+<Cu2+) A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— == Ni B.电解过程中,阳极质量的减少与阴极质量的增加相等 C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ D.电解后,电解槽底部的阳极泥中只有Cu和Pt 13.下列实验操作或事故处理中,正确的做法是 A.银镜反应实验后附有银的试管,可用稀H2SO4清洗 B.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次 C.不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗 D.在250mL烧杯中,加入216mL水和24g NaOH固体,配制10% NaOH溶液 26.A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和 实验现象: 请回答: ⑴ 出A、B和C的化学式:A_______________,B______________,C____________。 ⑵ 依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式: ____________________________________________; ____________________________________________。 ⑶ 写出将SO2气体通入K溶液发生反应的离子方程式: ___________________________________________。 ⑷ 写出由F→H的化学方程式: ____________________________________________。 27.I.某天然油脂的化学式为C57H106O6。1摩尔该油脂水解可得到1摩尔甘油、1摩尔不饱 和脂肪酸B和2摩尔直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比 为C:H:O=9:16:1。 ⑴ 写出B的分子式:________________________。 ⑵ 写出C的结构简式:________________________; C的名称是__________________________。 ⑶ 写出含5个碳原子的C同系物的同分异构体的结构简式: ______________________________________________________________________ ______________________________________________________________________。 II.RCH=CHR’与碱性KMnO4溶液共热后酸化,发生双键断裂生成羧酸: 常利用该反应的产物反推含碳碳双键化合物的结构。 在催化剂存在下,1摩尔不饱和脂肪酸B和1摩尔氢气反应后经处理得到D和E的 混合物,D和E互为同分异构体。当D和E的混合物与碱性KMnO4溶液共热后酸化, 得到如下四种产物: HOOC—(CH2)10—COOH CH3—(CH2)7—COOH HOOC—(CH2)7—COOH CH3—(CH2)4—COOH ⑷ 写出D和E的结构简式:______________________________________________ ____________________________________________________________________。 ⑸ 写出B的结构简式:_________________________________。 ⑹ 写出天然油脂A的一种可能结构简式: ___________________________________________________。 28.根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是: 将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30—35℃,搅拌下分批加入研细 的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量 蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,得Na2CO3固体。 四种盐在不同温度下的溶解度(g/100g水)表 温度 盐 溶解度 0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃ 100℃ NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 39.8 NH4HCO3 11.9 15.8 21.0 27.0 —① — — — NaHCO3 6.9 8.1 9.6 11.1 12.7 14.5 16.4 — NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.3 77.3 ①> 35℃NH4HCO3会有分解 请回答: ⑴ 反应温度控制在30—35℃,是因为若高于35℃,则_____________________________, 若低于30℃,则_____________________________,为控制此温度范围,采取的加热方法 为_________________。 ⑵ 加料完毕后,继续保温30分钟,目的是________________________________________。 静置后只析出NaHCO3晶体的原因是___________________________________________。 用蒸馏水洗涤NaHCO3晶体的目的是除去_______________杂质(以化学式表示) ⑶ 过滤所得的母液中含有___________________________(以化学式表示),需加入_______, 并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl ⑷ 测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水 溶解,加1—2滴酚酞指示剂,用物质的量浓度为c( mol/L)的HCl溶液滴定至溶液由 红色到无色(指示CO32—+H+==HCO3—反应的终点),所用HCl溶液的体积为V1 mL,再 加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积 为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式: NaHCO3% = ______________________________。 29.磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在3.2g的氧气中燃烧, 至反应物耗尽,并放出X KJ热量。 ⑴ 通过计算确定反应产物的组成(用化学式表示)是____________________,其相应的 质量(g)为________________。 ⑵ 已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O5 的反应热 △H = ________________。 ⑶ 写出1mol P与O2反应生成固态P2O3 的热化学反应方程式: __________________________________________。 答案: 7.D 8 C 9 B 10 A 11 C 12 D 13 B 26.⑴ NaI NaClO AgI ⑵ 2I— + ClO— + H2O == I2 + Cl— + 2OH— I2 + 5ClO— + 2OH— == 2IO3—+ 5Cl— + H2O ⑶ 2Fe3+ + SO2 + 2H2O == 2Fe2+ + SO42— + 4H+ ⑷ Cl2 + 2NaOH == NaCl + NaClO + H2O 27.⑴ C16H32O2 ⑵ CH3—(CH2)16—COOH 硬脂酸(或十八烷酸、十八酸) ⑶ CH3CH2CH2CH2COOH CH3CH2CH(CH3)COOH CH3CH(CH3) CH2COOH (CH3)3CCOOH ⑷ CH3(CH2)7—CH==CH—(CH2)7—COOH CH3(CH2)4—CH==CH—(CH2)10—COOH ⑸ CH3(CH2)4—CH==CH—CH2—CH==CH—(CH2)7—COOH 28.⑴ NH4HCO3分解 反应速率降低 水浴加热 ⑵ 使反应充分进行 NaHCO3的溶解度最小 NaCl NH4Cl NH4HCO3 ⑶ NaHCO3 NaCl NH4Cl NH4HCO3 HCl ⑷ 29.⑴ P2O3 P2O5 2.75 3.55 ⑵ -(20X-Y) KJ/mol ⑶ P(s) + 3/4O2(g) == 1/2 P2O3(s);△H = -(20X-Y) KJ/mol查看更多