(新课标)广西2020高考化学二轮复习 题型六 化学反应速率与化学平衡专项练
1
题型六 化学反应速率与化学平衡
1.80 ℃时,在 2 L 密闭容器中充入 0.40 mol N2O4,发生反应 N2O4(g) 2NO2(g) ΔH=+Q kJ·mol-
1(Q>0),获得如下数据:
时间/s 0 20 40 60 80 100
0.00 0.12 0.20 0.26 0.30 0.30
下列判断正确的是( )
A.升高温度该反应的平衡常数 K 减小
B.20~40 s 内,v(N2O4)=0.004 mol·L-1·s-1
C.反应达平衡时,吸收的热量为 0.30Q kJ
D.100 s 时再通入 0.40 mol N2O4,达到新平衡时 N2O4 的转化率增大
答案 C
解析该反应为吸热反应,升高温度,平衡向正反应方向移动,平衡常数 K 增大,A 错误。20~40 s
内,v(NO2)= =
=0.004 mol·L-1·s-1,v(N2O4)=
v(NO2)=0.002 mol·L-1·s-1,B 错误。浓度不变时,说明反应已达平衡,此时,生成 NO2 0.30
mol·L-1×2 L=0.60 mol,由热化学方程式可知,生成 0.6 mol NO2 吸收热量 0.3Q kJ,C 正确。100
s 时再通入 0.40 mol N2O4,相当于增大压强,平衡逆向移动,N2O4 的转化率减小,D 错误。
2.某密闭容器中充入等物质的量的 A 和 B,一定温度下发生反应 A(g)+xB(g) 2C(g),达到平衡后,
在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别
随时间的变化如图所示:
图 1
图 2
2
下列说法中正确的是( )
A.30~40 min 内该反应使用了催化剂
B.化学方程式中的 x=1,正反应为吸热反应
C.30 min 时降低温度,40 min 时升高温度
D.8 min 前 A 的平均反应速率为 0.08 mol·L-1·min-1
答案 D
解析由图 1 知,A、B 的浓度变化相同,故 A、B 的化学计量数相同,都为 1;由图 2 知,30 min 时改变
的条件为减小压强,40 min 时改变的条件为升高温度,且升高温度平衡向逆反应方向移动,则正反应
为放热反应,A、B、C 错误。8 min 前 A 的平均反应速率为 v(A)= =0.08 mol·L-
1·min-1,D 正确。
3.(2018 四川绵阳模拟)在一定温度下,将等量的气体 Z 分别通入起始容积相同的密闭容器Ⅰ和Ⅱ中,
使其发生反应,t0 时容器Ⅰ中达到化学平衡,X、Y、Z 的物质的量的变化如图所示。则下列有关推断
正确的是( )
A.该反应的化学方程式为 3X+2Y 2Z
B.若两容器中均达到平衡时,两容器的体积 V(Ⅰ)
”或“=”)。
图 2
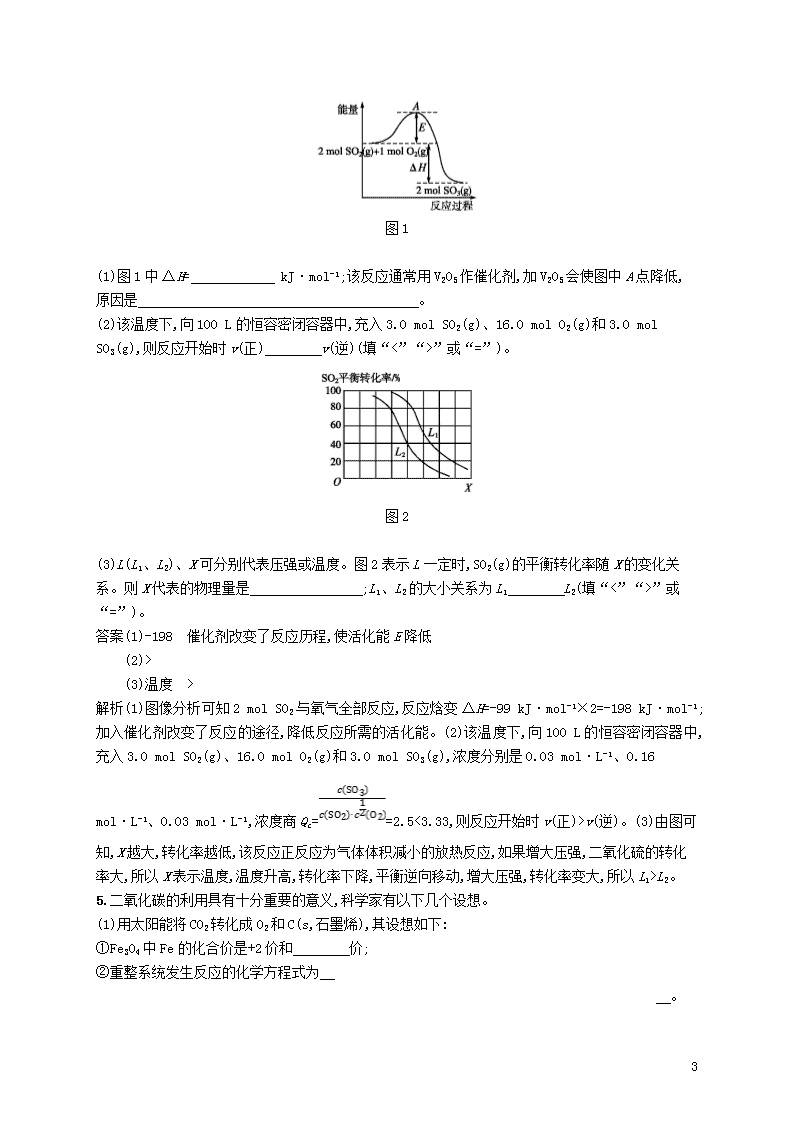
(3)L(L1、L2)、X 可分别代表压强或温度。图 2 表示 L 一定时,SO2(g)的平衡转化率随 X 的变化关
系。则 X 代表的物理量是 ;L1、L2 的大小关系为 L1 L2(填“<”“>”或
“=”)。
答案(1)-198 催化剂改变了反应历程,使活化能 E 降低
(2)>
(3)温度 >
解析(1)图像分析可知 2 mol SO2 与氧气全部反应,反应焓变 ΔH=-99 kJ·mol-1×2=-198 kJ·mol-1;
加入催化剂改变了反应的途径,降低反应所需的活化能。(2)该温度下,向 100 L 的恒容密闭容器中,
充入 3.0 mol SO2(g)、16.0 mol O2(g)和 3.0 mol SO3(g),浓度分别是 0.03 mol·L-1、0.16
mol·L-1、0.03 mol·L-1,浓度商 Qc= =2.5<3.33,则反应开始时 v(正)>v(逆)。(3)由图可
知,X 越大,转化率越低,该反应正反应为气体体积减小的放热反应,如果增大压强,二氧化硫的转化
率大,所以 X 表示温度,温度升高,转化率下降,平衡逆向移动,增大压强,转化率变大,所以 L1>L2。
5.二氧化碳的利用具有十分重要的意义,科学家有以下几个设想。
(1)用太阳能将 CO2 转化成 O2 和 C(s,石墨烯),其设想如下:
①Fe3O4 中 Fe 的化合价是+2 价和 价;
②重整系统发生反应的化学方程式为
。
4
(2)二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一密闭容器中分别投入 1 mol CO2、3 mol
H2,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时 H2
的物质的量变化关系如图所示。
①其他条件不变,起始时若按 1 mol CO2、2 mol H2 进行投料,CO2 转化率将 (填“增
大”“减小”或“不变”);
②ΔH 0(填“>”“<”或“不能确定”);
③若测试中体系内无氧气产生,试结合图示推断热稳定性 C2H4 H2O(填“>”“<”或“不能
确定”)。
(3)用氨水吸收 CO2 制化肥(NH4HCO3)。
①已知:NH3·H2O(aq) N (aq)+OH-(aq) ΔH1=a kJ·mol-1
CO2(g)+H2O(l) H2CO3(aq) ΔH2=b kJ·mol-1
H2CO3(aq)+OH-(aq) HC (aq)+H2O(l) ΔH3=c kJ·mol-1
则利用 NH3·H2O 吸收 CO2 制备 NH4HCO3 的热化学方程式
为 ;
②已知常温下相关数据如表:
Kb(NH3·H2O) 2×10-5
Ka1(H2CO3) 4×10-7
Ka2(H2CO3) 4×10-11
则反应 N +HC +H2O NH3·H2O+H2CO3 的平衡常数 K= 。
答案(1)①+3 ②6FeO+CO2 2Fe3O4+C(s,石墨烯)
(2)①减小 ②< ③<
(3)①NH3·H2O(aq)+CO2(g) N (aq)+HC (aq)
ΔH=(a+b+c) kJ·mol-1 ②1.25×10-3
解析(1)①四氧化三铁中铁元素以+2、+3 价存在。②根据原理,重整系统中加入 FeO 和 CO2,生成石
墨烯和 Fe3O4,配平即可。(2)①现在通入 1 mol CO2 和 2 mol H2,相当于在原来的基础上减少了氢气
5
的量,平衡向逆反应方向进行,CO2 转化率减小。②随着温度升高,氢气的物质的量增大,说明平衡向
逆反应方向进行,正反应为放热反应,ΔH<0。③根据图示,如果乙烯的稳定性强于水,则会产生氧气,
现在体系中没有氧气,乙烯的稳定性弱于水。(3)①将题给 3 个热化学方程式相加得出
NH3·H2O(aq)+CO2(g) N (aq)+HC (aq) ΔH=(a+b+c) kJ·mol-1。②根据反应,平衡常数 K=
,分子分母同乘以 c(H+)×c(OH-),得出:K= =1.25×10-3。
6.用 CO2 来生产燃料甲醇是工业上一种有效开发利用 CO2 的方法。为探究反应原理,进行如下实验,
在体积为 1 L 的恒容密闭容器中,充入 1 mol CO2 和 3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得 CO2 和 CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,CO2 的平均反应速率 v(CO2)= mol·L-1·min-1。
(2)氢气的转化率= 。
(3)求此温度下该反应的平衡常数 K= 。
(4)下列措施中能使平衡体系中 增大的是 。
A.将 H2O(g)从体系中分离出去
B.充入 He(g),使体系压强增大
C.升高温度
D.再充入 1 mol H2
(5)当反应达到平衡时,CO2 的物质的量浓度为 c1,然后向容器中再加入一定量 CO2,待反应再一次达
到平衡后,CO2 的物质的量浓度为 c2,则 c1 c2(填“>”“<”或“=”)。
答案(1)0.075 (2)75% (3)5.33 (4)AD (5)<
解析(1)利用“三段式”法列式计算
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
1 3 0 0
0.75 2.25 0.75 0.75
0.25 0.75 0.75 0.75
6
v(CO2)= =0.075 mol·L-1·min-1。(2)氢气的转化率= ×100%=75%。(3)K=
=5.33。(4)要使 增大,应使平衡向正反应方向移动。将
H2O(g)从体系中分离,平衡向正反应方向移动,A 正确。充入 He(g),使体系压强增大,但平衡不移动,
不变,B 错误。因正反应放热,升高温度平衡向逆反应方向移动,则 减小,C
错误。再充入 1 mol H2,相当于增大压强,平衡向正反应方向移动,则 增大,D 正确。(5)
向容器中再加入一定量 CO2,c(CO2)增大,平衡虽向右移动,但浓度增大的结果不变,故 c1”“=”或“<”)。
(4)反应①按照相同的物质的量投料,测得 CO 在不同温度下的平衡转化率与压强的关系如图所示。
下列说法正确的是 (填字母)。
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
答案Ⅰ.(1)2c-a (2)CD
Ⅱ.(1)吸热 (2)K1·K2 (3)> (4)C
解析Ⅰ.(1)根据盖斯定律,③×2-①得④2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH4=(2c-a) kJ·mol-
1。(2)单位时间内生成 1 mol NO2 的同时消耗了 1 mol NO,都是正反应,不能说明达到平衡状态,A
错误。密度= ,总质量一定,容积一定,密度不变,故混合气体的密度保持不变不能说明达到平衡
状态,B 错误。NO2 气体为红棕色,混合气体颜色不变,即 c(NO2)不变,说明达到平衡状态,C 正确。在
恒温恒压的容器中,NO 的体积分数保持不变,能说明达到平衡状态,D 正确。
Ⅱ.(1)反应②的平衡常数随温度升高增大,说明升高温度平衡正向移动,正反应是吸热反应。
(2)反应①+②得到反应③,可得平衡常数 K3=K1·K2;(3)500 ℃时,测得反应③在某时刻 H2(g)、
CO2(g)、CH3OH(g)、H2O(g)的浓度分别为 0.8 mol·L-1、0.1 mol·L-1、0.3 mol·L-1、0.15
mol·L-1,Q= =0.88v(逆)。(4)根据反应①中温度与
K 的关系知该反应为放热反应,升高温度,平衡左移,CO 的转化率减小,所以 T3>T2>T1,A 错误。反应
速率 v(c)>v(a),v(b)>v(d),B 错误。温度越高,平衡常数越小,压强对平衡常数无影响,所以
K(a)>K(c),K(b)=K(d),C 正确。