- 2021-05-13 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
(浙江专版)备战2020高考化学一轮复习 加试题增分练 特训2 化学平衡简答作图
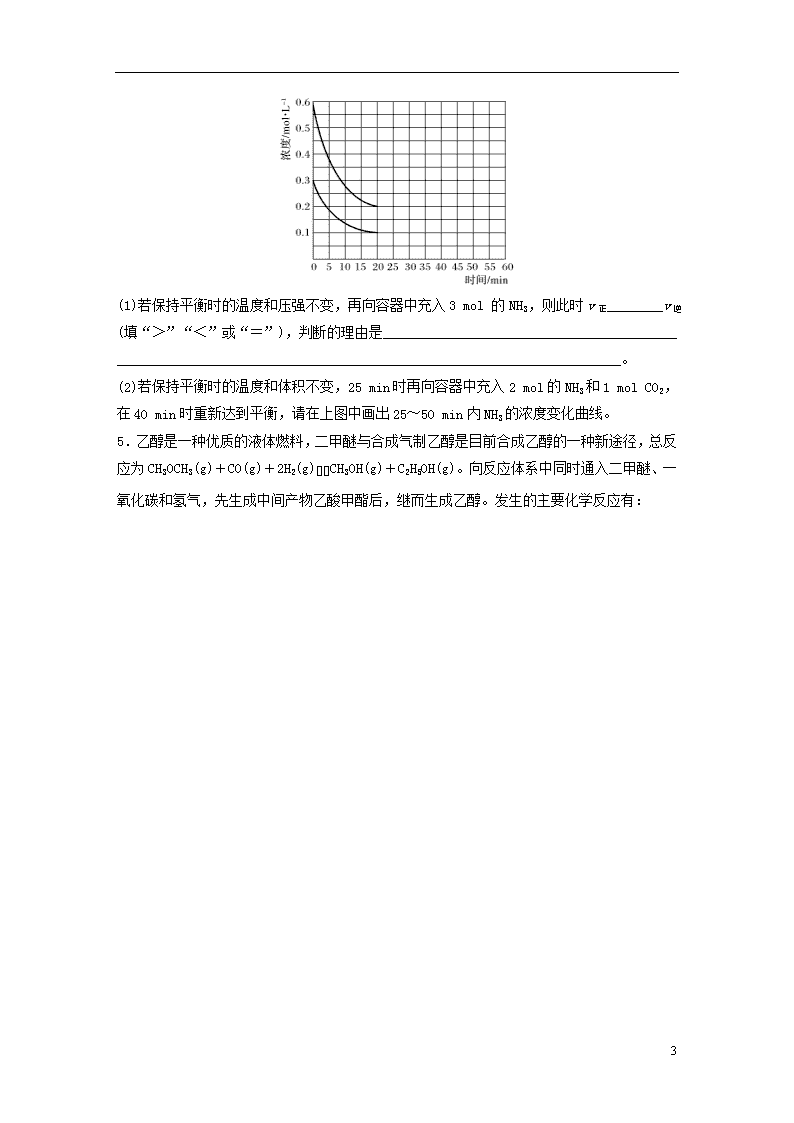
特训2 化学平衡简答作图 1.在某温度下,反应2Cu(s)+Cl2 (g)2CuCl(s) ΔH1=-36 kJ·mol-1达到平衡状态,在tl时,增加压强到原来的两倍(Cu的量足够),在图中画出Cl2浓度的变化趋势线。 2.丙烯是重要的有机化工原料,丁烯催化裂解法是一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。反应如下: Ⅰ主反应:3C4H8(g)4C3H6(g) ΔH1 Ⅱ副反应:C4H8(g)2C2H4(g) ΔH2 以ZSM-5分子筛作为催化剂,测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T) 和压强(p)变化的趋势分别如图1和图2所示: 8 (1)图2中,随压强增大,平衡体系中丙烯的质量分数呈上升趋势,从平衡角度解释其原因是________________________________________________________________________。 (2) 在恒温恒容体系中,充入一定量的丁烯,转化率随时间的变化如图3。在实际生产中,通常在恒压条件下以氮气作为反应体系的稀释剂,请在下图中画出恒压条件下丁烯的转化率随时间变化的曲线。 3.在恒定温度下,一个体积固定为1 L的容器中加入20 g CaO和一定量的CO2气体,在10分钟达平衡的过程中CO2浓度变化如图所示,若保持平衡时的温度不变,15分钟时将体积迅速增大至2 L,在20分钟时重新达到平衡,请在图中补充体积变化后CO2浓度变化示意图。 4.工业合成尿素的反应如下:2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(l) ΔH<0 某实验小组模拟工业合成尿素的条件,在恒定温度下,将NH3和CO2按2∶1的物质的量之比充入一体积为10 L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20 min达到平衡,各物质的浓度变化曲线如下图所示。 8 (1)若保持平衡时的温度和压强不变,再向容器中充入3 mol 的NH3,则此时v正________v逆(填“>”“<”或“=”),判断的理由是__________________________________________ ________________________________________________________________________。 (2)若保持平衡时的温度和体积不变,25 min时再向容器中充入2 mol的NH3和1 mol CO2,在40 min时重新达到平衡,请在上图中画出25~50 min内NH3的浓度变化曲线。 5.乙醇是一种优质的液体燃料,二甲醚与合成气制乙醇是目前合成乙醇的一种新途径,总反应为CH3OCH3(g)+CO(g)+2H2 (g)CH3OH(g)+C2H5OH(g)。向反应体系中同时通入二甲醚、一氧化碳和氢气,先生成中间产物乙酸甲酯后,继而生成乙醇。发生的主要化学反应有: 8 反应过程 化学方程式 不同温度下的K 273.15 K 1 000 K Ⅰ 二甲醚羰基化反应 CH3OCH3(g)+CO(g)CH3COOCH3(g) 1016.25 101.58 Ⅱ 乙酸甲酯加氢反应 CH3COOCH3(g)+2H2(g)CH3OH(g)+C2H5OH(g) 103.97 10-0.35 回答下列问题: (1)在压强为1 Mpa的条件下,温度对二甲醚和乙酸甲酯平衡转化率影响如图1所示,温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图2所示。观察图2可知乙酸甲酯含量在300~600 K范围内发生的变化是_________________________________________________, 简要解释产生这种变化的原因_______________________________。 (2)将CH3OCH3(g)和CO(g)按物质的量之比1∶1充入密闭容器中发生羰基化反应,温度为T时,反应进行到不同时间测得各物质的浓度如下: 时间(min) 浓度(mol·L-1) 0 10 20 30 40 50 8 CH3OCH3(g) 2.00 1.80 1.70 1.00 0.50 0.50 CO(g) 2.00 1.80 1.70 1.00 0.50 0.50 CH3COOCH3(g) 0 0.20 0.30 1.00 1.50 1.50 20 min时,只改变了某一条件,根据上表中的数据判断改变的条件可能是________(填字母)。 A.通入一定量的CO B.移出一定量的CH3OCH3 C.加入合适的催化剂 在图3中画出该温度下,CH3COOCH3(g)的体积分数随反应时间的变化曲线。 图3 6.工业上可由丁烯(C4H8)来制备丙烯(C3H6)和乙烯(C2H4),其主要反应原理为 反应Ⅰ:C4H8(g)C3H6(g) ΔH1 反应Ⅱ:C4H8(g)2C2H4(g) ΔH2 保持其他条件相同,研究下列不同条件下,丁烯(C4H8)分解成丙烯(C3H6)和乙烯(C2H4)的平衡组成,得到如图所示结果。说明:(1)是C2H4;(2)是C3H6;(3)是C4H8。 8 根据上述信息,回答下列问题: (1)压强一定时,随温度升高,丙烯的平衡浓度在450 ℃左右达到最大值,继续升高温度,其平衡浓度反而降低,可能的原因是______________________________。 (2)从温度和压强两个角度,选择合适的生产丙烯的条件:____________________。 (3)向一恒温密闭容器中,充入一定量的丁烯发生反应Ⅱ,正、逆反应速率随时间的变化曲线如图所示,在t1时,保持容器压强不变,再充入一定量的丁烯,t2时建立新的平衡,请在图中画出正、逆反应速率随时间变化的曲线(注明正逆) 7.在一个体积为2 L的真空密闭容器中加入1 mol CaCO3,发生反应:CaCO3(s)CaO(s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化如图所示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线。 请按要求回答下列问题: (1)请说明随着温度的升高,曲线B向曲线A逼近的原因是________________。 (2)温度为T时,CO2的浓度变化如图所示,在t2时刻达到平衡状态,在t3时刻压缩容器为1 L,t4时刻重新达到平衡,请在图中画出t3~t5这段时间内CO2的浓度变化。 8 答案精析 1.(平衡线与原平衡线相平,否则不给分) 2.(1)压强增大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大 (2) 3. 4.(1)< 恒温、恒压条件下,再充入3 mol NH3,容器体积变为20 L,c(NH3)=0.25 mol·L-1,c(CO2)=0.05 mol·L-1,此时>K,平衡逆向移动,所以v正<v逆 (2) 5.(1)随温度的升高而增大 该温度范围内,反应Ⅰ的转化率都很大,反应Ⅱ的转化率随温度的升高而减小,所以乙酸甲酯的含量升高 8 (2)C 6.(1)随着温度上升,乙烯浓度上升,使丁烯浓度下降,反应Ⅰ逆向进行;发生其他副反应 (2)450 ℃,0.2 MPa左右 (3) 7.(1)随温度升高,反应速率加快,达到平衡需要的时间变短 (2) 8查看更多