- 2021-05-13 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习必修部分讲义第七单元第4讲难溶电解质的溶解平衡推荐关注高中学习资料库
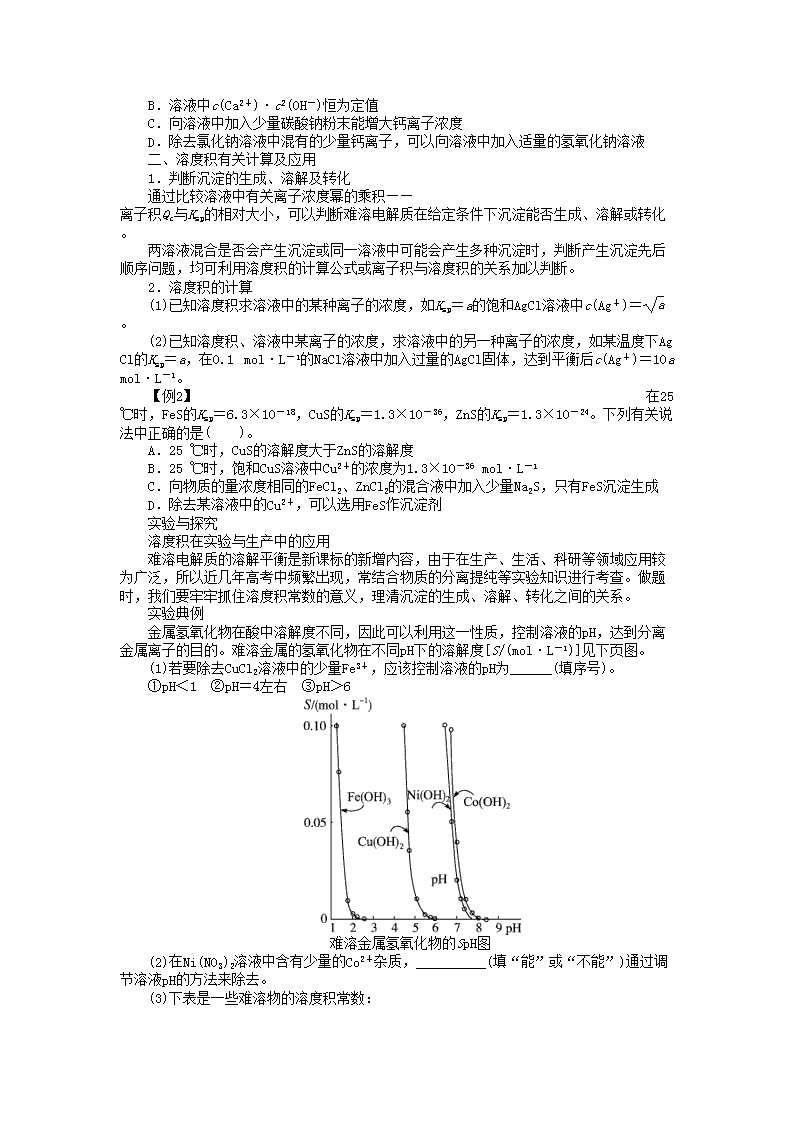
2012届高考化学第一轮复习必修部分讲义 第七单元第4讲难溶电解质的溶解平衡 解读与阐释 考纲要求 权威解读 1.了解难溶电解质的溶解平衡。 2.了解难溶电解质的沉淀转化的本质。 本部分是新课标新增内容,是高考的重点,常见的考查形式:①结合图像考查溶解平衡的建立、溶度积常数在生产、科研、环保中的应用;②根据物质的溶度积常数判断沉淀的溶解及转化;③溶解平衡的影响因素。 梳理与整合 一、沉淀溶解平衡的建立 导学诱思 (1)0.1 mol·L-1的盐酸与0.1 mol·L-1的AgNO3溶液等体积混合完全反应后溶液中含有的微粒有:__________________。 (2)下列方程式①AgCl(s)Ag+(aq)+Cl-(aq)、②AgCl===Ag++Cl-、③CH3COOHCH3COO-+H+各表示什么意义? 答:________________________________________________________________________。 教材回归 1.AgCl溶解平衡的建立 在AgCl的溶液中存在下述两个过程:一方面,在水分子的作用下,少量Ag+和Cl-脱离AgCl的表面而溶于水中;另一方面,溶液中的Ag+和Cl-受AgCl表面正、负离子的吸引,回到AgCl的表面而析出沉淀。在一定温度下当沉淀溶解和生成的速率相等时,得到AgCl的饱和溶液。 2.溶解平衡 固体溶质溶液中的溶质 (1)v溶解____v沉淀,固体溶解。 (2)v溶解____v沉淀,溶解平衡。 (3)v溶解____v沉淀,析出固体。 二、溶度积 导学诱思 AgCl的Ksp=1.80×10-10,将0.002 mol·L-1的NaCl和0.002 mol·L-1的AgNO3溶液等体积混合,是否有AgCl沉淀生成?答:____________________________________________。 教材回归 1.表达式 化学平衡均有平衡常数,所以沉淀溶解平衡也有平衡常数——溶度积,符号为______。对于沉淀溶解平衡MmAn(s)mMn+(aq)+nAm-(aq),Ksp=______。Ksp只受______影响。 2.Ksp的意义 反映了难溶电解质在水中的溶解能力。 (1)用溶度积直接比较时,物质的类型(如AB型、A2B型、AB2型等)必须相同。 (2)对于同类型物质Ksp数值越大,难溶电解质在水中的溶解能力越强。如由Ksp数值可知,溶解能力:AgCl>AgBr>AgI。 3.Ksp的应用 某难溶电解质的溶液中任一情况下有关离子浓度幂的乘积——离子积Qc与Ksp的关系: Qc____Ksp,溶液过饱和,____沉淀析出,直至溶液达到新的平衡; Qc=______,溶液饱和,沉淀与溶解处于______状态; Qc____Ksp,溶液____饱和,____沉淀析出,若加入过量难溶电解质,难溶电解质溶解直到溶液______。 三、沉淀反应的应用 导学诱思 (1)在实验室中怎样除去NaCl溶液中的BaCl2? 答:________________________________________________________________________。 (2)怎样除去AgI中的AgCl? 答:________________________________________________________________________。 教材回归 1.沉淀的生成 (1)调节pH法:如除去NH4Cl溶液中的FeCl3杂质,可首先加入氨水调节pH至7~8,离子方程式为:__________________________。 (2)加沉淀剂法:如用CO沉淀Ca2+,离子方程式为______________________。 2.沉淀的溶解 (1)酸溶解法:如CaCO3溶于盐酸,离子方程式为____________________________。 如Cu(OH)2溶于稀硫酸,离子方程式为________________________________。 (2)盐溶液溶解法:Mg(OH)2溶于NH4Cl溶液。 3.沉淀的转化 (1)实质:______________的移动。 (2)特征 ①一般说来,溶解度小的沉淀转化为溶解度______的沉淀容易实现。 ②沉淀的溶解度差别______,越容易转化。 例如:AgNO3______(白色沉淀)________(淡黄色沉淀)______(黄色沉淀)Ag2S(黑色沉淀)。 (3)应用 ①锅炉除垢 将CaSO4转化为CaCO3,离子方程式为________________________________________。 ②矿物转化 CuSO4溶液遇ZnS(闪锌矿)转化为CuS(铜蓝)的离子方程式为__________________________。 理解与深化 一、沉淀溶解平衡的影响因素 1.内因 难溶电解质本身的性质,这是决定因素。 2.外因 以AgCl(s)Ag+(aq)+Cl-(aq) ΔH>0为例 外界条件 移动方向 平衡后 c(Ag+) 平衡后 c(Cl-) Ksp 升高温度 正向 增大 增大 增大 加水稀释 正向 不变 不变 不变 加入少量AgNO3 逆向 增大 减小 不变 通入HCl 逆向 减小 增大 不变 通入H2S 正向 减小 增大 不变 【例1】 (2011·天津一中月考)已知溶液中存在平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是( )。 A.升高温度,平衡逆向移动 B.溶液中c(Ca2+)·c2(OH-)恒为定值 C.向溶液中加入少量碳酸钠粉末能增大钙离子浓度 D.除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的氢氧化钠溶液 二、溶度积有关计算及应用 1.判断沉淀的生成、溶解及转化 通过比较溶液中有关离子浓度幂的乘积——离子积Qc与Ksp的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成、溶解或转化。 两溶液混合是否会产生沉淀或同一溶液中可能会产生多种沉淀时,判断产生沉淀先后顺序问题,均可利用溶度积的计算公式或离子积与溶度积的关系加以判断。 2.溶度积的计算 (1)已知溶度积求溶液中的某种离子的浓度,如Ksp=a的饱和AgCl溶液中c(Ag+)=。 (2)已知溶度积、溶液中某离子的浓度,求溶液中的另一种离子的浓度,如某温度下AgCl的Ksp=a,在0.1 mol·L-1的NaCl溶液中加入过量的AgCl固体,达到平衡后c(Ag+)=10a mol·L-1。 【例2】 在25 ℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是( )。 A.25 ℃时,CuS的溶解度大于ZnS的溶解度 B.25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1 C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成 D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂 实验与探究 溶度积在实验与生产中的应用 难溶电解质的溶解平衡是新课标的新增内容,由于在生产、生活、科研等领域应用较为广泛,所以近几年高考中频繁出现,常结合物质的分离提纯等实验知识进行考查。做题时,我们要牢牢抓住溶度积常数的意义,理清沉淀的生成、溶解、转化之间的关系。 实验典例 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度[S/(mol·L-1)]见下页图。 (1)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为______(填序号)。 ①pH<1 ②pH=4左右 ③pH>6 难溶金属氢氧化物的SpH图 (2)在Ni(NO3)2溶液中含有少量的Co2+杂质,__________(填“能”或“不能”)通过调节溶液pH的方法来除去。 (3)下表是一些难溶物的溶度积常数: 难(微)溶物 溶度积常数(Ksp) BaSO4 1×10-10 BaCO3 2.6×10-9 CaSO4 7×10-5 CaCO3 5×10-9 工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO物质的量浓度达到0.01 mol·L-1以上,则溶液中CO物质的量浓度应≥______ mol·L-1。 答案与解析 梳理与整合 一、 导学诱思 (1)H2O、H+、OH-、Ag+、Cl-、NO (2)①AgCl的溶解平衡;②AgCl是强电解质,溶于水的AgCl完全电离;③CH3COOH的电离平衡 教材回归 2.(1)> (2)= (3)< 二、 导学诱思 c(Cl-)·c(Ag+)=0.001 mol·L-1×0.001 mol·L-1=10-6mol2·L-2>Ksp,有沉淀生成 教材回归 1.Kspcm(Mn+)·cn(Am-) 温度 3.> 有 Ksp 平衡 < 未 无 饱和 三、 导学诱思 (1)向溶液中加入过量的Na2CO3充分反应过滤,向滤液中加适量盐酸 (2)把混合物与饱和KI溶液混合,振荡静置,溶度积大的AgCl就慢慢转化为溶度积小的AgI 教材回归 1.(1)Fe3++3NH3·H2O===Fe(OH)3↓+3NH (2)CO+Ca2+===CaCO3↓ 2.(1)CaCO3+2H+===Ca2++H2O+CO2↑ Cu(OH)2+2H+===Cu2++2H2O (2)Mg(OH)2+2H+===Mg2++2H2O 3.(1)沉淀溶解平衡 (2)更小 越大 AgCl AgBr AgI (3)CaSO4(s)+CO(aq)===CaCO3(s)+SO(aq) Cu2+(aq)+ZnS(s)===CuS(s)+Zn2+(aq) 理解与深化 【例1】A 解析:Ksp=c(Ca2+)·c2(OH-)是溶度积常数的表达式,溶度积常数随温度变化而变化,B错误;C会生成CaCO3,使Ca2+浓度减小,错误;加入氢氧化钠溶液会使平衡左移,有Ca(OH)2沉淀生成,但Ca(OH)2的溶度积较大,要除去Ca2+,应把Ca2+转化为更难溶的CaCO3 ,D错误。 【例2】D 解析:1 L水中溶解的CuS的质量为×10-18×96 g,同理1 L水中溶解的ZnS的质量为×10-12×97 g,所以CuS的溶解度小于ZnS的溶解度,A、B错误;FeS的Ksp大于ZnS,所以C选项应只有ZnS生成;D选项依据沉淀的转化,溶度积大的FeS可以转化为溶度积小的CuS。 实验与探究 答案:(1)② (2)不能 (3)0.26 解析:(1)由图像可知Fe3+在pH约为2.5时,沉淀完全,而Cu2+在pH约为5时,开始生成沉淀,所以控制溶液的pH为2.5~5时,Fe3+沉淀完全,Cu2+不生成沉淀;(2)因为Ni(OH)2、Co(OH)2的曲线很近,所以不能用调节溶液pH的方法来除杂。查看更多