- 2021-05-13 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学模拟试卷含答案
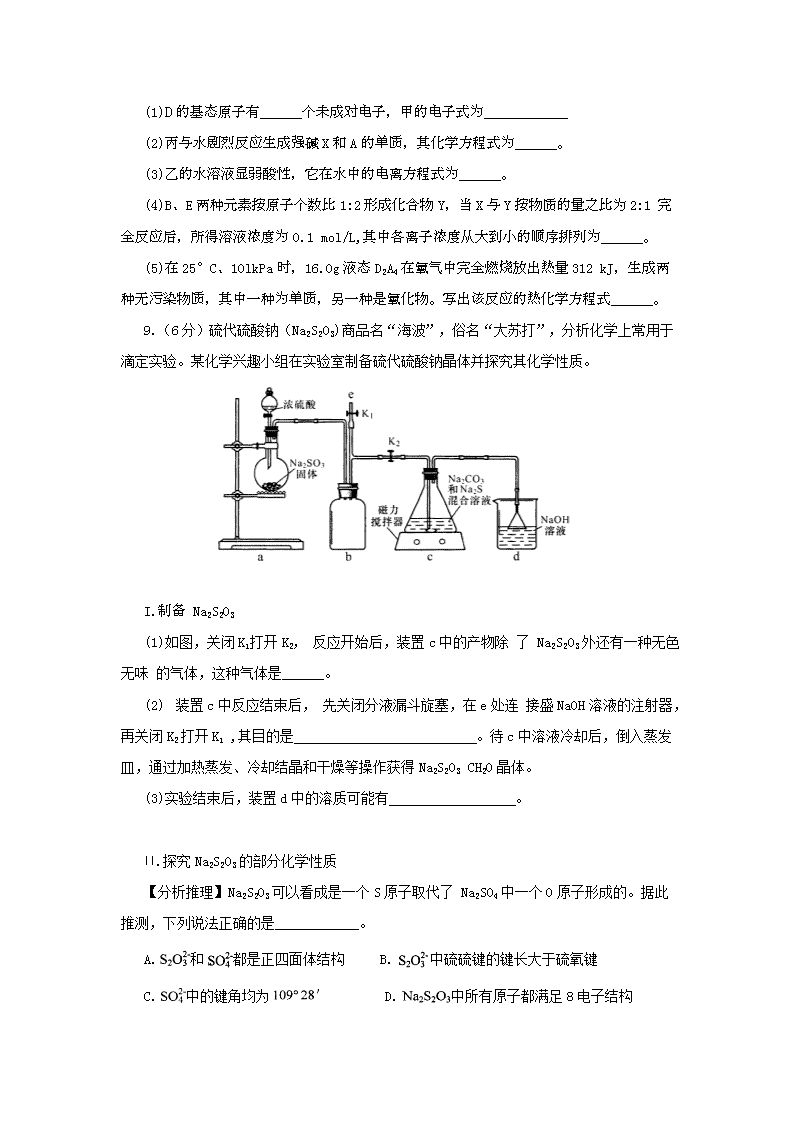
理科综合 化学部分 可能用到的相对原子质量H 1 C 12 N 14 O 16 Cr 52 Fe 56 第I卷(选择题共42分) 选择题(共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的) 1. 隆冬季节,雾霾天气增多造成一些城市空气重度污染,其中的污染物不包括 A. PM2.5 B. NO2 C. SO2 D. CO2 2. 苯胺是染料工业的重要原料,因其毒性强,在环境中对苯胺类化合物应严格控制排放。下 列关于苯胺(C6H5NH2)结构和性质的说法中不正确的是 A.碳原子和氮原子均采取Sp2杂化 B.分子中既有键又有 键 C.能发生加成反应和取代反应 D.既能与盐酸反应,又能被氧化 3. 用NA表示阿伏加德罗常数的值,下列说法中正确的是 A. 的NH4NO3溶液中氮原子数小于0.2NA B. 某温度时,1LpH=6的纯水中含有1.0X10-6NA个OH- C. 在O2参加的反应中,1mol O2作氧化剂时得到的电子数一定是4NA D. 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2,充分反应时转移的电子数为1.2NA 4. “天宫一号”使用镍氢电池供电。镍氢电池的负极材料为储氢合金(用—表示,氢以单原子填入合金晶格),总反应为,下列说法正确的是 A. 电池充电时氢原子被氧化 B. 电池放电时正极为NiOOH C. 电池充电时,与电源负极相连的电极反应为: D. 电池放电时,负极反应为: 5. 过碳酸钠()在生产和生活领域应用广泛,其制备反应为:。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是 A. 实验室制备过碳酸钠时可釆用冷水浴控制反应温度 B. 过碳酸钠水溶液呈碱性,可用作漂洗剂和消毒杀菌剂 C. 过碳酸钠应密封保存,放置于冷暗处 D. 过碳酸钠可使酸性高锰酸钾溶液褪色,并放出一种无色气体 6. 一种白色固体可能由离子中的若干种组成, 陶宝同学设计实验检验其组成,记录如下: 下列关于固体组成的结论错误的是 A.肯定含有和 B.至少含有中的一种离子 C.肯定不含Ba2+,一定含有Cl- D.无需焰色反应即可断定溶液中含有Na+ 7. 人体吸入CO后在肺中发生反应导致人体缺氧。向某血样中通 入CO与O2的混合气,氧合血红蛋白 HbO2浓度随时间变化曲线如下图所示。下列说法正确的是 A. 反应开始至4s内用HbO2表示的平均反应速率为 B. 反应达平衡之前,O2与HbCO的反应速率逐渐减小 C. 将CO中毒病人放入高压氧舱治疗是利用了化学平衡移动原理 D. 该温度下反应的平衡常数为107 第II卷(共58分) 8. (14分)五种短周期元素A、B、D、E、G的原子序数依次增大,其中A、G同主族, B、D、E同周期。A分别与B、E、G形成原子个数比为1:1的化合物甲、乙、丙,它们在 常温常压下分别为气体、液体、固体,甲燃烧时火焰明亮且产生浓烈的黑烟,丙为离子晶体。 (1)D的基态原子有______个未成对电子,甲的电子式为____________ (2)丙与水剧烈反应生成强碱X和A的单质,其化学方程式为______。 (3)乙的水溶液显弱酸性,它在水中的电离方程式为______。 (4)B、E两种元素按原子个数比1:2形成化合物Y,当X与Y按物质的量之比为2:1 完全反应后,所得溶液浓度为0.1 mol/L,其中各离子浓度从大到小的顺序排列为______。 (5)在25°C、10lkPa时,16.0g液态D2A4在氧气中完全燃烧放出热量312 kJ,生成两 种无污染物质,其中一种为单质,另一种是氧化物。写出该反应的热化学方程式______。 9.(6分)硫代硫酸钠(Na2S2O3)商品名“海波”,俗名“大苏打”,分析化学上常用于 滴定实验。某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质。 I.制备 Na2S2O3 (1)如图,关闭K1打开K2, 反应开始后,装置c中的产物除 了 Na2S2O3外还有一种无色无味 的气体,这种气体是______。 (2) 装置c中反应结束后, 先关闭分液漏斗旋塞,在e处连 接盛NaOH溶液的注射器,再关闭K2打开K1 ,其目的是 。待c中溶液冷却后,倒入蒸发皿,通过加热蒸发、冷却结晶和干燥等操作获得Na2S2O3 CH2O晶体。 (3)实验结束后,装置d中的溶质可能有 。 II.探究Na2S2O3的部分化学性质 【分析推理】Na2S2O3可以看成是一个S原子取代了 Na2SO4中一个O原子形成的。据此 推测,下列说法正确的是____________。 A.和都是正四面体结构 B.中硫硫键的键长大于硫氧键 C.中的键角均为 D.中所有原子都满足8电子结构 【提出假设】①Na2S2O3与Na2SO4结构相似,化学性质也应该相似,因此室温时Na2S2O3 溶液pH=7。②从S元素的化合价推测Na2S2O3具有较强的还原性。 【验证假设】配制适量Na2S2O3溶液,进行如下实验(请填空): 实验操作 实验现象 现象解释(用离子方程式表示) ① ___________________ 溶液pH=8 ___________ ② 向新制氯水中滴入适量Na2S2O3溶液 氯水褪色 _____________ 【实验结论】__________________ 10. (14分)布洛芬(C13H18O2)具有抗炎、镇痛、解热作用,其合成路线如下: 已知: 请回答以下问题: (1)反应①〜⑤中,属于取代反应的有______ (填编号); (2)E中官能团的名称为______; (3)布洛芬的结构简式为______。 (4)写出反应③的化学方程式:____________。 (5) 比布洛芬少5个碳原子的同系物X有多种同分异构体,写出同时满足下列条件的 所有 X的同分异构体结构简式:_________________; a.属于芳香族酯类化合物 b.核磁共振氢谱呈现4种峰,且峰面积之比为3:2:2:1 写出其中一种能发生银镜反应的物质在NaOH溶液中水解的反应方程式:______。 11. (14分)红矾钠(重铬酸钠:)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下: 请回答下列问题: (1)的基态电子排布式为____________。 (2)锻烧铬铁矿发生反应: 配平上述化学反应方程式。 (3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有 关反应的离子方程式为____________。 (4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。 ①阳极的电极反应式为(不考虑后续反应):____________。 ②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______。 ③已知某含的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。 理科综合 化学部分参考答案和评分标准 第Ⅰ卷(选择题 共42分) 选择题(共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的) 1. D 2. A 3. B 4. B 5. D 6. C 7. C 第Ⅱ卷(共58分) 8.(14分)(1)3(2分) H∶C C∶H(2分) (2)NaH+H2O==NaOH+H2↑(2分) (3)H2O2H++HO (2分) (4)c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+) (3分) (5)N2H4(l)+O2(g) === N2(g)+2H2O(l) ΔH=-624 kJ·mol-1(3分) 9.(共16分,每空2分)Ⅰ.(1)CO2(或二氧化碳) (2)吸收a、b装置中残余的SO2,防止拆除装置时污染空气 (3)Na2SO3、Na2CO3、Na2SO4 Ⅱ.【分析推理】BC 【验证假设】①用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照(或用pH计测Na2S2O3溶液的pH) S2O+H2OHS2O+OH- ②S2O+4Cl2+5H2O==2SO+8Cl-+10H+ 【实验结论】Na2S2O3溶液呈碱性,并具有还原性 10.(14分)(1)①②③(2分) (2)羟基(1分) (3)(2分) (3分) (4)+—→+ CH3COOH[ (5)(3分) + 2NaOH —→+ HCOONa + H2O(3分) 11.(14分)(1)1s22s22p63s23p63d3或 [Ar] 3d3(2分) (2)4Fe(CrO2)2+8Na2CO3+7O22Fe2O3+8Na2CrO4+8CO2(2分) (3)2CrO+2H+Cr2O+H2O(2分),CO+2H+==CO2↑+H2O(1分) (4)①Fe-2e-==Fe2+(2分) ②阴极区水电离出的H+得电子产生H2,促进水的电离平衡正向移动,使溶液OH-浓度增大(2分) ③16.8(3分)查看更多