- 2021-05-13 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学全国Ⅱ
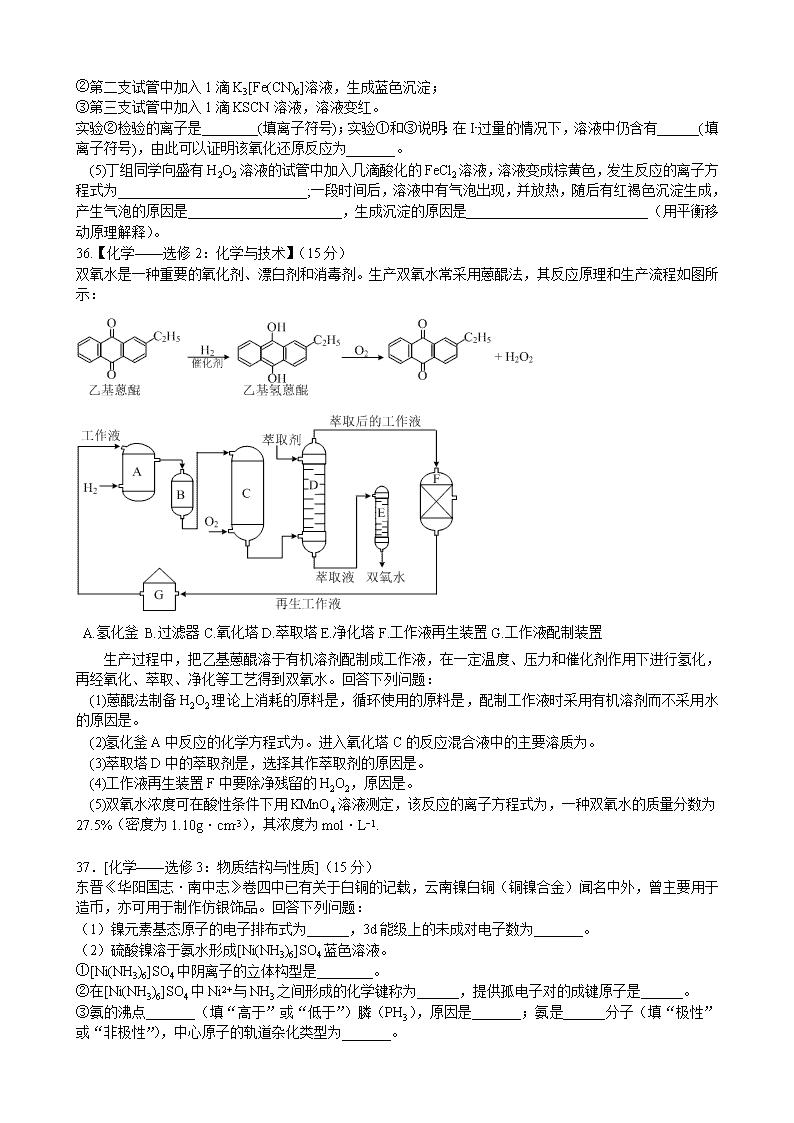
2016年普通高等学校招生全国统一考试(全国Ⅱ) 理科综合能力测试(化学部分) 7.下列关于燃料的说法错误的是 A.燃料燃烧产物CO2是温室气体之一 B.化石燃料完全燃烧不会造成大气污染 C.以液化石油气代替燃油可减少大气污染 D.燃料不完全燃烧排放的CO是大气污染物之一 8.下列各组中的物质均能发生就加成反应的是 A.乙烯和乙醇 B.苯和氯乙烯 C.乙酸和溴乙烷 D.丙烯和丙烷 9.a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+的电子层结构相同,d与b同族。下列叙述错误的是 A.a与其他三种元素形成的二元化合物中其化合价均为+1 B.b与其他三种元素均可形成至少两种二元化合物 C.c的原子半径是这些元素中最大的 D.d与a形成的化合物的溶液呈弱酸性 10.分子式为C4H8Cl2的有机物共有(不含立体异构) A.7种 B.8种 C.9种 D.10种 11.Mg–AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是 A.负极反应式为Mg–2e– = Mg2+ B.正极反应式为Ag+ + e–=Ag C.电池放电时Cl–由正极向负极迁移 D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ 12.某白色粉末由两种物质组成,为鉴别其成分进行如下实验: ①取少量样品加入足量水仍有部分固体未溶解:再加入足量稀盐酸,有气泡产生,固体全部溶解; ②取少量样品加入足量稀盐酸有气泡产生,震荡后仍有固体存在。 该白色粉末可能为 A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3 C.Na2SO3、BaCO3 D.Na2CO3、CuSO4 13.下列实验操作能达到实验目的的是 实验目的 实验操作 A. 制备Fe(OH)3胶体 将NaOH浓溶液滴加到饱和FeCl3溶液中 B. 由MgCl2溶液制备无水MgCl2 将MgCl2溶液加热蒸干 C. 除去Cu粉中混有的CuO 加入稀硝酸溶液,过滤、洗涤、干燥 D. 比较水与乙醇中氢的活泼性 分别将少量钠投入到盛有水和乙醇的烧杯中 26.(14分) 联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题: (1)联氨分子的电子式为_______,其中氮的化合价为_________。 (2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为_________。 (3) ①2O2(g)+N2(g)==N2O4(l) ΔH1 ②N2(g)+2H2(g)==N2H4(l) ΔH2 ③O2(g)+2H2(g)==2H2O(g) ΔH3 ④2N2H4(l)+N2O4(l)==3N2(g)+4H2O(g) ΔH4=-1048.9 kJ·mol-1 上述反应热效应之间的关系式为ΔH4=_______,联氨和N2O4可作为火箭推进剂的主要原因为________。 (4)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数值为_____(已知:N2H4+H+N2H5+的K=8.7×107;Kw=1.0×10−14)。联氨与硫酸形成的酸式盐的化学式为________。 (5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是_______。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1 kg的联氨可除去水中溶解的O2_______kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是_____。 27.(14分) (1)丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产。主要副产物有丙烯醛(CH2=CHCHO)和异径(CH3CN)和副产物丙烯醛(C3H4O)的热化学方程式如下: ①C3H6(g) + NH3(g) + O2(g) ===== C3H3N(g) +3H2O(g) ΔH = −515 kJ·mol−1 ②C3H6(g) +O2(g) ==== C3H4O(g) +H2O(g) ΔH = −353 kJ·mol−1 两个反应在热力学上趋势均很大,其原因是__________;有利于提高丙烯腈平衡产率的反应条件是_____________;提高丙烯腈反应选择性的关键因素是___________。 (2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃。低于460℃时,丙烯腈的产率_______(填“是”或“不是”)对应温度下的平衡转化率,判断理由是_________;高于460℃时,丙烯腈产率降低的可能原因是____________(双选,填标号)。 A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D.反应活化能增大 (3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为__________,理由是____________。进料气氨、空气、丙烯的理论体积比约为______________。 28.(15分) 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题: (1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_____________。 (2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为________________。 (3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_________。 (4)丙组同学取10 ml 0.1 mol·L-1KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取 2 mL 此溶液于3支试管中进行如下实验: ①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色; ②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀; ③第三支试管中加入1滴KSCN溶液,溶液变红。 实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为_______。 (5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是______________________,生成沉淀的原因是__________________________(用平衡移动原理解释)。 36.【化学——选修2:化学与技术】(15分) 双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示: A.氢化釜 B.过滤器C.氧化塔D.萃取塔E.净化塔F.工作液再生装置G.工作液配制装置 生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题: (1)蒽醌法制备H2O2理论上消耗的原料是,循环使用的原料是,配制工作液时采用有机溶剂而不采用水的原因是。 (2)氢化釜A中反应的化学方程式为。进入氧化塔C的反应混合液中的主要溶质为。 (3)萃取塔D中的萃取剂是,选择其作萃取剂的原因是。 (4)工作液再生装置F中要除净残留的H2O2,原因是。 (5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为,一种双氧水的质量分数为27.5%(密度为1.10g·cm-3),其浓度为mol·L−1. 37.[化学——选修3:物质结构与性质](15分) 东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题: (1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为_______。 (2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。 ①[Ni(NH3)6]SO4中阴离子的立体构型是________。 ②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。 ③氨的沸点_______(填“高于”或“低于”)膦(PH3),原因是_______;氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。 (3)单质铜及镍都是由______键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol–1,ICu> INi的原因是_______。 (4)某镍白铜合金的立方晶胞结构如图所示。 ①晶胞中铜原子与镍原子的数量比为________。 ②若合金的密度为d g·cm–3,晶胞参数a=______nm。 38.[化学——选修5:有机化学基础](15分) 氰基丙烯酸酯在碱性条件下能快速聚合为从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下: 已知: ①A的相对分子质量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰 ② 回答下列问题: (1)A 的化学名称为______,。 (2)B的结构简式为______。其核磁共振氢谱显示为_________组峰,峰面积比为_______。 (3)由C生成D的反应类型为______。 (4)由D生成E的化学方程式为______。 (5)G中的官能团有______、______、______。(填官能团名称) (6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有___________种。(不含立体结构) 2016年普通高等学校招生全国统一考试(全国Ⅱ) 理科综合(化学部分参考答案) 7. B 8. B 9. A 10. C 11. B 12. C 13. D 26. (1) −2 (2)NaClO+2NH3=N2H4+NaCl+H2O (3)△H4=2△H3-2△H2-△H1 反应放热量大、产生大量气体 (4)8.7×10−7 N2H6(HSO4)2 (5)固体逐渐变黑,并有气泡产生 1 N2H4的用量少,不产生其他杂质(还原产物为N2和H2O,而Na2SO3产生Na2SO4 27. (1) 两个反应均为放热量大的反应;降低温度降低压强 催化剂 (2) 不是,该反应为放热反应,平衡产率应随温度升高而降低 AC (3) 1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低 1:7.5:1 28. (1)防止Fe2+被氧化 (2) 2Fe2++Cl2=2Fe3++2Cl- (3)隔绝空气(排除氧气对实验的影响) (4)Fe2+ Fe3+ 可逆反应 (5)H2O2+2Fe2++2H+=2Fe3++2H2O Fe3+催化H2O2分解产生O2 H2O2分解反应放热,促进Fe3+的水解平衡正向移动。 36. (1)氢气和氧气 乙基蒽醌 乙基蒽醌(乙基氢蒽醌)不溶于水,易溶于有机溶剂 (2) 乙基氢蒽醌 (3) 水 H2O2溶于水被水萃取,乙基蒽醌不溶于水 (4) H2O2分解放出氧气,与氢气混合,易发生爆炸 (5) 6H++5H2O2+2MnO-4=2Mn2++5O2↑+8H2O ;8.9 37. (1) 1s22s22p63s23p63d84s2或[Ar] 3d84s2 2 (2) ①正四面体 ②配位键 N ③高于 NH3分子间可形成氢键 极性 sp3 (3) 金属 铜失去的是全充满的3d10电子,镍失去的是4s1电子 (4) ①3:1 ② ×107 38. (1)丙酮 (2) 2 6:1 (3)取代反应 (4) (5)碳碳双键 酯基 氰基 (6)8查看更多