- 2021-05-13 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
海南高考化学试卷含答案
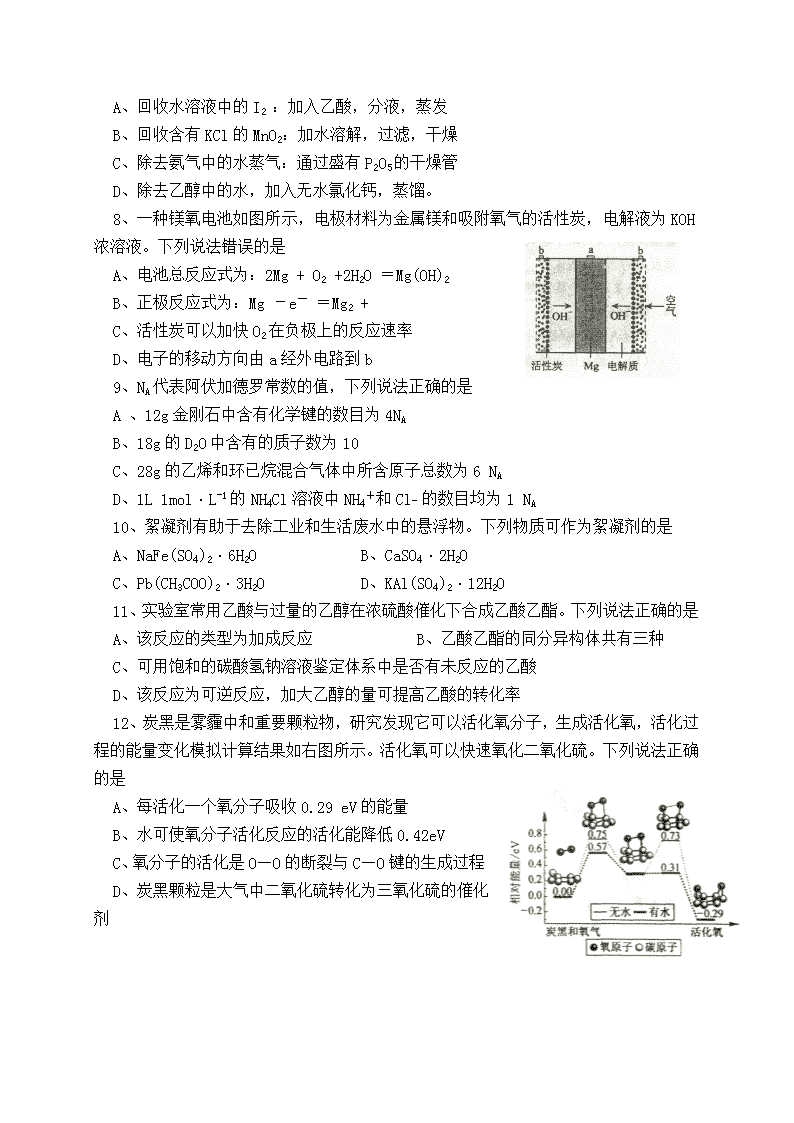
2018年普通高等学校招生全国统一考试 化 学 注意事项: 1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。 3.考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H 1 C 12 N14 O16 S 32 Fe 56 Cu64 一、选择题:本题共6小题,每小题2分,共12分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1、 下列食品添加剂中,常用作防腐剂的是 A、碘酸钾 B、碳酸氢钠 C、苯甲酸钠 D、磷酸氢钠 2、某工业废气所含氮氧化物(NOx)的氮氧质量比为7:4 ,该NOx可表示为 A、N2O B、NO C、N2O3 D、NO2 3、用浓硫酸配制稀硫酸时,不必要的个人安全防护用品是 A、实验服 B、橡胶手套 C、护目镜 D、磷酸氢钙 4、下列化合物中,能与Na2CO3溶液反应生成沉淀且沉淀可溶于NaOH溶液的是 A、MgCl2 B、Ca(NO)3 C、FeSO4 D、AlCl3 5、化学与生产生活密切相关,下列说法错误的是 A、Na2O2可与CO2反应放出氧气,可用于制作呼吸面具 B、SiO2具有导电性,可用于制作光导纤维和光电池 C、聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层 D、氯水具有较强的氧化性,可用于漂白纸张、织物等 6、某温度下向含AgCl固体的AgCl饱和溶液中加少量稀硫酸,下列说法正确的是 A、AgCl的溶解度、Ksp均减小 B、AgCl的溶解度、Ksp均不变 C、AgCl的溶解度减小、Ksp不变 D、AgCl的溶解度不变、Ksp减小 二、选择题。本题共6小题,每小题4分,共24分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选得0分,若正确答案包含两个选项,只选一个且正确得2分,选两个且都正确得4分,只要选错一个就得0分。 7、下列分离方法正确的是 A、回收水溶液中的I2 :加入乙酸,分液,蒸发 B、回收含有KCl的MnO2:加水溶解,过滤,干燥 C、除去氨气中的水蒸气:通过盛有P2O5的干燥管 D、除去乙醇中的水,加入无水氯化钙,蒸馏。 8、一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法错误的是 A、电池总反应式为:2Mg + O2 +2H2O =Mg(OH)2 B、正极反应式为:Mg -e- =Mg2 + C、活性炭可以加快O2在负极上的反应速率 D、电子的移动方向由a经外电路到b 9、NA代表阿伏加德罗常数的值,下列说法正确的是 A 、12g金刚石中含有化学键的数目为4NA B、18g的D2O中含有的质子数为10 C、28g的乙烯和环已烷混合气体中所含原子总数为6 NA D、1L 1mol·L-1的NH4Cl溶液中NH4+和Cl_ 的数目均为1 NA 10、絮凝剂有助于去除工业和生活废水中的悬浮物。下列物质可作为絮凝剂的是 A、NaFe(SO4)2·6H2O B、CaSO4·2H2O C、Pb(CH3COO)2·3H2O D、KAl(SO4)2·12H2O 11、实验室常用乙酸与过量的乙醇在浓硫酸催化下合成乙酸乙酯。下列说法正确的是 A、该反应的类型为加成反应 B、乙酸乙酯的同分异构体共有三种 C、可用饱和的碳酸氢钠溶液鉴定体系中是否有未反应的乙酸 D、该反应为可逆反应,加大乙醇的量可提高乙酸的转化率 12、炭黑是雾霾中和重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如右图所示。活化氧可以快速氧化二氧化硫。下列说法正确的是 A、每活化一个氧分子吸收0.29 eV的能量 B、水可使氧分子活化反应的活化能降低0.42eV C、氧分子的活化是O—O的断裂与C—O键的生成过程 D、炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂 三、非选择题:共44分。每个试题考生都必须作答。 13.(8分) X、Y、Z为短周期元素,X原子的质子数等于Z与Y的质子数之和;Z与Y位于同一周期,Y原子核外有3个未成对电子,非金属Z的一种固体单质可导电。回答下列问题: (1)Y在周期表中的位置是第____周期、第_____族,其原子结构示意图为_________; Y与Z之间形成的化学键属于__________。 (2)X、Y、Z三种元素中原子半径最大的是______(填元素符号);X单质既可与盐酸反应,又可溶于氢氧化钠溶液,产生的气体为__________ (填分子式),该气体与Y单质反应的化学方程式为__________________________________________________。 (3)Z最高价氧化物的电子式为____________________。 14.(8分) 铜是人类发现最早并广泛使用的一种金属。回答下列问题: (1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为________________。 (2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程 式__________________________________________。配制的FeCl3溶液应保持__________ (填“酸性”“碱性”或“中性”),原因是________________________________。 (3)溶液中Cu2+的浓度可采用碘量法测得: ①2Cu2++5I一=2CuI↓+I3―; ②I3― + 2S2032-=S4O62一+ 3I一 反应①中的氧化剂为____________。现取20.00 mL含Cu2+的溶液,加入足量的KI充分反应后,用0.1000mol·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S203溶液25.00 mL,此溶液中Cu2+的浓度为____________mol·L-1。 15.(9分) 二甲醚(CH3OCH3)是一种气体麻醉剂,可由“可燃冰”为原料合成。回答下列问题: (1)B为黄绿色气体,其化学名称为____________。 (2)由A和B生成D的化学方程式为____________。 (3)E的结构简式为____________。 (4)由E生成二甲醚的反应类型为____________。 (5)二甲醚的同分异构体的结构简式为____________。 16.(9分) 过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。回答下列问题: (1)已知: H2(g)+ O2(g)=H20(1) △H1=-286kJ·mol-1 H2(g)+ 02(g)=H202(l) △H2=-188 kJ·mol-1 过氧化氢分解反应2H2O2(1)=2H20(l)+O2(g)的△H=_______kJ·mol-1。不同温度下 过氧化氢分解反应的平衡常数K313K___________K298K (填“大于"“小于”或“等于”)。 (2)100℃时,在不同金属离子存在下,纯过氧化氢24h的分解率见下表: 离子 加入量/(mg·L-1) 分解率/% 离子 加入量/(mg·L-1) 分解率/% 无 __ 2 Fe3+ 1.O 15 Al3+ 10 2 Cu2+ O.1 86 Zn2+ 10 10 Cr3+ 0.1 96 由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______。贮运过氧化氢时,可选用的容器材质为_________(填标号)。 A.不锈钢 8.纯铝 C.黄铜 D.铸铁 (3)过氧化氢的Ka1=2.24×10-12,H202的酸性______H2O(填“大于”“小于”或“等于”)。研究表明,过氧化氢溶液中HO2—的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH求的关系如右图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是_________________________:相同pH下,过氧化氢浓度越大分解率越低的原因是_________________________________。 17.(10分)某小组在实验室中探究金属钠与二氧化碳的反应。回答下列问题: (1)选用如图所示装置及药品制取CO2。打开弹簧夹,制取CO2。为了得到干燥、纯净的CO2,产生的气流应依次通过盛有___________、_______的洗气瓶(填试剂名称)。反应结束后,关闭弹簧夹,可观察到的现象是_________________。不能用稀硫酸代替稀盐酸,其原因是____________________________________________________。 (2)金属钠与二氧化碳反应的实验步骤及现象如下表: 步骤 现象 将一小块金属钠在燃烧匙中点燃,迅速伸入盛有CO2的集气瓶中。充分反应,放置冷却 产生大量白烟,集气瓶底部有黑色固体产生,瓶壁上有白色物质产生 在集气瓶中加入适量蒸馏水,振荡、过滤 滤纸上留下黑色固体,滤液为无色溶液 ①为检验集气瓶瓶壁上白色物质的成分,取适量滤液于2支试管中,向一支试管 中滴加1滴酚酞溶液,溶液变红:向第二支试管中滴加澄清石灰水,溶液变浑浊。据此 推断,白色物质的主要成分是________(填标号)。 A.Na2O B.Na2O2 C.NaOH D.Na2CO3 ②为检验黑色固体的成分,将其与浓硫酸反应,生成的气体具有刺激性气味。据 此推断黑色固体是_______________。 ③本实验中金属钠与二氧化碳反应的化学方程式为________________。 四、选考题:共20分。请考生从第l8、19题中任选一题作答。如果多做,则按所做的第一题计分。第18、19题的第I题为选择题,在给出的四个选项中,有两个选项是符合题目要求的,请将符合题目要求的选项标号填在答题卡相应位置;第Ⅱ题为非选择题,请在答题卡相应位置作答并写明小题号。 18.[选修5——有机化学基础】 18-I(6分)下列氯代烃中不能由烯烃与氯化氢加成直接得到的有 A.氯代环己烷 B.2,2-二甲基-1-氯丙烷 C.2-甲基-2-氯丙烷 D.2,2,3,3一四甲基-1-氯丁烷 18-Ⅱ(14分)盐酸美西律(E)是一种抗心律失常药,其一条合成路线如下: 刚答F列问题: (1)已知A的分子式为C8H10O,其化学名称为_______________。 (2)B中的官能团的名称为_______。 (3)由A生成C的化学反应方程式为_____________________,反应类型是_______。 (4)由D的结构可判断:D应存在立体异构。该立体异构体的结构简式为__________。 (5)若用更为廉价易得的氨水替代盐酸羟氨(NH2OH·HCl)与C反应,生成物的结构简式为_____________________。 (6)A的同分异构体中能与三氯化铁溶液发生显色反应的还有_______种:其中,核磁共振氢谱为四组峰,峰面积比为6:2:1:1的结构简式为_______。 19.【选修3——物质结构与性质】 19-I(6分)下列元素或化合物的性质变化顺序正确的是 A.第一电离能:Cl>S>P>Si B.共价键的极性:HF>HCI>HBr>HI C.晶格能:NaF>NaCl>NaBr>NaI D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3 19一II(14分) 黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题: (1)CuFeS2中存在的化学键类型是_________。下列基态原子或离子的价层电子排布图正确的是_________(填标号)。 (2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。 ①x分子的立体构型是_______,中心原子杂化类型为_________,属于______(填“非极性”或“极性”)分子。 ②X的沸点比水低的主要原因是______________________。 (3)CuFeS2与氧气反应生成SO2。SO2中心原子的价层电子对数为__________,共价键的类型有____________。 (4)四方晶系CuFeS2的晶胞结构如右图所示。 ①Cu+的配位数为_______,S2-的配位数为________。 ②已知:a=b=0.524 nm,c=1.032nm,Na为阿伏加德罗常数 的值,CuFeS2晶体的密度是_______g·cm-3(列出计算式)。查看更多