- 2021-05-13 发布 |
- 37.5 KB |
- 11页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学专题五原电池和化学电源一轮复习
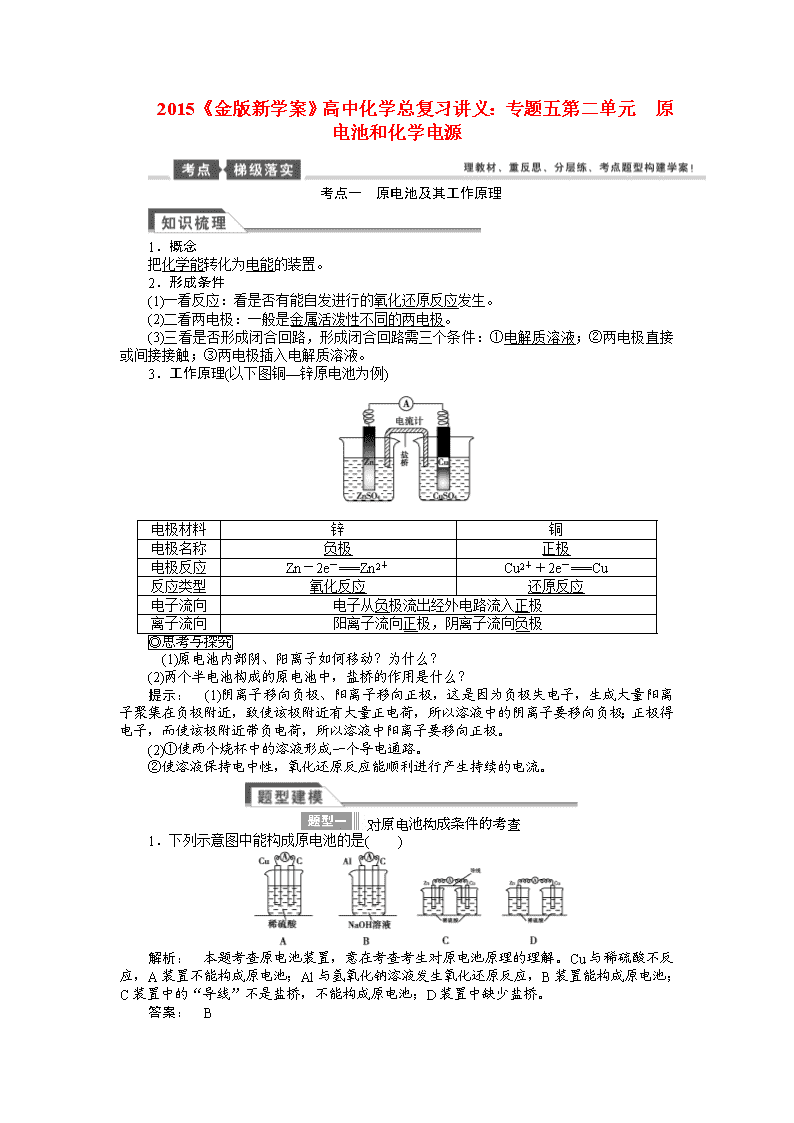
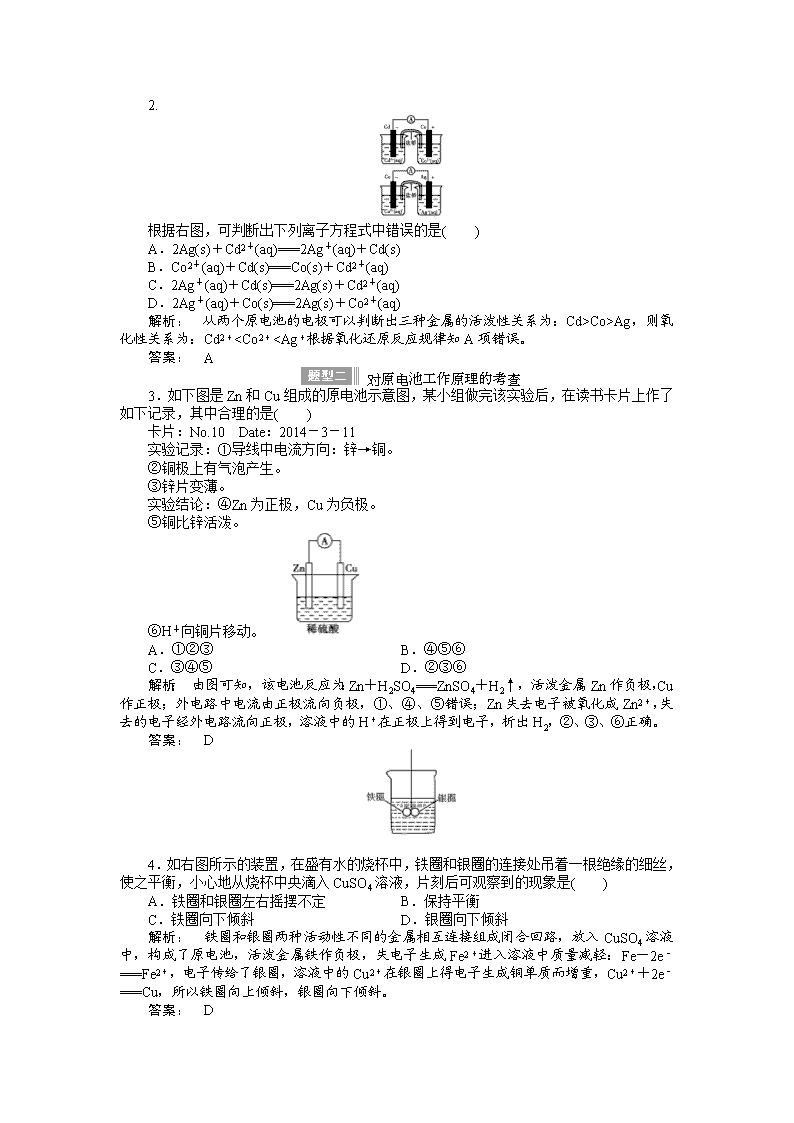
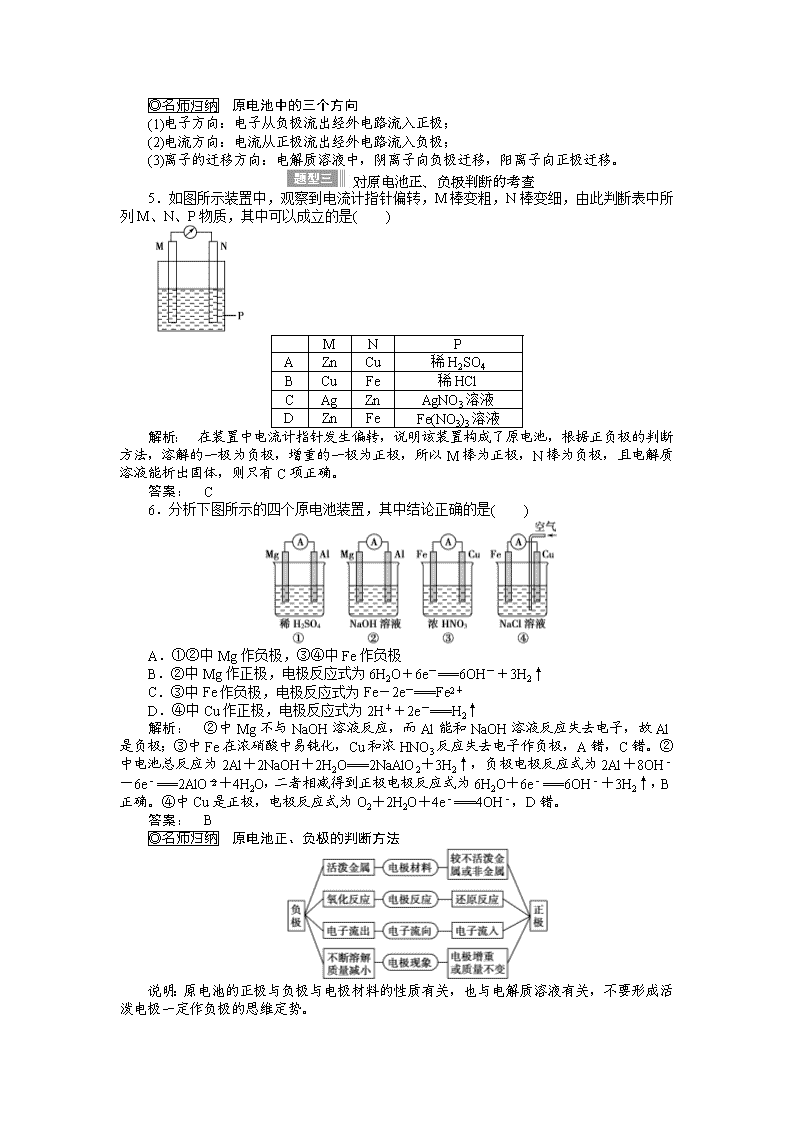
2015《金版新学案》高中化学总复习讲义:专题五第二单元 原电池和化学电源 考点一 原电池及其工作原理 1.概念 把化学能转化为电能的装置。 2.形成条件 (1)一看反应:看是否有能自发进行的氧化还原反应发生。 (2)二看两电极:一般是金属活泼性不同的两电极。 (3)三看是否形成闭合回路,形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液。 3.工作原理(以下图铜—锌原电池为例) 电极材料 锌 铜 电极名称 负极 正极 电极反应 Zn-2e-===Zn2+ Cu2++2e-===Cu 反应类型 氧化反应 还原反应 电子流向 电子从负极流出经外电路流入正极 离子流向 阳离子流向正极,阴离子流向负极 (1)原电池内部阴、阳离子如何移动?为什么? (2)两个半电池构成的原电池中,盐桥的作用是什么? 提示: (1)阴离子移向负极、阳离子移向正极,这是因为负极失电子,生成大量阳离子聚集在负极附近,致使该极附近有大量正电荷,所以溶液中的阴离子要移向负极;正极得电子,而使该极附近带负电荷,所以溶液中阳离子要移向正极。 (2)①使两个烧杯中的溶液形成一个导电通路。 ②使溶液保持电中性,氧化还原反应能顺利进行产生持续的电流。 1.下列示意图中能构成原电池的是( ) 解析: 本题考查原电池装置,意在考查考生对原电池原理的理解。Cu与稀硫酸不反应,A装置不能构成原电池;Al与氢氧化钠溶液发生氧化还原反应,B装置能构成原电池;C装置中的“导线”不是盐桥,不能构成原电池;D装置中缺少盐桥。 答案: B 2. 根据右图,可判断出下列离子方程式中错误的是( ) A.2Ag(s)+Cd2+(aq)===2Ag+(aq)+Cd(s) B.Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq) C.2Ag+(aq)+Cd(s)===2Ag(s)+Cd2+(aq) D.2Ag+(aq)+Co(s)===2Ag(s)+Co2+(aq) 解析: 从两个原电池的电极可以判断出三种金属的活泼性关系为:Cd>Co>Ag,则氧化性关系为:Cd2+查看更多
相关文章
- 当前文档收益归属上传用户