- 2021-05-13 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学实验探究题分类练习
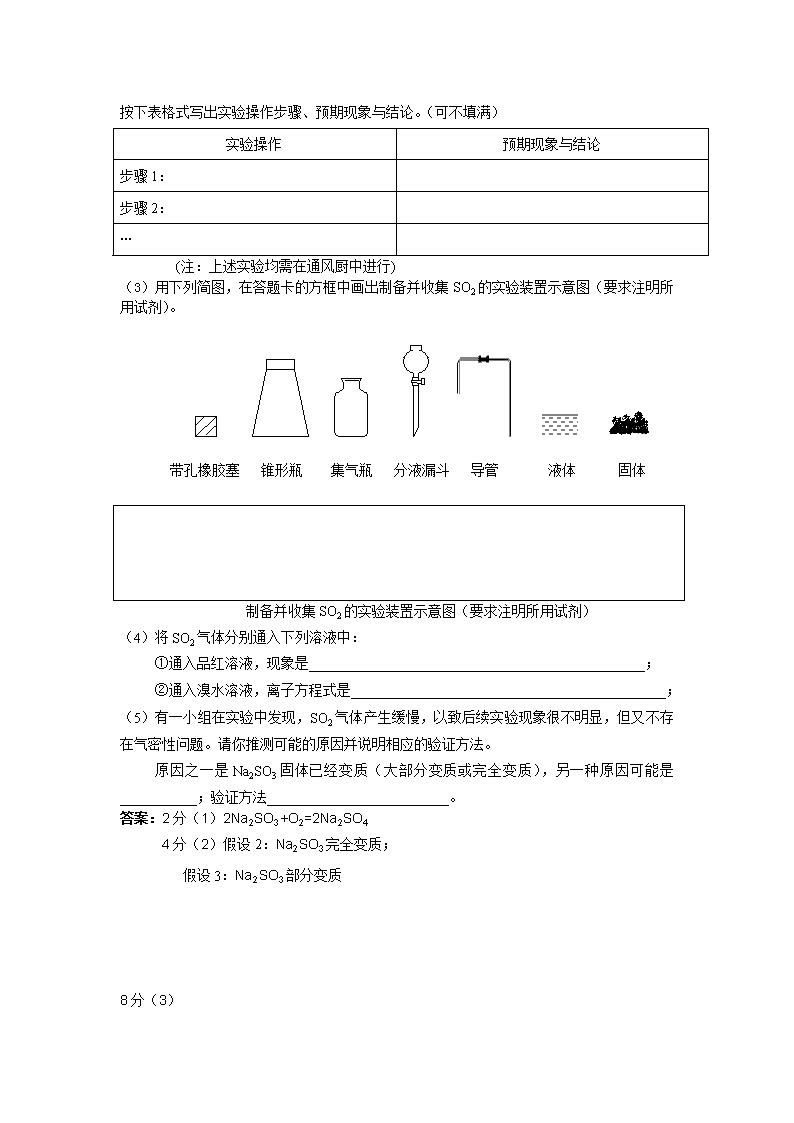
高考化学实验探究题分类练习 命题趋势: 探究性实验题以其创新、灵活的特点也正在取代陈旧的命题套路,成为高考命题的热点题型。 解题思路: 提出假设→实验探究→得出结论 1、准确地把握实验目的 2、利用已学知识,分析如何实现这个目的 --实验原理 3、结合实验材料,初步确定设计对策 --实验方案 考题类型: 1、对未知物(产物或剩余物等)的探究 2、物质性质的探究 3、化学反应原理的探究 答题模式(表述方法): A、取适量的 物质(药品)进行 实验(操作)如果有 现 象,则得出 B、(对另一种情况设计判断)另取等量的 物质(药品)进行 对照实验(操作)如果有 (现象),则得出 (结论)。 注意事项: 1、细心审题是关键:目的、原理要画出来,并自始至终把握实验目的。 2、认真分析是核心:①原理分析 ②材料分析 ③变量分析 ④结果分析 3、正确表达是保障:大多数学生有实验思路,就是拿不到分,因此我们在表达过程中一定要按格式答题,同时要体现出科学、等量、单一变量与对照性等原则,提高实验的得分率。 一:对未知物(产物或剩余物等)的探究 1、(16)三草酸合铁酸钾晶体K3[Fe(C2O4)3]×3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。 限选试剂:浓硫酸、1.0 mol·L-1 HNO3、1.0 mol·L-1 盐酸、1.0 mol·L-1 NaOH、3% H2O2、0.1 mol·L-1 KI、0.1 mol·L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。 (1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。 (2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是 ,现象是 。 (3)固体产物中铁元素存在形式的探究。 ① 提出合理假设 假设1: ; 假设2: ; 假设3: 。 ② 设计实验方案证明你的假设(不要在答题卡上作答) ③ 实验过程 根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。 实验步骤 预期现象与结论 步骤1: 步骤2: 步骤3: …… 答案:(1)CO和CO2 (2)利用焰色反应 透过蓝色钴玻璃观察到紫色火焰 (3)①全部为铁单质 全部为FeO 同时存在铁单质和FeO ③ 实验步骤 预期现象与结论 步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使K2CO3完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。 固体部分溶解。 步骤2:向试管中加入适量CuSO4溶液,再加入少量上述不溶固体,充分振荡。 (1)若蓝色溶液颜色及加入的不溶固体无明显变化,则假设2成立。 (2)若蓝色溶液颜色明显改变,且有暗红色固体物质生成,则证明有铁单质存在。 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN。 结合步骤2中的(2): (1)若溶液基本无色,则假设1成立。 (2)若溶液呈血红色,则假设3成立。 2、(共22分)化学兴趣小组在实验室对粉末状Na2SO3样品是否变质进行探究,并希望用未变质的Na2SO3固体制取SO2 ,SO2在水中的溶解性为:1体积水约溶解40体积SO2。 限选实验仪器与试剂:白纸、Na2SO3样品、1 mol·L-1H2SO4、 12 mol·L-1H2SO4、 6 mol·L-1HNO3、0.01 mol·L-1KMnO4、BaCl2溶液、品红试液、NaOH溶液、稀盐酸、 蒸馏水。 (1)请指出Na2SO3固体在空气中变质的原因,用化学方程式表示: 。 (2)请完成对Na2SO3样品是否变质的探究,提出合理假设: 假设1:Na2SO3样品完全没有变质; 假设2: ; 假设3: 。 ① 设计实验方案证明你的假设(不要在答题卷上作答) ② 实验过程 根据假设方案,对假设2和假设3进行实验,判断Na2SO3 样品是否变质。请在答题卷上按下表格式写出实验操作步骤、预期现象与结论。(可不填满) 实验操作 预期现象与结论 步骤1: 步骤2: … (注:上述实验均需在通风厨中进行) (3)用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置示意图(要求注明所用试剂)。 带孔橡胶塞 锥形瓶 集气瓶 分液漏斗 导管 液体 固体 制备并收集SO2的实验装置示意图(要求注明所用试剂) (4)将SO2气体分别通入下列溶液中: ①通入品红溶液,现象是________________________________________________; ②通入溴水溶液,离子方程式是_____________________________________________; (5)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法。 原因之一是Na2SO3固体已经变质(大部分变质或完全变质),另一种原因可能是___________;验证方法__________________________。 答案:2分(1)2Na2SO3+O2=2Na2SO4 4分(2)假设2:Na2SO3完全变质; 假设3:Na2SO3部分变质 8分(3) 实验操作 预期现象与结论 步骤1:取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加稀HCl,使溶液呈酸性,再滴加适量BaCl2溶液; 结论1:如果出现白色沉淀,说明溶液中含SO42-,Na2SO3样品变质。 步骤2:另取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加1 mol·L-1H2SO4酸化的0.01 mol·L-1KMnO4溶液。 结论2:如果KMnO4溶液的紫红色褪去为无色溶液,则说明溶液中有SO32-,结合步骤1说明原样品部分变质。 结论3:如果KMnO4溶液的紫红色不褪色,结合步骤1说明原样品完全变质。 … 注:其它合理答案与步骤均给分 3分(3) 氢氧化钠 Na2SO3 浓硫酸 制备并收集SO2的实验装置示意图 3分(4)品红褪色;SO2+Br2+2H2O=4H++2Br-+SO42- 2分(5)不是用浓硫酸;用洁净玻璃棒蘸取待测试样涂白纸不变黑,说明不是浓硫酸。 第30题图 3、(16分)某同学用图示装置进行铁和稀硝酸反应的实验并进行相关的实验探究。(相对原子质量Fe:56) a.向广口瓶内注入足量热NaOH溶液,将盛有a g纯铁粉的小烧杯放入瓶中。 b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。 c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入200mL 6mol/L的稀硝酸,铁粉恰好完全溶解。 (一)气体产物成分探究 ①实验前如何检查该装置的气密性 。 ②燃烧红磷的目的是 。 ③为证明气体产物为NO,步骤c后还缺少的一步主要操作是___________________。 (二)产物中铁元素价态探究: (1)提出合理假设: 假设1:产物只有+3价铁; 假设2: ; 假设3: 。 (2)设计实验:分别取小烧杯中反应后溶液装入两支试管甲、乙,在甲试管中滴加酸性高锰酸钾溶液;在乙试管中滴加KSCN溶液,观察现象。推测实验现象与结论: ①若现象为: ,则假设1正确; ②若现象为: ,则假设2正确; ③若现象为: ,则假设3正确。 (3)a值范围为 。 答案:(一) ①略。(2分) ②除去广口瓶内的氧气,避免干扰气体检验(2分) ③打开止水夹,向瓶内通入少量氧气;(2分) (二)(1)假设2:产物中只有+2价铁元素(1分)。假设3:产物中既含+2价又有+3价铁元素(1分)。 (2)①甲试管溶液无明显变化,乙试管溶液变红色;(2分) ②甲试管溶液紫色褪去,乙试管没有明显变化;(2分) ③甲试管溶液紫色褪去,乙试管溶液变红色。(2分) (3)16.8≤a≤25.2 (2分) 4、Na2CO3溶液和CuSO4溶液混合后,产生蓝色沉淀,请你推测可能有哪些产物?并设计试验来验证。[提示] 经查资料得知:CuCO3和Cu(OH)2均不带结晶水。 假设一:__________________________ 假设二:__________________________ 假设三:__________________________ 答案: 假设一:Na2CO3溶液和CuSO4溶液混合后直接发生沉淀反应,生成CuCO3沉淀。 假设二:Na2CO3溶液和CuSO4溶液混合后发生双水解反应,生成Cu(OH)2沉淀。 假设三:Na2CO3溶液和CuSO4溶液混合后既发生沉淀反应,又发生双水解反应,生成Cu和Cu(OH)2两种沉淀的混合物。 方案一:向洗涤干净并低温烘干的沉淀中加入盐酸,证明生成物中含CuCO3,另取沉淀加热灼烧,检验生成的水,证明生成物中含Cu(OH)2。 澄清Ca(OH)2 粘有无水CuSO4的棉球 方案二:将洗涤干净并低温烘干的沉淀直接加热灼烧,将生成的气体依次通过无水硫酸铜、澄清石灰水,检验生成的水或二氧化碳,证明生成物中含Cu(OH)2或CuCO3或两者兼有。 二:物质性质的探究 1、某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去): Ⅰ.实验装置如下图一所示 图一 图二 (1)浓硝酸受热分解的化学方程式是 __________________ 。 (2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确),理由是 Ⅱ.实验装置如上图2所示 (1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是 。 (2)当集气瓶中充满红棕色气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是 ______ _ Ⅲ.为了更直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。 答案:Ⅰ(1)4HNO3(浓) =4NO2↑+O2↑+2H2O (2)不正确 带火星的木条熄灭可能是由于加热浓硝酸时产生大量水蒸气。 Ⅱ (1)2Cu(NO3)2 =2CuO+4NO2↑+O2↑ (2)正确 硝酸铜分解产生的混合气体中氧气的体积分数与空气中氧气的体积分数基本相同,若NO2不支持燃烧,则木条不会复燃 Ⅲ 用金属铜与浓硝酸反应制取NO2气体,并用浓硫酸或无水氯化钙进行干燥,再将带火星的木条伸入二氧化氮中观察是否复燃。 三:化学反应原理的探究 1、在溴水中加入镁粉,溴水褪色。对于褪色的原因,甲认为是溴溶于水后,溴和水发生了可逆反应: Br2+H2O HBr+HBrO 当向溴水中加入镁粉之后,则发生以下两种反应: Mg+2HBr=MgBr2+H2↑ ` Mg+2HBrO=Mg(BrO)2+H2↑ 由于上述反应的发生,使溴水中的平衡向正反应方向移动,从而使溴水褪色。乙认为,镁是活泼金属,在溴水中存在大量的溴,应该是溴与镁粉直接反应:Mg+Br2=MgBr2,而使溴水褪色。 请设计实验方案验证。 答案: 1:在溴水中加入镁粉,立即观察现象,若短时间内有有大量气体产生,则甲的解释正确。若短时间内没有大量气体产生,则乙的解释正确 2:把镁粉加入到溴的四氯化碳溶液中,看溴的四氯化碳溶液是否褪色,若不褪色,说明镁不能与干燥的溴发生反应。若褪色,说明乙是对的 解题关键:找出两种观点的争论焦点,以其内在区别为切入点,结合课本知识设计不同的实验来区别。 2、请结合所学知识设计实验,证实AlO2-结合H+的能力比CO32−强,供选试剂:NaOH溶液、AlCl3溶液、CuSO4溶液、pH试纸、NaHCO3溶液、FeCl3溶液(仪器自选)。 ⑴应选试剂;⑵操作要点;(3)能证明AlO2-结合H+的能力强于CO32−的反应的原理的离子方程式。 分析:该实验为验证性实验,如果AlO2-和HCO3−相遇时,生成 Al(OH)3白色沉淀,即可AlO2-结合H+的能力强于CO32− 解答: ⑴应选试剂:NaOH溶液、AlCl3溶液、NaHCO3溶液 (2)操作要点:①取少量的AlCl3溶液于试管中; ②向试管中逐滴加入NaOH溶液直至产生白色沉淀恰好全部消失; ③向其中再滴入NaHCO3溶液至足量。 (3)离子方程式: AlO2- + HCO3−+H2O = Al(OH)3 ↓+ CO32− 3、 含有酚酞的氢氧化钠的溶液中,滴加新制氯水,边滴边振荡,直到红色褪去。对于红色消失的原因,甲同学认为是氯气与水反应生成的HCl和HClO中和了NaOH所致;乙同学认为是氯气与水反应生成的HClO具有强氧化性使红色酚酞变成了无色的物质。 请设计实验证明上述解释正区确与否。 分析:如果红色消失的原因是因为酸碱中和,则红色可能重现,如果红色消失的原因是因为被氧化,则红色不可能重现。 答案:向上述刚好褪色的溶液中再滴入一些NaOH溶液,若红色重现,则是因为HCl和HClO的酸性所致;若红色不再重现,则是因为HClO的强氧化性所致。 题后反思: 1、重视实验基础知识 虽然探究性实验主要考察学生的探究能力,但在问 题的设置上常常包含了对实验基础知识 的考察。 2、牢牢掌握元素化合物知识,大胆猜想, 细心论证。 3、探究实验要有开放性答案,与唯一答案有区别。查看更多