- 2021-05-13 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
(浙江选考)2020版高考化学 考前提升训练10 化学反应中的能量变化
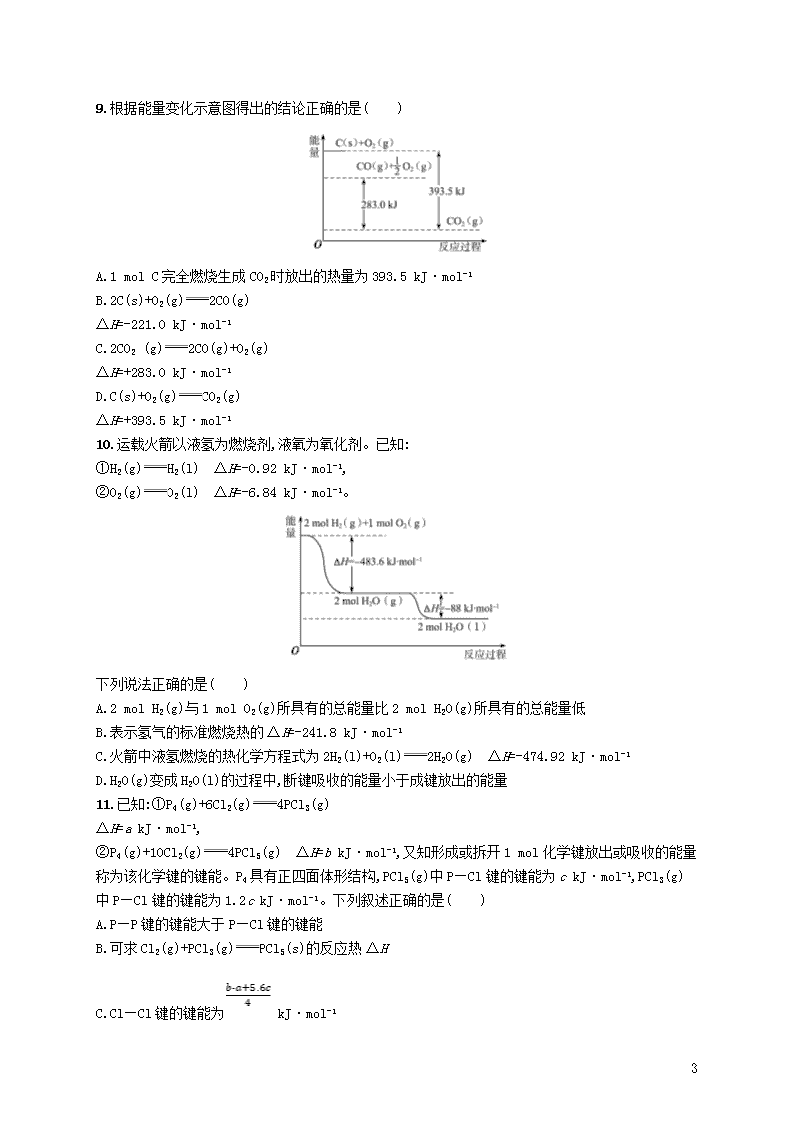
提升训练10 化学反应中的能量变化 1.(2018·金华十校统测)下列热化学方程式书写正确的是(ΔH的绝对值均正确)( ) A.C2H5OH(l)+3O2(g)2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ· mol-1(标准燃烧热) B.NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=+57.3 kJ· mol-1(中和热) C.S(s)+O2(g)SO2(g) ΔH=-269 kJ· mol-1(反应热) D.2NO2O2+2NO ΔH=+116.2 kJ· mol-1(反应热) 2.(2018·湖州统测)下列说法正确的是( ) A.图①中ΔH1=ΔH2+ΔH3 B.图②在催化剂条件下,反应的活化能等于E1+E2 C.图③表示醋酸溶液滴定NaOH和氨水混合溶液的电导率变化曲线 D.图④可表示由CO(g)生成CO2(g)的反应过程和能量关系 3.(2018·富阳中学模拟)25 ℃、101 kPa下: ①2Na(s)+ O2(g)Na2O(s) ΔH1=-414 kJ· mol-1 ②2Na(s)+O2(g)Na2O2(s) ΔH2=-511 kJ· mol-1 下列说法正确的是( ) A.①和②产物的阴、阳离子个数比不相等 B.①和②生成等物质的量的产物,转移电子数不同 C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐增大 D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)2Na2O(s) ΔH=-317 kJ· mol-1 4.(2018·舟山模拟)已知充分燃烧a g乙烯气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则表示乙烯燃烧的热化学方程式正确的是( ) A.2C2H4(g)+6O2(g)4CO2(g)+4H2O(l) ΔH=-4b kJ· mol-1 7 B.C2H4(g)+3O2(g)2CO2(g)+2H2O(l) ΔH=+2b kJ· mol-1 C.2C2H4(g)+6O2(g)4CO2(g)+4H2O(l) ΔH=-2b kJ· mol-1 D.2C2H4(g)+6O2(g)4CO2(g)+4H2O(l) ΔH=+b kJ· mol-1 5.下列物质放入水中,会显著放热的是( ) A.食盐 B.蔗糖 C.酒精 D.生石灰 6.乙烯和氢气反应过程中的能量变化如图(图中曲线b)所示。下列有关叙述正确的是( ) A.该反应为放热反应 B.催化剂能改变该反应的焓变 C.图中曲线a可表示使用催化剂时的能量变化 D.逆反应的活化能大于正反应的活化能 7.乙苯催化脱氢制苯乙烯反应:+H2(g)。 已知: 化学键 C—H C—C CC H—H 键能/(kJ·mol-1) 412 348 612 436 根据表中数据计算上述反应的ΔH(kJ · mol-1) ( ) A.-124 B.+124 C.+1 172 D.-1 048 8.2 mol Cl2(g)与足量的H2(g)反应生成HCl(g),在298.15 K时测得放出369.2 kJ能量。在下列热化学方程式中,不正确的是( ) A.H2(g)+Cl2(g)2HCl(g) ΔH=-369.2 kJ·mol-1 B.2H2(g)+2Cl2(g)4HCl(g) ΔH=-369.2 kJ·mol-1 C.HCl(g) H2(g)+ Cl2(g) ΔH=+92.3 kJ·mol-1 D. H2(g)+ Cl2(g)HCl(g) ΔH=-92.3 kJ·mol-1 7 9.根据能量变化示意图得出的结论正确的是( ) A.1 mol C完全燃烧生成CO2时放出的热量为393.5 kJ·mol-1 B.2C(s)+O2(g)2CO(g) ΔH=-221.0 kJ·mol-1 C.2CO2 (g)2CO(g)+O2(g) ΔH=+283.0 kJ·mol-1 D.C(s)+O2(g)CO2(g) ΔH=+393.5 kJ·mol-1 10.运载火箭以液氢为燃烧剂,液氧为氧化剂。已知: ①H2(g)H2(l) ΔH=-0.92 kJ·mol-1, ②O2(g)O2(l) ΔH=-6.84 kJ·mol-1。 下列说法正确的是( ) A.2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低 B.表示氢气的标准燃烧热的ΔH=-241.8 kJ·mol-1 C.火箭中液氢燃烧的热化学方程式为2H2(l)+O2(l)2H2O(g) ΔH=-474.92 kJ·mol-1 D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量 11.已知:①P4(g)+6Cl2(g)4PCl3(g) ΔH=a kJ·mol-1, ②P4(g)+10Cl2(g)4PCl5(g) ΔH=b kJ·mol-1,又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体形结构,PCl5(g)中P—Cl键的键能为c kJ·mol-1,PCl3(g)中P—Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是( ) A.P—P键的键能大于P—Cl键的键能 B.可求Cl2(g)+PCl3(g)PCl5(s)的反应热ΔH C.Cl—Cl键的键能为 kJ·mol-1 7 D.P—P键的键能为 kJ·mol-1 12.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下: 钛精矿粗TiCl4纯TiCl4 氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。 已知:TiO2(s) +2Cl2(g)TiCl4(g)+O2(g) ΔH1=+175.4 kJ·mol-1 2C(s) +O2(g)2CO(g) ΔH2=-220.9 kJ·mol-1 (1)沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式: 。 (2)氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH 0(填“>”“<”或“=”),判断依据: 。 13.(1)已知: 若表示1 mol甲醇完全燃烧的焓变为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)CH3OH(l)的ΔH= 。若ΔH1=-285.8 kJ· mol-1,ΔH2=+283.0 kJ· mol-1,某H2和CO的混合气体完全燃烧时放出113.74 kJ能量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量之比为 。 (2)以CH4和H2O为原料,通过下列反应也可以制备甲醇。 Ⅰ.CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=+206.0 kJ· mol-1 Ⅱ.CO(g)+2H2(g)CH3OH(g) ΔH=-129.0 kJ· mol-1 CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 。 7 参考答案 提升训练10 化学反应中的能量变化 1.C A项,生成的水不是液态水,故A项中ΔH不能表示C2H5OH的标准燃烧热;B项,中和反应为放热反应,故B项中ΔH应为负值;D项,热化学方程式没有标明各物质的聚集状态。 2.C 若将图①中ΔH1对应的箭头改变方向(指向H2O),则根据盖斯定律可知有ΔH1=ΔH2+ΔH3,A项错误;图②加入催化剂后,该反应的活化能为E1,B项错误;图③中,加入醋酸溶液后发生反应:CH3COOH+NaOHCH3COONa+H2O,导电离子的物质的量变化不大,但加入了醋酸溶液后,溶液体积增大,离子浓度减小,电导率减小,将NaOH反应完毕后,加入的醋酸与氨水反应:CH3COOH+NH3·H2OCH3COONH4+H2O,溶液中导电离子浓度增大,溶液电导率增大,氨水反应完毕后,再加入醋酸溶液后,溶液体积增大,因为醋酸是弱酸,则溶液的电导率会减小,C项正确;图④中各物质的聚集状态没有注明,D项错误。 3.D A项,①和②产物中阳离子均为Na+,阴离子分别为O2-、,则阴、阳离子个数比均为1∶2,错误;B项,①和②生成等物质的量的产物,由Na元素的化合价变化可知转移电子数相同,错误;C项,Na与O2加热生成Na2O2,随温度升高生成Na2O的速率减小,错误;D项,由盖斯定律可知,①×2-②可得Na2O2(s)+2Na(s)2Na2O(s),则ΔH=(-414 kJ· mol-1)×2-(-511 kJ· mol-1)=-317 kJ· mol-1,正确。 4.A 乙烯燃烧是放热反应,ΔH为负值,生成1 mol CO2时,放热b kJ,故生成4 mol CO2时,放热4b kJ。 5.D A、B、C中物质均溶于水,热效应不明显,CaO与水反应,放出大量的热,热效应明显。 6.C 从图示可以看出反应物的总能量低于生成物的总能量,故为吸热反应,A项错误;焓变与反应过程中是否使用催化剂无关,B项错误;加入催化剂可以降低反应的活化能,C项正确;正反应是吸热反应,逆反应的活化能小于正反应的活化能,D项错误。 7.B ΔH=反应物总键能-生成物总能键能,由有机物的结构可知,应是—CH2CH3中总键能与—CHCH2、H2总键能之差,故ΔH=(5×412+348-3×412-612-436)kJ·mol-1=+124 kJ·mol-1,故选B。 8.A 2 mol Cl2(g)对应放出的热量为369.2 kJ,1 mol Cl2(g)对应放出的热量为184.6 kJ, mol Cl2(g)对应放出的热量为92.3 kJ,故A错误,B正确;放热反应的ΔH为负值,H2(g)+Cl2(g)HCl(g)是放热反应,HCl(g)H2(g)+Cl2(g)是吸热反应,在相同条件下其ΔH的绝对值相等,符号相反,故C、D两项正确。 9.B 根据能量变化示意图,1 mol C(s)完全燃烧生成CO2(g)时放出的热量为393.5 kJ,A项热量的单位错误;由图可知,1 mol C(s)不完全燃烧生成CO(g)时放热110.5 kJ热量,则热化学方程式为2C(s)+O2(g)2CO(g) ΔH=-221.0 kJ·mol-1,故B正确;由题图可知,1 mol CO2分解生成1 7 mol CO和0.5 mol氧气吸收283.0 kJ热量,则热化学方程式为2CO2(g)2CO(g)+O2(g) ΔH=-566.0 kJ·mol-1,故C错误;碳的燃烧反应是放热反应,ΔH<0,故D错误。 10.C A项,由图像分析,2 mol H2(g)与1 mol O2(g)反应生成2 mol H2O(g),放出483.6 kJ的热量,故2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量高,A项错误。B项,氢气的标准燃烧热是指1 mol氢气完全燃烧生成液态水时放出的热量,故表示氢气的标准燃烧热的ΔH=- kJ·mol-1=-285.8 kJ·mol-1,B项错误。C项,①2H2(g)+O2(g)2H2O(g) ΔH=-483.6 kJ·mol-1,②H2(g)H2(l) ΔH=-0.92 kJ·mol-1,③O2(g)O2(l) ΔH=-6.84 kJ·mol-1,根据盖斯定律,由①-②×2-③可得2H2(l)+O2(l)2H2O(g) ΔH=-474.92 kJ·mol-1,C项正确。D项,H2O(g)生成H2O(l)为物理变化,不存在化学键的断裂和生成,D项错误。 11.C P—Cl键的键能大于P—P键的键能,A项错误;PCl5(g)→PCl5(s)的能量转化未知,无法求出B项反应的反应热,B项错误;设Cl—Cl键的键能为x,根据盖斯定律,反应②-①得到4PCl3(g)+4Cl2(g)4PCl5(g) ΔH=(b-a)kJ·mol-1,则(b-a)kJ·mol-1=1.2c kJ·mol-1×12+4x-c kJ·mol-1×20,x= kJ·mol-1,C项正确;同理可得P—P键的键能为 kJ·mol-1,D项错误。 12.答案: (1)TiO2(s)+2Cl2(g)+2C(s)TiCl4(g)+2CO(g) ΔH=-45.5 kJ·mol-1 (2)> 温度越高,CO的物质的量越多而CO2的物质的量少,说明CO2生成CO的反应是吸热反应 解析: 由制备纯TiCl4的流程示意图,钛精矿与氯气、C发生氯化过程,反应为TiO2+2Cl2+2CTiCl4+2CO。 (1)由Ⅰ.TiO2(s)+2Cl2(g)TiCl4(g)+O2(g) ΔH1=+175.4 kJ·mol-1 Ⅱ.2C(s)+O2(g)2CO(g) ΔH2=-220.9 kJ·mol-1, 结合盖斯定律可知,Ⅰ+Ⅱ得到TiO2(s)+2Cl2(g)+2C(s)TiCl4(g)+2CO(g) ΔH=(+175.4 kJ·mol-1)+(-220.9 kJ·mol-1)=-45.5 kJ·mol-1,即热化学方程式为TiO2(s)+2Cl2(g)+2C(s)TiCl4(g)+2CO(g) ΔH=-45.5 kJ·mol-1。 (2)因温度越高,CO的物质的量越多而CO2的物质的量少,说明CO2生成CO的反应是吸热反应,所以ΔH>0;温度越高,CO的物质的量越多而CO2的物质的量少,说明CO2生成CO的反应是吸热反应。 13.答案: (1)2ΔH1-ΔH2-ΔH3 1∶1 (2)CH4(g)+H2O(g)CH3OH(g)+H2(g) ΔH=+77 kJ· mol-1 解析: (1)由反应Ⅰ可得①H2(g)+O2(g)H2O(l) ΔH1,由反应Ⅱ可得②CO2(g)CO(g)+O2(g) ΔH2,由表示1 mol甲醇完全燃烧的焓变为ΔH3可得③CH3OH(l)+O2(g) 7 CO2(g)+2H2O(l) ΔH3,将①×2-②-③可得目标热化学方程式,故ΔH=2ΔH1-ΔH2-ΔH3。由ΔH1、ΔH2可知表示H2、CO的标准燃烧热的ΔH分别为-285.8 kJ· mol-1、-283.0 kJ· mol-1,混合气体完全燃烧生成3.6 g液态水,n(H2O)=0.2 mol,n(H2)=0.2 mol,H2燃烧放出的热量Q=0.2 mol×285.8 kJ· mol-1=57.16 kJ,则混合气体中CO燃烧放出的热量为113.74 kJ-57.16 kJ=56.58 kJ,则混合气体中n(CO)=≈0.2 mol。 (2)依据盖斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)CH3OH(g)+H2(g) ΔH=(206.0-129.0) kJ· mol-1=+77 kJ· mol-1。 7查看更多