- 2021-05-13 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学无机推断解法与技巧教师版
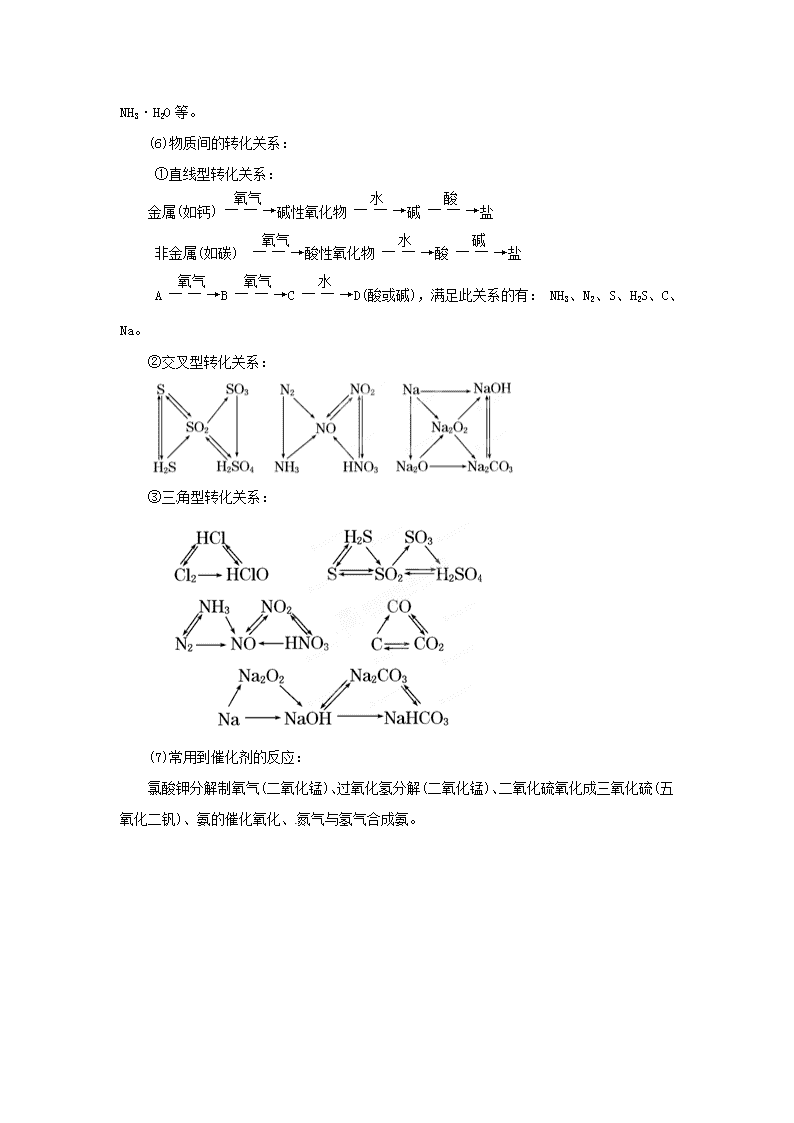
无机框图推断与元素推断技巧 无机框图推断题是化学学科考查的热点题型,是高考命题人特别关注的,此类题是将基本概念、基本理论、元素单质及其化合物的性质有机结合起来的综合题。考查考生观察、分析、推理、思维、获取信息及综合应用的能力。 1.解题方法技巧 无论推断题属于哪种形式,均遵循这样的推断思路:迅速浏览、整体扫描、产生印象、寻找“题眼”,题眼由点到面、随时检验,注意联系、大胆假设、全面分析(正推或逆推),验证确认。解题的关键是仔细审题,依物质的特性或特征转化来确定“题眼”,顺藤摸瓜,进而完成全部未知物的推断。我们可以将推断题的解题方法及推理过程表示如下: 推断题结论验证 2.常见解题题眼 Fe(SCN)3(红)。 (3)状态特征: ①液态单质:Br2、Hg; ②液态氢化物:H2O、H2O2。 (4)物质的特殊性质或特殊组成: (5)特殊反应现象: ①焰色反应:Na+(黄色)、K+(紫色)。 ②使品红溶液褪色的气体:SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)。 ③白色沉淀Fe(OH)2置于空气中最终转变为红褐色Fe(OH)3沉淀(由白色―→灰绿色―→红褐色);遇SCN-颜色无明显变化,通入Cl2后显红色的是Fe2+。 ④在空气中变为红棕色:NO。 ⑤气体燃烧火焰呈苍白色:H2在Cl2中燃烧;在空气中点燃呈蓝色或淡蓝色:CO、H2、CH4。 ⑥使湿润的红色石蕊试纸变蓝:NH3。 ⑦使湿润的淀粉碘化钾试纸变蓝:Cl2、Br2、FeCl3、碘水等。 ⑧两气体接触出现白烟:HCl和NH3;固体与气体反应产生白烟:钠在氯气中燃烧。 ⑨遇OH-生成红褐色沉淀、遇SCN-显红色的是Fe3+。 ⑩Br2在水中显橙黄色,在有机溶剂中显橙红色,I2在水中显深黄色,在有机溶剂中显紫红色。 ⑪滴加顺序不同,现象不同:AlCl3和NaOH、NaAlO2和HCl、Na2CO3和HCl、AgNO3和 NH3·H2O等。 (6)物质间的转化关系: ①直线型转化关系: 金属(如钙)碱性氧化物碱盐 非金属(如碳) 酸性氧化物酸盐 ABCD(酸或碱),满足此关系的有: NH3、N2、S、H2S、C、Na。 ②交叉型转化关系: ③三角型转化关系: (7)常用到催化剂的反应: 氯酸钾分解制氧气(二氧化锰)、过氧化氢分解(二氧化锰)、二氧化硫氧化成三氧化硫(五氧化二钒)、氨的催化氧化、氮气与氢气合成氨。 二、解推断题的一般方法 1.顺推法: 顺推是根据题设条件和转化关系方框图,从最初反应物入手,利用给定反应物的结构和性质特点,顺着转化关系往后推,从而解决问题。 例1.图1每一方框中的字母代表一种反应物或生成物: 附表 各物质的量 C D I 起始组成/mol 6 4 0 某时刻组成/mol 3 3 2 物质A跟B反应生成物E、F和G,物质C跟D反应生成物质I,某温下该反应起始和某时刻的反应混合物组成如附表所示。请填写下列空白: ⑴ 物质H的分子式_______; ⑵ 反应①的化学方程式_______; ⑶ 反应②的化学方程式(须注明反应条件)是________。 分析:本题首先给出饱和食盐水的电解,然后是电解产物间的作用。最初条件意义清楚,故进行顺推。饱和食盐水的电解产物是Cl2、H2、NaOH,其中两两反应可生成三种产物的是Cl2、NaOH中的一种,C为H2,又B、C作用生成H物质,则B为Cl2,A为NaOH,H为HCl。又由表中数据推知C、D、I三种物质在方程式中的系数比为(6-3)∶(4-3) ∶(2-0)=3∶1∶2,因C为H2,则D为N2,I为NH3。 答案: ⑴ HCl; ⑵ Cl2+2NaOH=NaCl+NaClO+H2O; ⑶ 3H2+N22NH3 2.逆推法: 有的推断题,最初条件意义并不明确,但某一结果有较明确的含义,求解时,从这一结果入手,采用逆推模式,逆向逐层推理,可顺利达到解决问题的目的。 例2.某些金属氧化物跟熔融烧碱反应可生成盐,根据图2化学反应方框图填空: (1)单质F是________; (2)写出由E生成G的离子方程式(或化学方程式)_______; (3)溶液I中所含金属离子是________; (4)由CE+F若改用浓酸,则不能选用的浓酸是(写分子式)________。 分析:从题设最初条件看,其意义并不明确,但从转化关系方框图中的结果“红褐色沉淀G”可知,其含义明确,故从此入手运用逆推。由红褐色沉淀G逆推可知溶液E中含Fe2+,再由E逆推知单质C为Fe,单质F为H2;又由单质F(H2)逆推知单质B可为金属Al或Zn或者为非金属单质Si,另由溶液I加NH3·H2O转化为沉淀J,J溶于强碱溶液,可确定单质B为Al,化合物A为铁的氧化物。 答案: (1)H2; (2)4Fe2++8NH3·H2O+O2+2H2O===4Fe(OH)3↓+8NH 或Fe2++2NH3·H2O====Fe(OH)2↓+2NH; 4Fe(OH)2+O2+2H2O===4Fe(OH)3; (3)Al3+和Na+; (4)H2SO4或HNO3 3.假想验证法: 假设思维模式是由题设条件和转化关系图找出题目突破口,并对有关内容建立假设,然后将假设结果代入题中验证分析,由此可使问题得以解决。假设模式的思维途径可表示为: 例3.下图①~分别代表反应中的一种物质,请填空白: (1)①、③、④的化学式分别是_______。 (2)⑧与⑨反应的化学方程式是________。 分析:由题设条件“物质①受热分解得气体混合物”可判断①可能为浓HNO3或不稳定酸的铵盐等。常见的不稳定酸的铵盐有NH4HCO3,(NH4)2CO3,NH4HSO3等。假设①为NH4HCO3,则气体混合物将为NH3,CO2,H2O蒸气,代入题中可推知③为NH3,④为O2,②为CO2;又由转化关系可推知⑥为NO,⑦为NO2,⑧为HNO3,⑨、⑩一种为MgO,一种为C,因⑧⑨反应生成三种产物,则⑨为C。以上结果都是符合题意的,可见假设①为NH4HCO3是成立的。同理(NH4)2CO3亦合题意。 答案: ⑴①——NH4HCO3[(NH4)2CO3];③——NH3;④——O2; ⑵C+4HNO3(浓) 2H2O+4NO2↑+CO2↑ 【专家预测】 1.已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: (1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学程式为______________。 (2)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的化学式为 ___________________. (3)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)___________________。 (4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为________________。 (5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根离子外还存在的阴离子为___________ (填化学式)。 (6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为____________________________. (7)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成。则A生成B的化学方程式是_________________。 (7)由体积分数为75%的溶液可用作医疗消毒剂,可知A为乙醇,B为乙醛,C为乙酸。 【答案】 2.已知A、B、C、D、E、F、G和X八种物质存在如下图所示的转化关系。其中C是过渡元素的单质,其他元素均是短周期元素;B的浓溶液和稀溶液都能与C反应,但还原产物不同;反应⑤用于传统制镜工业,X是医疗上病人重要的营养补给物质(通过输液);F是大气污染物,也是汽车尾气的成分之一。请回答下列问题:(部分生成物未标出) (1)A、X的化学式分别是 , ;G溶液俗称为 。 (2)写出反应①的离子方程式 。 (3)写出E的分子式 ,请用电离方程式解释E的水溶液呈碱性的原因 。 (4)已知1gE与足量的空气混合,在加热及有催化剂存在下发生反应生成气态产物,放出热量13.3kJ,请写出该反应的热化学方程式 。 (5)为了消除F对大气的污染,工业上采用在催化剂作用下E与F反应,将其转化为无毒气体和水,请写出该反应的化学方程式 。 【解析】根据题意“反应⑤用于传统制镜工业,X是医疗上病人重要的营养补给物质(通过输液)”可知反应⑤为银镜反应,而X为葡萄糖溶液,G为银氨溶液;F是大气污染物,也是汽车尾气的成分之一可知F为二氧化氮,则B为硝酸,D为氧气,E为氨气,A为硝酸银,C为单质银。 【答案】(1)AgNO3,C6H12O6; 银氨溶液。 (2)4Ag+ + 2H2O4Ag + O2↑+ 4H+ (3)NH3 NH3 + H2ONH4+ + OH-(或NH3•H2ONH4+ + OH-) (4)4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) ΔH=–904.4 kJ·mol―1 (5)4NH3 + 6NO 5N2 + 6H2O 3.A、B、C、D四种元素原子的核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系: (1)写出F的电子式 。 (2)气体H有毒,可用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________。 (3)加热E的水溶液后并灼烧,最终得到的固体为 , 原因为 , 。(用化学反应方程式来表示) (4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的PH>7,则此溶液中离子浓度由小到大的顺序为: 。 (5)将气体H放在空气中充分燃烧可得到气体氧化物BO2,BO2可与氧气继续反应:2BO2+O2 2BO3,在一个固定容积为2L的密闭容器中充入0.20 mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则= molL-1min-1。若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于 之间。 【解析】由框图中信息:白色胶状沉淀G能溶于NaOH溶液,则可推测G为,Al(OH)3,H具有臭鸡蛋气味,则H为H2S,无色溶液I为KCl。据此可知E、F发生双水解,可能为AlCl3和K2S。再根据A、B、C、D四种元素原子的核电荷数依次增大,则E、F分别为AlCl3和K2S。 4.甲、乙、丙均为中学化学常见的气体单质,A、B、C为常见的化合物,已知: ⑴A和B都极易溶于水,用两根玻璃棒分别蘸取A和B的浓溶液后,相互靠近会看到白烟 ⑵各物质之间存在如下图所示的转化关系 请回答下列问题: ⑴写出物质A与B的化学式: 、 。 ⑵C溶液中离子浓度的大小关系是 。 ⑶“C溶液+镁粉→甲”的化学方程式为 。 ⑷丙气体通入200 mL氢氧化钠溶液中恰好完全反应,此时电子转移总数为0.1N A,则氢氧化钠溶液的pH为 。 ⑸常温下,向含白色沉淀M的浊液中加入氯化钠固体,M的溶解度将 (填“增大”、“减小”或“不变”),Ksp(M)将 (填“增大”、“减小”或“不变”)。 【解析】由(1)可知C必为氯化铵,由(2)看出氯化铵溶液与氢氧化钠溶液反应可得氨气,故A为氨气,氯化铵溶液与金属镁反应得氢气,则甲为氢气,从而推出乙为氮气,丙为氯气,M为氯化银。 【答案】(1)NH3 HCl (2)c(Cl)>c(NH4+)>c(H+)>c(OH-) (3)Mg+2NH4Cl=MgCl2+2NH3↑+H2↑ (4)14 (5)减小 不变 5.下图中的B~K分别代表有关反应的一种反 应物或生成物,其中A、C、F、K是固体;E是常见的气体单质,I是红棕色的气态氧化物。固态物质A(混合物)加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D。各物质间的转化关系如下图所示: 请回答下列问题: (1)B的化学式为_____________________, D的电子式_________________________. (2) 写出实验室检验A物质中含有的阳离子的方法 。 (3) 写出实验室制取B的化学方程式 。 (4) 将0.01mol D通入 1L 0.01mol/L F溶液中,所得溶液中所含离子浓度由大到小排列顺序为 。 (5) 写出N的稀溶液与过量的铁粉反应的离子方程式 。 (6) 若混合气体通过碱石灰得到的气体B与通过浓硫酸得到的气体D的物质的量之比是8∶5,则用物质的量的关系表示此固体A的组成为 。 (2)取适量A物质放入试管中,加入适量NaOH等强碱溶液并加热,若能产生使湿润的红色石蕊试纸变蓝的气体,则证明含有铵根离子。 (3)Ca(OH)2 + 2NH4Cl CaCl2 + 2H2O +2 NH3↑ (4)c (Na+)>c(HCO3-)> c (OH-)> c (H+)>c(CO32-) (5)3Fe + 8H+ + 2NO3- == 2NO↑+3Fe2+ + 4H2O (6)NH4HCO3和(NH4)2CO3按物质的量之比为2:3混合而成。 6.已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系 如下图:(注意:其中有些反应的条件及部分生成物被略去) 请填写下列空白: (1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为 ____________________________________________________________________; (2)从D溶液制备D的无水晶体的“操作a”为__________________________; (3)E的电子式为_________________________________; (4)反应⑤的化学方程式为_____________________________________________; (5)原电池反应①中正极的电极反应式为_________________________________。 【答案】(1)2Mg+CO2 2MgO+C; (2)将D溶液在HCl气流中蒸干; (3) (4)⑤C+4HNO3 CO2↑+4NO2↑+2H2O (5)2NH4++2e- = 2NH3↑+H2↑ 7.下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。 已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G为四原子10电子分子,化合物M由两种元素组成,分子内共有58个电子。 (1)写出F的化学式 、P的电子式 ; (2)在G的水溶液中,阳离子浓度最大的是 (用离子符号表示) (3)写出K与H反应的离子方程式 ;G与H反应的化学方程式 (4)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。用化学平衡移动的原理加以解释 。 【答案】(1) SO2 (2)NH4+ (2)2Fe2++ Cl2=2 Fe3+ + 2Cl- 4NH3+3Cl2=NCl3+3NH4Cl (3)饱和H水溶液中存在平衡:Cl2+H2OH++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 8.已知下图所示各物质的转化关系中,某些反应部分产物已被省去,其中反应② 用于常见金属Ⅰ的冶炼,B为淡黄色固体,D、G、H均为气体且D、H无色。 (1)溶液A为 (写名称),B的电子式: (2)反应①的离子方程式为: 反应③的离子方程式为: 反应④的化学方程式为: (3)有同学认为M也可由溶液K加热灼烧获得,试判断这种说法是否正确? (填“是”或“否”),理由是 (4)反应②中每生成1molD,同时生成 molⅠ。查看更多