- 2021-05-11 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018中考化学试题分类汇编及答案工业流程题
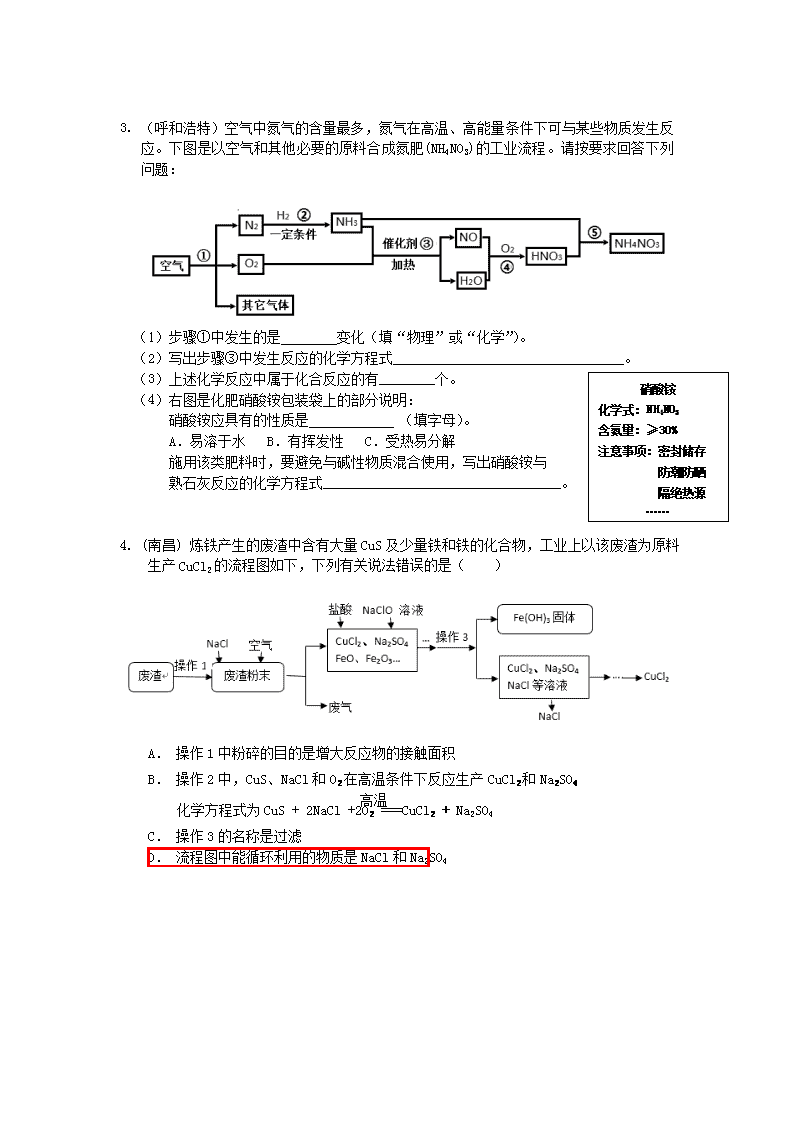
2018中考化学试题分类汇编——工艺流程题 1.(安徽)我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下: (1)反应①的化学方程式________________,反应②的基本反应类型为_______。 (2)工业上用分离液态空气 的方法制取氢气,属于_______变化(填“物理”或“化学”)。(3)操作a的名称是_____,实验室进行此操作所需的玻璃仪器有烧杯、玻璃棒、______。 (4)写出NH4Cl的一种用途________________。 2. (益阳)过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下: (1)气体X是CO2,其名称是 ;将过氧化钙晶体与溶液分离的方法是 。 (2)反应Y需控制温度在0~5℃,可将反应容器放在 中,该反应是化合反应,反应产物是CaO2·8H2O,请写出化学方程式 。获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是 。 (3)CaO2的相对分子质量为 ,过氧化钙晶体﹝CaO2·8H2O﹞中H、O元素的质量比为 。 (4)为测定制得的过氧化钙晶体中CaO2·8H2O的质量分数,设计的实验如下:称取晶体样品50g,加热到220℃充分反应(方程式为2CaO2·8H2O2CaO+O2↑+16H2O↑,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2·8H2O的质量分数(CaO2·8H2O相对分子质量为216),写出必要的计算过程。 3. (呼和浩特)空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。下图是以空气和其他必要的原料合成氮肥(NH4NO3)的工业流程。请按要求回答下列问题: (1)步骤①中发生的是________变化(填“物理”或“化学”)。 (2)写出步骤③中发生反应的化学方程式_________________________________。 硝酸铵 化学式:NH4NO3 含氮量:≥30% 注意事项:密封储存 防潮防晒 隔绝热源 …… (3)上述化学反应中属于化合反应的有________个。 (4)右图是化肥硝酸铵包装袋上的部分说明: 硝酸铵应具有的性质是 (填字母)。 A.易溶于水 B.有挥发性 C.受热易分解 施用该类肥料时,要避免与碱性物质混合使用,写出硝酸铵与 熟石灰反应的化学方程式__________________________________。 4. (南昌) 炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如下,下列有关说法错误的是( ) A. 操作1中粉碎的目的是增大反应物的接触面积 高温 B. 操作2中,CuS、NaCl和O2在高温条件下反应生产CuCl2和Na2SO4 化学方程式为CuS + 2NaCl +2O2 ===CuCl2 + Na2SO4 C. 操作3的名称是过滤 D. 流程图中能循环利用的物质是NaCl和Na2SO4 5. (扬州)醋酸钙[Ca(AC)2]是国家允许使用的补钙制剂之一。以蛋壳为原料回收膜并制备醋酸钙的一种工艺流程如下。 ⑴写出煅烧时的化学方程式 。CO2的任意排放会引发的环境问题是 。CO2与CH4一定条件下化合生成甲醛(HCHO),则此反应中与最佳质量比是 。下列做法能减少二氧化碳排放的是 。(填序号) ⑵在反应I中制备石灰乳,而不是制备澄清石灰水的目的是 。写出熟石灰的一种用途 。 ⑶在反应II中醋酸过量的目的是 。写出反应II的化学方程式 。 ⑷膜分离时,盐酸不能过量的主要原因是 。 6. (扬州)含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途 I.以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。 ⑴粉碎的目的是 。 ⑵若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管﹑玻璃棒﹑ 和 ,此处玻璃棒的作用是 。 ⑶物质X是 ,滤渣中含有的金属单质有 ,除铜时发生的反应属于 反应(填基本反应类型) ⑷流程中获得七水硫酸锌前省略的操作是 ﹑冷却结晶﹑ 洗涤和低温烘干。 ⑸某温度下,Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式 。 ⑹除铁过程中,温度pH对除铁效果的影响分别对如图所示。由图可知,除铁时温度应控制在 ℃为宜,pH应控制在 为宜。 II.以某菱锌矿(ZnCO3含量为62.5%)为原料制备锌的原理如下(假设杂质不参加反应): 则100吨这样的菱锌矿理论上最多制得锌多少吨?(写出计算过程) 7. (雅安) 绿矾又名七水硫酸亚铁(FeSO4·7H2O),其用途广泛,可用于制铁盐、氧化铁颜料、净水剂、防腐剂、消毒剂等。绿矾(FeSO4·7H2O)的一种综合利用工艺如下: (1)细铁丝在氧气中可以燃烧,请写出铁在氧气中燃烧的化学方程式 。 (2)绿矾与NH4HCO3在溶液中反应,有CO2生成,反应的化学方程式为 。 (3) 隔绝空气进行“焙烧”,铁元素的转化途径是,实际作还原剂的是CO。写出“焙烧”过程中各步反应的化学方程式: A.; B.____________________________________________; C.____________________________________________。 (4).母液“除杂”后,欲得到(NH4)2SO4粗产品,操作步骤依次为蒸发浓缩、____________、过滤、洗涤、干燥。 8. (厦门)黄铜矿(主要万分CuFeS2)经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4。某同学通过废铁屑与溶液甲反应,制取补血剂原料碳酸亚铁并回收铜。主要步骤如图7所示: 步骤Ⅰ:加入过量的废铁屑 充分反应,过滤 步骤Ⅲ 步骤Ⅱ 铜 FeCO3沉淀 不溶物 Fe2(SO4)3溶液 溶液甲 (1)Fe2(SO4)3与铁反应的化学方程式: x Fe2(SO4)3+ y Fe= z FeSO4,其中x、y、z为化学计量数,z的值为_____________。 (2)步骤Ⅰ中,生成铜的化学方程式:__________________________。 (3)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是__________________ __________________________________。 (4)步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析,该试剂可以是_____________(填化学式)。 (5)步骤Ⅲ回收铜的方法为_______________________________________。 9.(佛山)现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,以下是用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:[(NH4)2CO3溶液呈碱性,40 ℃以上时(NH4)2CO3分解]。 (1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器有玻璃棒、烧杯、 等。 (2)滤液Ⅰ中主要的阳离子是 等。 (3)加适量氨水的目的是 。 (4)根据题中信息,加入(NH4)2CO3后,该反应必须控制的条件是 。 (5)滤液Ⅱ中可回收的产品是 (写化学式)。 (6)写出在空气中煅烧FeCO3的化学反应方程式 。 10.(北京)生物浸出技术在金属冶炼中应用广泛。嗜热细菌在65-80℃酸性水溶液及氧气存在下,能氧化黄铜矿(主要成分)产生硫酸盐,进而生产铜和绿矾,主要流程如下: ⑴分离出矿渣的操作是 。 ⑵若试剂b为Fe粉,反应①的化学方程式为 。 ⑶氢氧化铁与试剂a发生中和反应,反应②的化学方程式为 。 11.(北京)某烟气脱硫的工艺不仅能消除,还能将其转化为石膏()等产品,实现“变废为宝”。主要物质转化关系如下: ⑴设备1中,通过喷淋水脱去烟气中的,该反应的化学方程式为 。 ⑵设备2中,加入的目的是将转化为 。 ⑶设备3中,反应前后化合价发生改变的元素是 。 12.(揭阳)某金属冶炼厂的工业废渣中含有泥沙和某些单质,其中单质含有铜、锌和少部分硫。现欲回收铜和锌,并对硫进行 处理,主要流程如下图所示: (1)在废气A中,一定含有的有害气体是 (填化学式)。操作①的操作名称是 。 (2)溶液D中含有的溶质是 (填化学式)。 (3)写出加入Zn后发生的化学方程式(写出其中之一即可) 。 参考答案: 1.(1)CaCO3 =CaO+CO2↑;分解反应。(2)物理;(3)过滤;漏斗。(4)做化肥或氮肥等。 2.(2)冰水混合物;CaO2+H2O2+7H2O=CaO2·8H2O;CaO或Ca(OH)2过量,且Ca(OH)2微溶 ;1∶10 解:设样品中CaO2·8H2O的质量为x 2CaO2·8H2O2CaO+O2↑+16H2O↑ 432 32 x 3.2 ∴x=43.2(g) ∴ 样品中CaO2·8H2O的质量分数为=86.4% 答:样品中CaO2·8H2O的质量分数为=86.4% 3.(1)物理 (2) 4NH3+5O2=4NO+6H2O (3)3 (4)A C 2NH4NO3+Ca(OH)2 =Ca(NO3)2 +2H2O+2NH3↑ 5.根据煅烧产生的CO2和蛋壳的主要成分为CaCO3,可以确定化学方程式。CO2的任意排放会引发温室效应;根据,计算CO2与CH4的质量比是44:16=11:4。⑵石灰乳中的Ca(OH)2含量比澄清石灰水中多,更利于提高醋酸钙的产量;⑶保证与Ca(OH)2完全反应,提高醋酸钙的含量;⑷加入盐酸就是为了将蛋壳与膜分开,过量的话会与CaCO3反应,会使制作醋酸钙的原料量减少。 6.⑴固体的表面积越大,化学反应速率越快。含锌废渣粉碎的目的是增大接触面积,加快反应速率,充分反应。 ⑵浓硫酸稀释过程中需用用到:量筒、滴管、细口瓶、玻璃棒和烧杯,通过比较可知,还缺少烧杯和量筒。此处玻璃棒的作用是搅拌,将热量及时地扩散。 ⑶加入过量的X,目的是除去铜,本小题实质是物质的除杂,既要除去杂质又要避免引入新的杂质,考虑到金属活动性顺序,故X可以是锌,滤渣含有锌和置换的铜,这个反应过程是置换反应。 ⑷这是分离可溶性固体和液体的方法:先将热的饱和溶液冷却,晶体就会析出,将此有晶体析出的饱和溶液,过滤,用少量的水洗涤,再低温烘干。所以操作的步骤是:加热浓缩,冷却结晶,过滤,洗涤和低温烘干 ⑸Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,铁的氧化物有三种,Fe2O3,FeO, Fe3O4.比较铁氧的质量比21:8只有Fe3O4符合题意。 ⑹关键看懂两张图的X轴和Y轴代表的含义,为了除铁效果最佳,我们需要找出最高除铁率对应的温度和pH. II.题目要求求出理论上最多制得锌多少吨 故设理论上最多制得锌的质量为X, 根据题意可知ZnCO3的质量是=100t×62.5%=62.5t 由两个方程式可知道 ZnCO3 ~ Zn 125 65 62.5t X x=32.5t 7.(1)3Fe+2O2Fe3O4(2分) (2)FeSO4·7H2O + 2NH4HCO3 = FeCO3 +(NH4)2SO4 + CO2↑+ 8H2O (2分) (3)CO2+C2CO (2分) FeO+COFe+CO2(2分) (4)降温结晶(或冷却热的饱和溶液)(2分) 8.(1)3(2)Fe+CuSO4=Cu+FeSO4(3)铁锈与硫酸反应生成硫酸铁(2分) (4)Na2CO3(或其他合理答案,2分)(5)加入过量的稀硫酸,过滤、洗涤、干燥 9.(1)漏斗 (2)H+ Fe2+ (3)中和过量的H2SO 4 (4)控制溶液的温度在40℃以下(5)(NH4)2SO4 (6)4FeCO3+O22Fe2O3+4CO2 10.(1)过滤(2)(3) 11.(1)(2)(3)O;S 12.(1)SO2; 过滤。 (2)ZnSO4、CuSO4 和H2SO4(3)Zn+H2SO4=ZnSO4+H2↑或Zn+CuSO4=Cu+ZnSO4查看更多