- 2021-11-11 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版九年级下册导学案课题1常见的酸和碱教学案
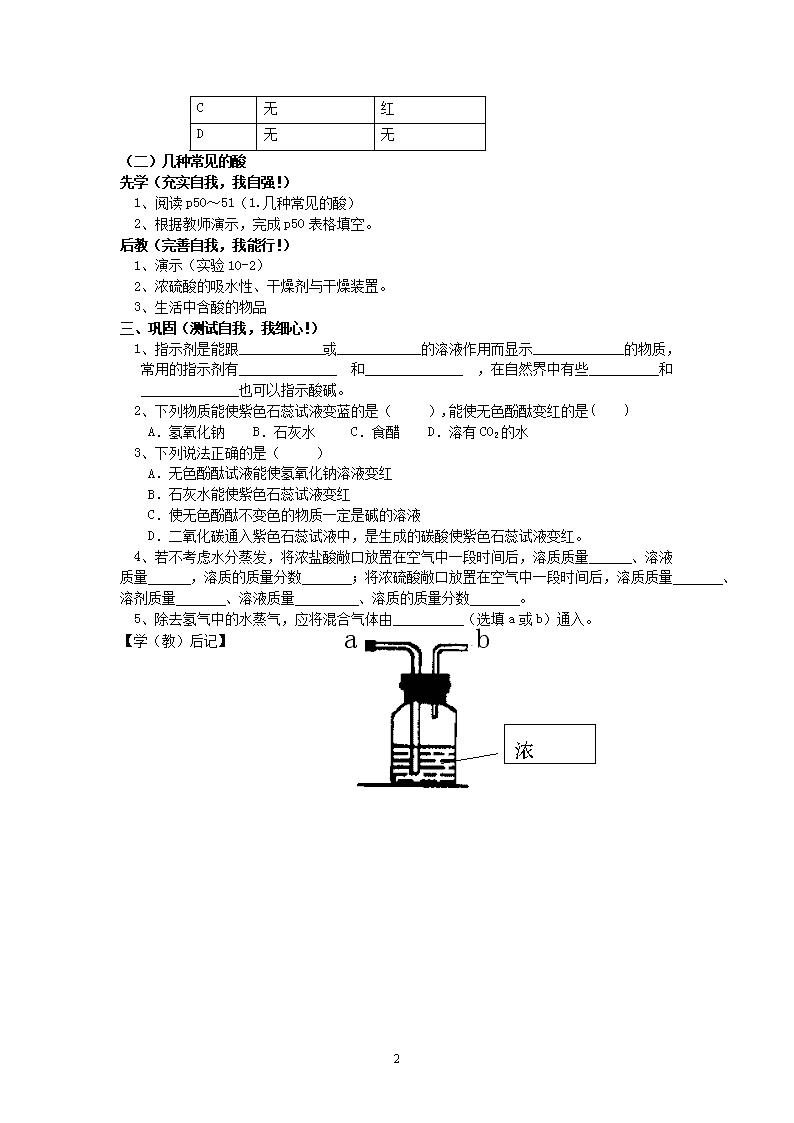
1 题 1 常见的酸和碱(第 1 课时)教学案 班级:初三( )姓名: 学科:化学 课型:新授 【学习目标】 1、了解常见酸碱指示剂及其变色情况。 2、初步了解用植物的花瓣或果实制取指示剂。 3、了解几种常见酸的基本性质 【学习重点】常见酸碱指示剂及其变色情况。 【学习难点】指示剂在酸性、碱性溶液中的颜色变化。 【学习过程】 一、复习(检查自我,我沉着!) 1、二氧化碳能使紫色石蕊溶液变红的原因 。 2、你所知道的酸的名称和化学式有: ( )、 ( )、 ( )等。 二、新授 (一)酸碱指示剂 先学(充实自我,我自强!) 1、酸碱指示剂: 2、常见的酸碱指示剂: 紫色石蕊溶液:遇酸变 遇碱变 无色酚酞溶液:遇酸变 遇碱变 后教(完善自我,我能行!) 1、简单解释常见的酸、碱及溶液 2、演示:[实验 10-1]学生进行实验,把实验现象填在下面的表格中,并进行如下讨论。 加入紫色石蕊溶液后的 颜色变化 加入无色酚酞溶液后的 颜色变化 食醋 石灰水 盐酸 氢氧化钠溶液 3、解释酸碱指示剂及对变色情况的记忆方法 4、一些植物浸出液在酸碱中的变色情况 讨论 1:表中的四种植物浸出液可否作酸碱指示剂? 讨论 2:下表是 A、B、C、D 四种植物的浸出液在不同物质中的颜色,其中能做酸碱指 示剂的是? 。 浸出液 在稀盐酸中 在石灰水中 A 红 红 B 蓝 红 指示剂 在不同溶液中的颜色变化 食醋 石灰水 盐酸 氢氧化钠溶液 牵牛花 红 蓝 红 蓝 月季花 红 草绿 红 草绿 紫卷心菜 红 绿 红 黄 紫罗兰 粉 绿 粉 绿黄 2 a b 浓 H2SO4 C 无 红 D 无 无 (二)几种常见的酸 先学(充实自我,我自强!) 1、阅读 p50~51(1.几种常见的酸) 2、根据教师演示,完成 p50 表格填空。 后教(完善自我,我能行!) 1、演示(实验 10-2) 2、浓硫酸的吸水性、干燥剂与干燥装置。 3、生活中含酸的物品 三、巩固(测试自我,我细心!) 1、指示剂是能跟____________或____________的溶液作用而显示_____________的物质, 常用的指示剂有______________ 和______________ ,在自然界中有些__________和 ______________也可以指示酸碱。 2、下列物质能使紫色石蕊试液变蓝的是( ),能使无色酚酞变红的是( ) A.氢氧化钠 B.石灰水 C.食醋 D.溶有 CO2 的水 3、下列说法正确的是( ) A.无色酚酞试液能使氢氧化钠溶液变红 B.石灰水能使紫色石蕊试液变红 C.使无色酚酞不变色的物质一定是碱的溶液 D.二氧化碳通入紫色石蕊试液中,是生成的碳酸使紫色石蕊试液变红。 4、若不考虑水分蒸发,将浓盐酸敞口放置在空气中一段时间后,溶质质量 、溶液 质量 ,溶质的质量分数 ;将浓硫酸敞口放置在空气中一段时间后,溶质质 量 、溶剂质量 、溶液质量 、溶质的质量分数 。 5、除去氢气中的水蒸气,应将混合气体由 (选填 a 或 b)通入。 【学(教)后记】 3 课题 1 常见的酸和碱(第 2 课时)教学案 班级:初三( )姓名: 学科:化学 课型:新授 编者:陈友楼 审核:备课组 【学习目标】 1.知道浓硫酸的特性(吸水性、腐蚀性); 2.知道浓硫酸的稀释方法; 3.掌握酸与指示剂、金属及金属氧化物反应的性质,能正确写出相关的化学方程式。 【学习重点】酸的化学性质及相关化学方程式的书写 【学习难点】与酸化学性质相关的化学方程式的书写 【学习过程】 一、复习(检查自我,我沉着!) 1、紫色 溶液:遇酸变 色,遇碱变 色。 2、无色 溶液:遇酸变 色,遇碱变 色。 3、浓盐酸具有 性,浓硫酸具有 性,可作为 剂。 二、新授 (一)浓硫酸的腐蚀性 先学(充实自我,我自强!) 1、浓硫酸有强列的腐蚀性,能使纸张、木材等变成 色; 2、稀释浓硫酸的方法:一定要把 沿 慢慢注入 里, 并不断 。 3、浓硫酸沾到皮肤或衣服上,应立即用 ,然后涂上 。 后教(完善自我,我能行!)二、常见的酸 1、演示实验 10-3:浓硫酸的腐蚀性 2、演示实验 10-4 稀释浓硫酸 概括稀释浓硫酸的操作要点: (二)几种常见的酸 先学(充实自我,我自强!) 1、填写 P53 图 10-6 表格。酸能使紫色石蕊试液变 ,无色酚酞试液 。 2、填写 P53 金属与酸反应化学方程式。 后教(完善自我,我能行!) 1、演示(图 10-6):酸(稀盐酸、稀硫酸)与指示剂作用 2、金属与酸反应化学方程式书写特点,补充 Al + HCl—— Al + H2SO4—— 3、演示铁锈与盐酸、硫酸的反应,分析化学方程式书写特点, 分析生锈铁钉放入过量盐酸中的现象及原因 补充: CuO + HCl—— CuO + H2SO4—— 三、巩固(测试自我,我细心! 1、对稀释浓硫酸的操作正确的是( ) A.没有特殊要求 B.把浓硫酸沿器壁慢慢地注入水中,并不断搅动 C.把水缓缓地倒入浓硫酸中,并不断搅动 D.迅速将浓硫酸倒入水中后搅动 4 2、书写下列反应的化学方程式: 与稀盐酸反应 与稀硫酸反应 铁 锌 镁 铝 3、书写下列反应的现象及化学方程式 现象 化学方程式 铁锈与 盐酸 铁锈与 硫酸 氧化铜 与盐酸 氧化铜 与硫酸 【学(教)后记】 5 课题 1 常见的酸和碱(第 3 课时)教学案 班级:初三( )姓名: 学科:化学 课型:新授 编者:陈友楼 审核:备课组 【学习目标】 1.知道氢氧化钠和氢氧化钙的物理性质、俗名及用途; 2.了解碱与指示剂、非金属氧化物的反应; 3.知道酸、碱具有相似化学性质的原因,及酸、碱溶液的构成粒子。 【学习重点】碱的相关化学性质。 【学习难点】碱的相关化学方程式的书写。 【学习过程】 一、复习(检查自我,我沉着!) 1、稀释浓硫酸的方法:将 注入 中; 2、写出下列反应的化学方程式: 铁+盐酸 锌+硫酸 镁+盐酸 铝+硫酸 铁锈+盐酸 铁锈+硫酸 二、新授 (一)几种常见的碱 先学(充实自我,我自强!) 1、氢氧化钠俗称: 、 、 ; 2、氢氧化钠固体具有 性,因而可做为 剂; 3、氢氧化钙俗称: 、 ,其水溶液称为 4、氢氧化钠用途 , 氢氧化钙用途 。 后教(完善自我,我能行!) 1、演示实验 10-6:氢氧化钠固体置于空气中。如何记俗名。学生填 P54 表。 2、固体干燥剂与干燥器 3、演示实验 10-7:生石灰加水,如何记俗名。 (二)碱的化学性质 先学(充实自我,我自强!) 1、碱能使紫色石蕊试液变 ,无色酚酞试液 。 2、分别写出二氧化碳与石灰水、氢氧化钠反应的化学方程式。 、 后教(完善自我,我能行!) 1、演示(图 10-8):氢氧化钠、氢氧化钙与指示剂 2、关于二氧化碳与石灰水反应的应用: ⑴二氧化碳的鉴定(检验) ⑵建筑上 ⑶久置石灰水中白色固体的形成及清洗 3、关于二氧化碳与氢氧化钠的反应 ⑴氢氧化钠的保存; ⑵化学方程式书写特点及三氧化硫与氢氧化钠的反应。 4、演示实验 10-8。分析酸、碱溶液的构成粒子及酸、碱具有相似化学性质的原因 三、巩固(测试自我,我细心! 1、写出下列反应的化学方程式 6 ⑴二氧化碳的检验: ; ⑵二氧化碳和氢氧化钠反应: ; ⑶二氧化硫和氢氧化钠反应: ; ⑷三氧化硫和氢氧化钠反应: 。 2、写出硫酸溶液中所含粒子的符号: 、 、 。 3、能用氢氧化钠干燥的气体是 ( ) A.二氧化碳 B.一氧化碳 C.二氧化硫 D.氢气 4、下列关于氢氧化钠的性质叙述不正确的是( ) A.氢氧化钠溶液能使紫色石蕊试液变红 B.可作某些气体的干燥剂 C.广泛用于肥皂、石油、造纸等工业 D.对皮肤、衣服有强烈腐蚀作用 5(附加题)、化学反应往往伴随着一些现象发生,但 CO2 与 NaOH 溶液的反应没有明显的现 象。为了通过一些现象说明 CO2 与 NaOH 发生了反应,某班同学分两组作了如下探究实验: (1)第一组同学把一支收集有 CO2 的试管倒立在装有饱和 NaOH 溶液的烧杯中(如下图所示), 看到试管内液面 。( 选填上升、下降、不变) (2)第二组同学从中得到启发,也设计了如下实验装置进行探究: A 现象为 ,B 现象为 , C 现象为 。 (3)同学们经过分析讨论,认为第一组的实验中产生液面上升现象的原因可能有两种。一 种是因为 CO2 与溶液中的 NaOH 反应,消耗了 CO2,你认为另一种原因是 。 (4)为了进一步证实 CO2 与 NaOH 溶液已经发生了反应,他们设计了如下方案:取上述实验后 的溶液,滴加 ,现象为 。 【学(教)后记】查看更多