高二化学上学期期中联考试题(1)
2018学年第一学期温州“十五校联合体”期中考试联考
高二年级 化学学科 试题
考生须知:
1.本卷共7页满分100分,考试时间90分钟;
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
3.所有答案必须写在答题纸上,写在试卷上无效;
4.考试结束后,只需上交答题纸。
5.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 Cl-35.5 Fe-56
选择题部分
一、选择题(本题共24小题,每小题2分,共48分。每小题列出的四个备选项中只有一个是符合题目要求,不选、多选、错选均不得分)
1.下列能源中,大量使用会导致全球进一步变暖、雾霾天气增多的是
A.化石能源 B.太阳能 C.氢能 D.地热能
2.下列反应中,属于吸热反应的是
A.乙醇燃烧 B.碳酸钙受热分解
C.氧化钙溶于水 D.盐酸和氢氧化钠反应
3.下列物质中,属于强电解质的是
A.H2O B.NaOH C.NH3·H2O D.CH3COOH
4.下列物质的电离方程式正确的是
A.HClO=H++Cl- B.H2CO32H++CO32-
C.NaHCO3=Na++H++CO32- D.KOH=K++OH-
5.仪器名称为“酸式滴定管”的是
- 12 -
A. B. C. D.
6.在体积可变的容器中发生反应N2+3H2⇌NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多
D.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞
7.下列物质的水溶液因水解而呈酸性的是
A.NaHCO3 B.FeSO4 C.Ca(ClO)2 D.NaHSO4
8.通过以下反应均可获取H2。下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) ΔH1= +571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) ΔH2= +131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH3= +206.1kJ·mol–1
A.反应①中电能转化为化学能 B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小 D.反应CH4(g) = C(s)+2H2(g)的ΔH= +74.8kJ·mol–1
9.关于下列装置的说法,正确的是
A.装置①中盐桥内的K+移向CuSO4溶液 B.装置①将电能转变为化学能
C.若装置②用于铁棒镀铜,则N极为铁棒
D.若装置②用于电解精炼铜,精炼过程溶液中的Cu2+浓度保持不变
- 12 -
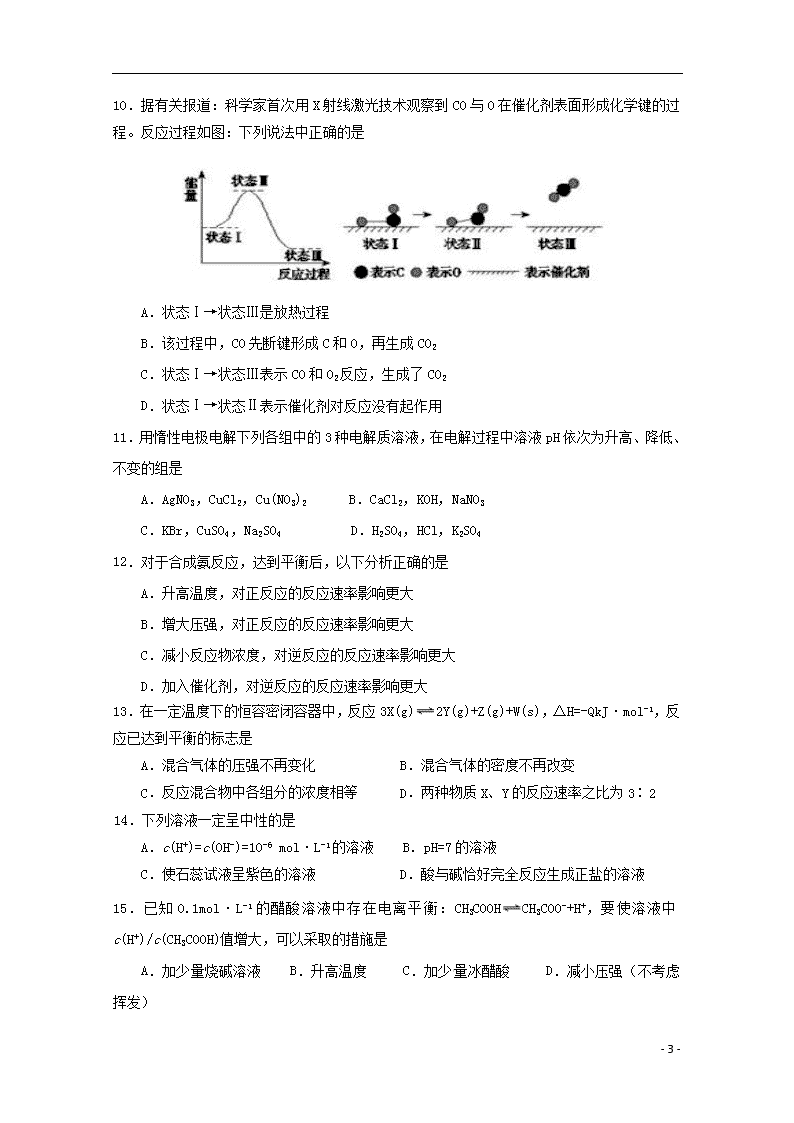
10.据有关报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程如图:下列说法中正确的是
A.状态Ⅰ→状态Ⅲ是放热过程
B.该过程中,CO先断键形成C和O,再生成CO2
C.状态Ⅰ→状态Ⅲ表示CO和O2反应,生成了CO2
D.状态Ⅰ→状态Ⅱ表示催化剂对反应没有起作用
11.用惰性电极电解下列各组中的3种电解质溶液,在电解过程中溶液pH依次为升高、降低、不变的组是
A.AgNO3,CuCl2,Cu(NO3)2 B.CaCl2,KOH,NaNO3
C.KBr,CuSO4,Na2SO4 D.H2SO4,HCl,K2SO4
12.对于合成氨反应,达到平衡后,以下分析正确的是
A.升高温度,对正反应的反应速率影响更大
B.增大压强,对正反应的反应速率影响更大
C.减小反应物浓度,对逆反应的反应速率影响更大
D.加入催化剂,对逆反应的反应速率影响更大
13.在一定温度下的恒容密闭容器中,反应3X(g)2Y(g)+Z(g)+W(s),ΔH=-QkJ·mol-1,反应已达到平衡的标志是
A.混合气体的压强不再变化 B.混合气体的密度不再改变
C.反应混合物中各组分的浓度相等 D.两种物质X、Y的反应速率之比为3∶2
14.下列溶液一定呈中性的是
A.c(H+)=c(OH-)=10-6 mol·L-1的溶液 B.pH=7的溶液
C.使石蕊试液呈紫色的溶液 D.酸与碱恰好完全反应生成正盐的溶液
15.已知0.1mol·L-1的醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
A.加少量烧碱溶液 B.升高温度 C.加少量冰醋酸 D.减小压强(不考虑挥发)
- 12 -
16.常温下,0.1mol·L-1某一元酸(HA)溶液中=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10mol·L-1
B.溶液中c(H+)+c(A-)=0.1mol·L-1
C.上述溶液加NaA晶体,溶液的c(OH-)增大
D.常温下将HA稀释十倍,氢离子浓度变为原来的十分之一
17.下列说法中,正确的是
A.凡是放热反应都是自发反应 B.凡是熵增大的反应都是自发反应
C.要判断反应进行的方向,必须综合考虑体系的焓变和熵变
D.过程的自发性不仅能用于判断过程的方向,还能确定过程是否一定能迅速发生
18.某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热。下列说法中,正确的是
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若将盐酸体积改为60 mL,理论上所求中和热不相等
19.相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是
A.pH相等的两溶液:c(CH3COO-)=c(Cl-)
B.中和相同物质的量的NaOH时,盐酸的体积小
C.同pH值时,稀释相同倍数后,醋酸溶液的pH值大
D.与铁粉反应,产生气体的速率盐酸快
20.N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是
A.N2(g)+3H2(g)2NH3(l) ΔH=2(a-b-c) kJ·mol-1
- 12 -
B.N2(g)+3H2(g)2NH3(g) ΔH=2(b-a) kJ·mol-1
C.1/2N2(g)+3/2H2(g)NH3(l) ΔH=(b+c-a) kJ·mol-1
D.1/2N2(g)+3/2H2(g)NH3(g) ΔH=(a+b) kJ·mol-1
21.锌-空气电池适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时,下列说法正确的是
A.电池工作时溶液中的OH-向石墨电极移动
B.Zn电极发生了氧化还原反应
C.电子经过溶液移向石墨电极
D.锌电极的电极反应式:Zn + 2OH--2e- = ZnO + H2O
22.在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率如下表数据所示,下列判断不正确的是
v/mol·L-1·min-1
T/K
c/mol·L-1
0.600
0.500
0.400
0.300
318.2
3.60
3.00
2.40
1.80
328.2
9.00
7.50
a
4.50
b
6.30
5.25
4.20
3.15
A.a=6.00
B.不同温度、不同蔗糖初始浓度的条件下,v可能相同
C.318.2
c(A-)
B.b点时,消耗的NaOH溶液的体积大于20mL
C.c点时,2c(Na+)=3c(A-)+3c(HA)
- 12 -
D.水的电离程度:c>b>
非选择题部分
二、非选择题(本大题共5小题,共52分)
25.(12分)合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化。为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)2CO(g) ∆H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
回答下列问题:
(1)p1、p2、p3的大小关系是______________,图中a、b、c三点对应的平衡常数大小关系是______________________。
(2)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:
反应1:CO(g)+3H2(g)CH4(g)+H2O(g) ∆H1= a kJ/mol
反应2:CO(g)+H2O(g)CO2(g)+H2(g) ∆H2= b kJ/mol
① 则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是_________________________。
② 已知298 K时相关化学键键能数据为:
化学键
H—H
O—H
C—H
E/(kJ·mol-1)
436
465
413
1076
则根据键能计算,∆H1=________________。反应1自发的条件是_____________。(填“较高温度”、“较低温度”、“任意温度”)
(3)一定条件下,CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH3,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3
- 12 -
OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K值=_____________(用分数表示),若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡时CH3OH的转化率为_____________,若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是___________。(填“增大”、“减小”、“不变”)
26.(10分)近年来城市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g)2NO(g),是导致汽车尾气中含有NO的原因之一。请回答:
已知该反应在2400℃时,平衡常数K=6.4×10-3。该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2 mol·L-1和5.0×10-3 mol·L-1,此时反应_____________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(2)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可转化为N2(g)和CO2(g)得到净化。发生反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ∆H<0。在25℃、101kPa下,将4mol NO、4.8molCO通入固定容积为4L的密闭容器中,反应过程中部分物质的浓度变化如图所示。
①0~20min内,v(NO) =______________。
②25min时若改变反应条件,提高NO的转化率,则改变的条件可能是__________(填序号)。
a.升高温度 b.降低温度
c.增加CO的量 d.扩大容器体积
③25min时将容器体积快速压缩至2L,反应在t1时重新达到平衡状态,在上图中画出c(CO)的变化曲线示意图。
(3)工业上可用CO和甲醇在通电的条件下来合成乙酸,装置如图所示,阴极的电极反应式_____________________。
27.(10分)某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
- 12 -
装置
编号
电极A
溶液B
操作及现象
Ⅰ
Fe
pH=2的H2SO4
连接装置后,石墨表面产生无色气泡;电压表指针偏转
Ⅱ
Cu
pH=2的H2SO4
连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是______________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是________________________;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号
溶液B
操作及现象
Ⅲ
经煮沸的pH=2的 H2SO4
溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b
Ⅳ
pH=2的H2SO4
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c
Ⅴ
pH=12的NaOH
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是____________________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是__________________。
④为达到丁同学的目的,经讨论,同学们认为应改用右图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是___________________________。
- 12 -
28.(10分)常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00mL 0.1000 mol·L-1 HCl溶液和20.00mL0.1000mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示。
(1)滴定HCl溶液的曲线是__________(填“图1”或“图2”)。
(2)a=__________mL。
(3)E点对应离子浓度由大到小的顺序为______________________________。
(4)A、B、C、D、E点中c(Na+)=c(CH3COO-)的点是____________________。
(5)如果用0.1000 mol·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,在滴定过程中,下列4种离子的物质的量浓度排序不正确的是__________。
a.c(CH3COO-)>c(H+)>c(Na+)>c(OH-) b.c(H+)>c(OH-)>c(Na+)>c(CH3COO-)
c.c(Na+)>c(CH3COO-)=c(OH-)>c(H+) d.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(6)设CH3COOH的Ka=2.0×10-5,E点时溶液中CH3COO-的水解程度为0.1%,计算E点时溶液的pH为________________(可用对数值表示)。
29.(10分)滴定是一种化学实验操作也是一种定量分析的手段。它通过两种溶液的定量反应来确定某种溶质的含量。实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,其操作过程为:
① 准确称取4.080g邻苯二甲酸氢钾加入250mL锥形瓶中;
② 向锥形瓶中加30mL蒸馏水溶解;
③ 向溶液中加入1~2滴指示剂;
④ 用氢氧化钠溶液滴定至终点;
⑤ 重复以上操作;
⑥ 根据数次实验数据计算氢氧化钠的物质的量的浓度。
已知:Ⅰ、到达滴定终点时,溶液的pH约为9.1。
- 12 -
Ⅱ、邻苯二甲酸氢钾在水溶液中可以电离出一个H+
Ⅲ、邻苯二甲酸氢钾的相对分子质量为204
指示剂
酚酞
甲基橙
pH范围
<8.2
8.2 ~ 10
>10
<3.1
3.1 ~ 4.4
>4.4
颜色
无色
粉红色
红色
红色
橙色
黄色
(1)为标定氢氧化钠溶液的浓度,应选用___________作指示剂;
(2)完成本实验,已有电子天平、铁架台、滴定管夹、锥形瓶、烧杯等,还必须的仪器是:__________;
(3)判断到达滴定终点的实验现象是____________________________________________;
(4)在整个滴定过程中,两眼应该注视着________________________________________;
(5)滴定实验记录数据如下表,则NaOH溶液的浓度为______________;
实验编号
m(邻苯二甲酸氢钾)/g
V(NaOH)/mL
初始读数
末尾读数
1
4.080
0.50
20.52
2
4.080
1.00
20.98
3
4.080
0.20
24.80
(6)滴定过程中,下列操作能使测定结果(待测液的浓度数值)偏小的是____________。
A.上述操作中,将邻苯二甲酸氢钾直接放入锥形瓶中溶解
B.滴定管在滴定开始时尖嘴有气泡,滴定完成时气泡消失
C.滴定完毕,尖嘴外留有液滴或溶液滴在锥形瓶外
D.滴定前仰视读数而滴定终了俯视读数
- 12 -
2018学年第一学期温州“十五校联合体”期中考试联考
高二年级 化学学科 参考答案及评分标准
一、选择题(本大题共24小题,每小题2分,共48分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
A
B
B
D
A
C
B
D
A
A
C
B
B
题号
14
15
16
17
18
19
20
21
22
23
24
答案
A
B
C
C
B
A
A
D
D
A
C
二、非选择题(本大题共5小题,共52分)
25.(12分)
(1)p1c(CH3COO-)>c(OH-)c>c(H+)(2分);
(4)D(2分);
(5)bd(2分);
(6)8-lg2(2分)。
29.(10分)
(1)酚酞(1分);
(2)碱式滴定管(1分)、量筒、药匙(1分);
(3)滴入最后一滴NaOH溶液,溶液由无色变为浅红色,且在半分钟内不褪色(2分);
(4)锥形瓶内溶液颜色的变化(1分);
(5)1.000 mol·L-1(2分);
(6)BC(2分)。
- 12 -