- 2021-08-24 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高考化学二轮复习专题强化训练17化学工艺流程含解析
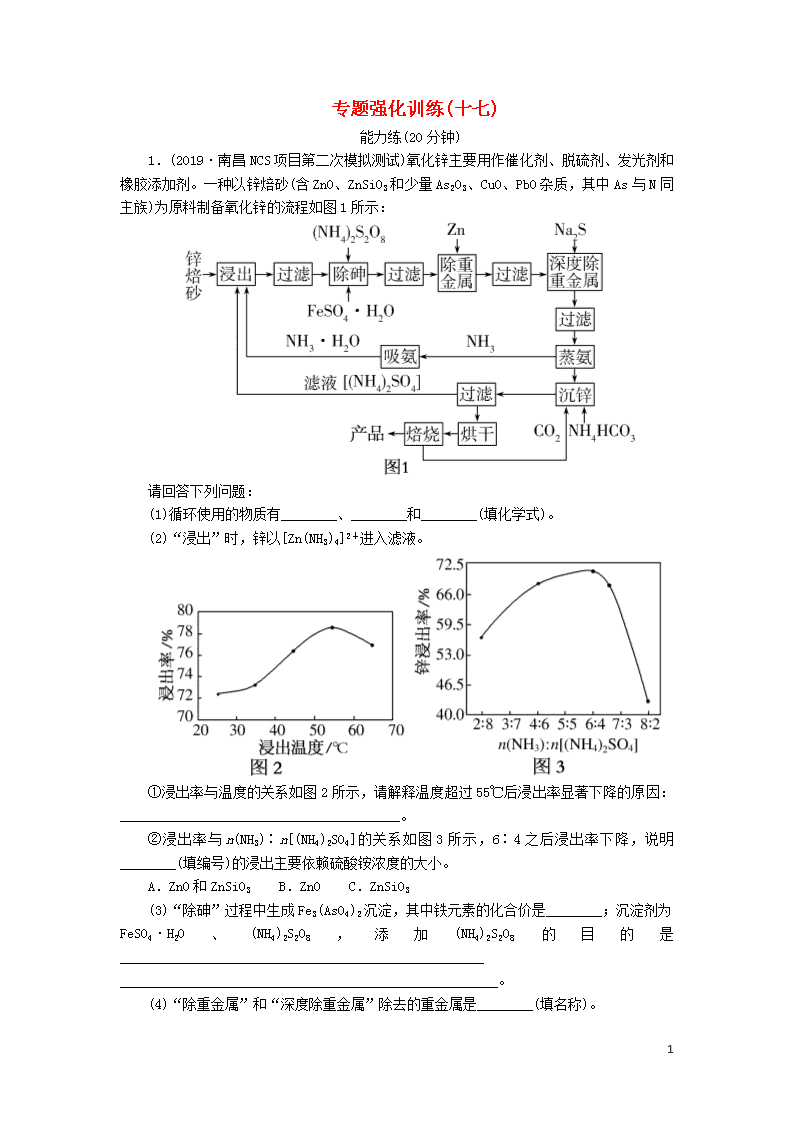
专题强化训练(十七) 能力练(20分钟) 1.(2019·南昌NCS项目第二次模拟测试)氧化锌主要用作催化剂、脱硫剂、发光剂和橡胶添加剂。一种以锌焙砂(含ZnO、ZnSiO3和少量As2O3、CuO、PbO杂质,其中As与N同主族)为原料制备氧化锌的流程如图1所示: 请回答下列问题: (1)循环使用的物质有________、________和________(填化学式)。 (2)“浸出”时,锌以[Zn(NH3)4]2+进入滤液。 ①浸出率与温度的关系如图2所示,请解释温度超过55℃后浸出率显著下降的原因:________________________________________。 ②浸出率与n(NH3)∶n[(NH4)2SO4]的关系如图3所示,6∶4之后浸出率下降,说明________(填编号)的浸出主要依赖硫酸铵浓度的大小。 A.ZnO和ZnSiO3 B.ZnO C.ZnSiO3 (3)“除砷”过程中生成Fe3(AsO4)2沉淀,其中铁元素的化合价是________;沉淀剂为FeSO4·H2O、(NH4)2S2O8,添加(NH4)2S2O8的目的是____________________________________________________ ______________________________________________________。 (4)“除重金属”和“深度除重金属”除去的重金属是________(填名称)。 9 (5)“蒸氨”的产物主要是ZnSO4和NH3,写出所发生反应的化学方程式_______________________________________________。 [解析] (1)根据“主线主产品,分支副产品,回头为循环”知,该工艺流程中可循环使用的物质有NH3·H2O或NH3、(NH4)2SO4、CO2。(2)①“浸出”时,温度过高,氨气挥发而使溶液浓度下降,因此浸出率下降。②ZnO既可以用NH3·H2O浸出,又可以用(NH4)2SO4浸出,生成[Zn(NH3)4]2+,n(NH3)∶n[(NH4)2SO4]=6∶4之后,(NH4)2SO4的浓度下降,浸出率下降,说明ZnSiO3的浸出主要依赖硫酸铵浓度的大小。(3)Fe3(AsO4)2中阴离子为AsO,故铁元素的化合价为+2。锌焙砂所含杂质As2O3中砷元素的化合价为+3,除砷过程中生成Fe3(AsO4)2沉淀,砷元素的化合价升高,被氧化,故添加(NH4)2S2O8的目的是把+3价砷氧化成AsO以便除去砷元素。(4)根据锌焙砂所含杂质,“除重金属”和“深度除重金属”除去的重金属是铜和铅。(5)“蒸氨”时Zn(NH3)4SO4发生分解反应:Zn(NH3)4SO4ZnSO4+4NH3↑。 [答案] (1)NH3·H2O或NH3 (NH4)2SO4 CO2 (2)①温度升高,氨气挥发,溶液浓度下降,浸出率下降 ②C (3)+2 把+3价砷氧化成AsO以便除去砷元素 (4)铜和铅 (5)Zn(NH3)4SO4ZnSO4+4NH3↑ 2.(2019·长沙四校二模)一种从冶铅废渣中提取铅的工艺流程如图所示: 已知:醋酸铅易溶于水,难电离。火法炼铅是将方铅矿(主要成分为PbS)在空气中焙烧,生成PbO和SO2。 回答下列问题: (1)用方铅矿火法炼铅的反应的化学方程式为_______________ ________________________________________________________。 (2)火法炼铅的废气中含SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为____________________________________ ________________________________________________________。 (3)冶铅废渣用硫酸洗涤后,生成的PbSO4表面常含有铜单质,为了溶解铜单质,常需要同时加入一定量的H2O2溶液,写出溶解铜单质发生反应的离子方程式____________________________;为加快此反应的速率,下列方法合理的是________(填标号)。 9 A.搅拌 B.适当加热 C.减压 (4)将饱和Na2CO3溶液加入滤渣1中发生的反应为CO(aq)+PbSO4(s)PbCO3(s)+SO(aq),以PbCO3和焦炭为原料在高温条件下可制备金属铅,用化学方程式表示制备过程____________。 (5)工业上常用等体积的饱和NaHCO3溶液代替饱和Na2CO3溶液,将一定量的PbSO4转化为PbCO3。PbSO4与NaHCO3或Na2CO3的物质的量之比不同时,PbSO4的转化率如表所示。 Ⅰ n(PbSO4)∶n(NaHCO3) 1∶1.5 1∶2 1∶3 PbSO4的转化率% 95.5 96.9 97.8 Ⅱ n(PbSO4)∶n(Na2CO3) 1∶1.5 1∶2 1∶3 PbSO4的转化率% 98 98 98 依据表中数据,物质的量之比相同时,Ⅱ中PbSO4的转化率比Ⅰ中的略大,原因是__________________________________________ __________________________________________________________。 [解析] (1)由火法炼铅是将方铅矿在空气中焙烧,生成PbO和SO2,可知发生反应的化学方程式为2PbS+3O22PbO+2SO2。(2)SO2与过量的氨水反应生成亚硫酸铵,反应的离子方程式为2NH3·H2O+SO2===2NH+SO+H2O。(3)酸性条件下铜被H2O2氧化为Cu2+,反应的离子方程式是Cu+H2O2+2H+===Cu2++2H2O;搅拌能加快反应速率,适当升高温度可使反应速率加快,该反应没有气体参与,减压对反应速率无影响,故选AB。(4)以PbCO3和焦炭为原料制备Pb的反应的化学方程式为PbCO3PbO+CO2↑、2PbO+C2Pb+CO2↑(或PbO+CPb+CO↑)。(5)物质的量之比相同时,Na2CO3溶液中c(CO)比NaHCO3溶液中的大,故Ⅱ中PbSO4的转化率比Ⅰ中的略大。 [答案] (1)2PbS+3O22PbO+2SO2 (2)2NH3·H2O+SO2===2NH+SO+H2O (3)Cu+H2O2+2H+===Cu2++2H2O AB (4)PbCO3PbO+CO2↑、2PbO+C2Pb+CO2↑(或PbO+CPb+CO↑) (5)物质的量之比相同时,Na2CO3溶液中c(CO)比NaHCO3溶液中的大 3.(2019·济南模拟)工业上,从精制黑钨矿(FeWO4、MnWO4)中提取金属钨的一种流程如图所示,该流程同时获取副产物Fe2O3和MnCl2。 9 已知:Ⅰ.过程①~④中,钨的化合价均不变; Ⅱ.常温下钨酸难溶于水; Ⅲ.25℃时,Ksp[Fe(OH)3]=1.0×10-38、 Ksp[Mn(OH)2]=4.0×10-14。 回答下列问题: (1)上述流程中的“滤渣1”除MnO2外还有________,“气体”除水蒸气、HCl外还有________(均填化学式)。 (2)过程①中MnWO4参与反应的化学方程式为____________________________________;FeWO4参与的反应中氧化剂与还原剂的物质的量之比为________。 (3)已知:WO3(s)+3H2(g)===W(s)+3H2O(g) ΔH=a kJ·mol-1 WO3(s)===WO3(g) ΔH=b kJ·mol-1 写出WO3(g)与H2(g)反应生成W(s)的热化学方程式: ______________________________________________________。 (4)过程⑦在25℃时调pH,至少应调至________(当离子浓度等于1.0×10-5 mol·L-1时,可认为其已沉淀完全)。 (5)过程⑧要获得MnCl2固体,在加热时必须同时采取的一项措施是_____________________________________________________。 (6)钠钨青铜是一类特殊的非化学计量比化合物,其通式为NaxWO3,其中0查看更多
相关文章
- 当前文档收益归属上传用户