2020届高三化学第七次月考试题 人教 目标版
2019第七次月考理科综合化学试卷
7.化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
A.铁粉和碳粉的混合物可作食品抗氧化剂
B.共享单车利用太阳能发电完成卫星定位,有利于节能环保
C.补铁剂与维生素C共同服用可提高补铁效果
D.光导纤维、醋酸纤维、硝酸纤维都是以纤维素为原料的化工产品
8.下列依据实验操作及现象得出的结论正确的是( )
选项
实验操作
现象
结论
A
向亚硫酸钠试样中滴入盐酸酸化的Ba(ClO)2 溶液
产生白色
沉淀
试样已氧化变质
B
向Co2O3中滴入浓盐酸
产生黄绿色
气体
氧化性: Co2O3>Cl2
C
向待测液中依次滴入氯水和KSCN溶液
溶液变为
红色溶液
待测液中含有Fe2+
D
向Na2SO4和Na2CO3混合溶液中滴入AgNO3 溶液
产生白色
浑浊
Ksp(Ag2SO4)
Z>X>Y
C.Y单质着火可用泡沫灭火器灭火
D.X单质可从W的简单氢化物中置换出W单质
12.中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是( )
A.吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3-
B.电解池中质子从电极I向电极Ⅱ作定向移动
C.电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2
D.每处理1 mol NO电解池质量减少16g
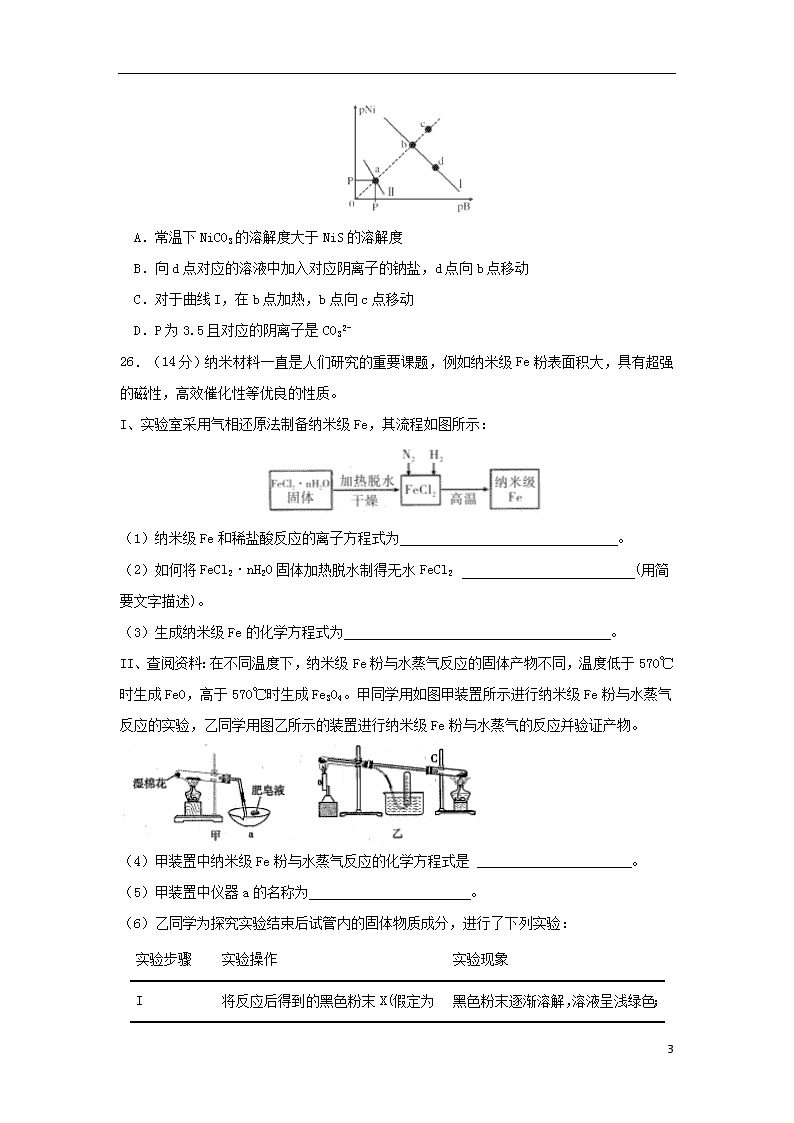
13.已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1. 0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是( )
9
A.常温下NiCO3的溶解度大于NiS的溶解度
B.向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C.对于曲线I,在b点加热,b点向c点移动
D.P为3.5且对应的阴离子是CO32-
26.(14分)纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:
(1)纳米级Fe和稀盐酸反应的离子方程式为 。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2 (用简要文字描述)。
(3)生成纳米级Fe的化学方程式为 。
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。
(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是 。
(5)甲装置中仪器a的名称为 。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤
实验操作
实验现象
I
9
将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热
黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生
II
向实验I得到的溶液中滴加几滴KSCN溶液,振荡
溶液没有出现红色
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字描述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________(结果保留三位有效数字)。
27.(15分)铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程
已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有 (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序 。
a加入过量的NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是 。
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式 。
②若用浓HNO3溶解金属硫化物,缺点是 (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是 (填离子符号)
9
,为使铜离子开始沉淀,常温下应调节溶液的pH值大于 。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是 。
28.(14分)氮的固定对工农业及人类生存具有重大意义。
Ⅰ.合成氨是最重要的人工固氮:N2(g)+3H2(g)2NH3(g)。
(1)下列关于该反应的说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S>0 D.△H<0,△S<0
(2) —定温度下,在容积为1L的密闭容器中,加入ImolN2和3molH2,反应达到平衡时H2的转化率为60%,则此条件下反应的平衡常数K= (此处不要求写单位);保持容器体积不变,再向容器中加入lmolN2,3molH2反应达到平衡时,氢气的转化率将 。 (填“增大”、“减小”或“不变”)
(3)标准状况下,若将22.4mL的氨气通入100mLpH为2的盐酸中.则溶液中各离子浓度的顺序由大到小为 。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,充分反应后,过滤所得滤液为(NH4)2SO4溶液,该过程的化学方程式为 。
II.随着研究的不断深入,科学家发明了越來越多有关氮的固定方法。
(5)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现常压、570℃高温的电解法合成氨,提高了反应物的转化率,其实验简图如下,阴极的电极反应式为 。
(6)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:
2N2(g)+6H2O4NH3(g)+3O2(g),则其反应热△H= 。(已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g) 2H2O(I) △H=-571.6kJ·mol-1)
35.[化学选修3一物质结构与性质](15分)
含钴化合物在机械制造、磁性材料等领域具有广泛的应用,请回答下列问题:
(1)基态Co3+的价电子排布图为 。
9
(2)钴的配合物[Co(NH3)5Br](NO3)2
①第一电离能N O(填“大于”、“小于”或“不能确定”);两种配位原子的杂化轨道类型均为 ;
②钴离子周围配位键数目(配位数)是 ;N03-的空间构型为 ;
③已知Br的含氧酸酸性由强到弱的顺序为HBrO4>HBrO3>HBrO2>HBrO,其原因是 。
(3)某钴氧化物品体具有CoO2的层状结构如下图所示(小球表示Co,大球表示O)。下列用粗线面出的结构单元不能描述CoO2)的化学组成的是
(4)Co的另一种氧化物的晶胞如图,已知钴原子的半径为apm,氧原子的半径为b pm,它们在晶体中是紧密接触的,钴原子填在氧原子的 填“正八面体”、“正四面体”或“立方体”)空隙;钴原子与跟它次近邻的氧原子之间的距离为 ;在该钴的氧化物品体中原子的空间利用率为 (均用含a、b的计算表达式表示)。
36.[化学选修5—有机化学基础](15分)由芳香烃X合成一种功能高分子H的过程如下。(部分产物、合成路线、反应条件略去)。
其中A是一氯代物,H的链节组成为C7H5NO
已知:I芳香烃X用质谱仪测出的质谱图如图所示
请根据所学知识与本题所给信息回答下列问题
9
(1)H的结构简式是 ;(2)反应③和④的类型分别是 、
(3)反应⑤的化学方程式是
(4)阿司匹林中含氧官能团的名称为
(5)的一种同系物有多种同分异构体,其中符合下列要求
的共有 种(不考虑立体异构),写出其中核磁共振氢谱为6组峰,且峰面积比为2:2:2:2:1:1的结构简式
①能与 NaHCO3反应放出CO2
②能与FeCl3溶液发生显色反应
③苯环上的一取代物有两种
(6)请用合成反应流程图表示出由A和其他无机物合成最合理的方案。
例:
。
9
化学参考答案:
7-13: D B C A D A C
26(14分):(1) Fe+2H+=Fe2+ + H2 ↑( 2分) (2) 在干燥的HC1气流中加热 ( 2分)
(3) FeCl2+H2 Fe+2HCl ( 2分) (4) Fe+H2O(g)FeO+H2 ( 2分) (5) 蒸发皿(2分) (6) 加入KSCN溶液,溶液没有出现红色,也可能是因为Fe过量,与生成的Fe3+反应转化为Fe2+ ( 2分) (7) 67.4%( 2分)
【解析】(7)用乙装置反应,反应温度高于570℃,则Fe粉与水蒸气反应的固体产物为Fe3O4。反应后所得固体的质量为6.88g,其中氧原子的质量为m(O)=6.88g-5.60g=1.28g,则n(O)==0.08mol。由关系式1 Fe3O4~4 O,可得n(Fe3O4)=0.02mol。所以固体物质中氧化物的质量分数== ≈67.4%
27(15分)、 Na2SiO3、Na2BeO2 (2分) BeO22-+4H+=Be2++2H2O ( 2分)
cefd (2分) 蒸发结晶时,向溶液中持续通入氯化氢气体 (2分)
MnO2+CuS+2H2SO4=S↓+MnSO4+CuSO4+2H2O( 2分)
产生污染环境的气体(合理即可) ( 1分)
Fe3+ ( 1分) 4 ( 1分) 90%( 2分)
28(14分)、(1)D (2分) (2)25/12 (或2.08) (2分); 增大(2分)
(3)c(Cl-)>c(NH4+)>c(H+)>c(OH-) (2分)
(4)CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4 (2 分)
(5)N2+6e-+6H+ = 2NH3 (2 分)(6)+1530.0kJ·mol-1 (2分)
35(15分)、( 1分) 大于( 1分)
sp3 ( 1分) 6 ( 1分) 平面(正)三角形( 1分)
含氧酸的中心元素相同时,非羟基氧越多,中心元素的正电性越高,导致Br-O-H中的O的电子向Br偏移,在水分子作用下也就越易电离H+ (2分)
D( 2分) 正八面体 ( 2分) ( 2分) ( 2分)
9
36(15分)、(2分) 还原反应、缩聚反应 (2分) ( 2分)
酯基 、 羧基(2分) 16(2分)
(2分)
( 3分)
9