- 2021-07-08 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届浙江学考一轮复习考点精讲通用版考点41化学反应速率与平衡图像分析学案
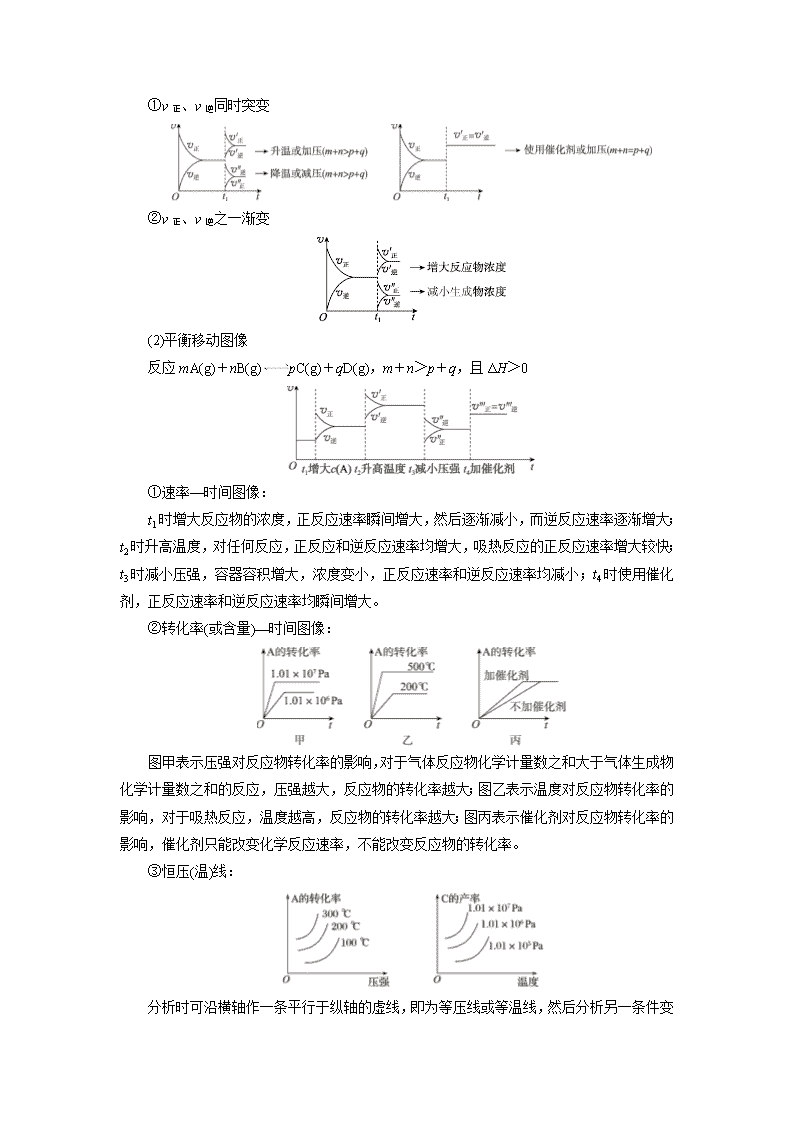
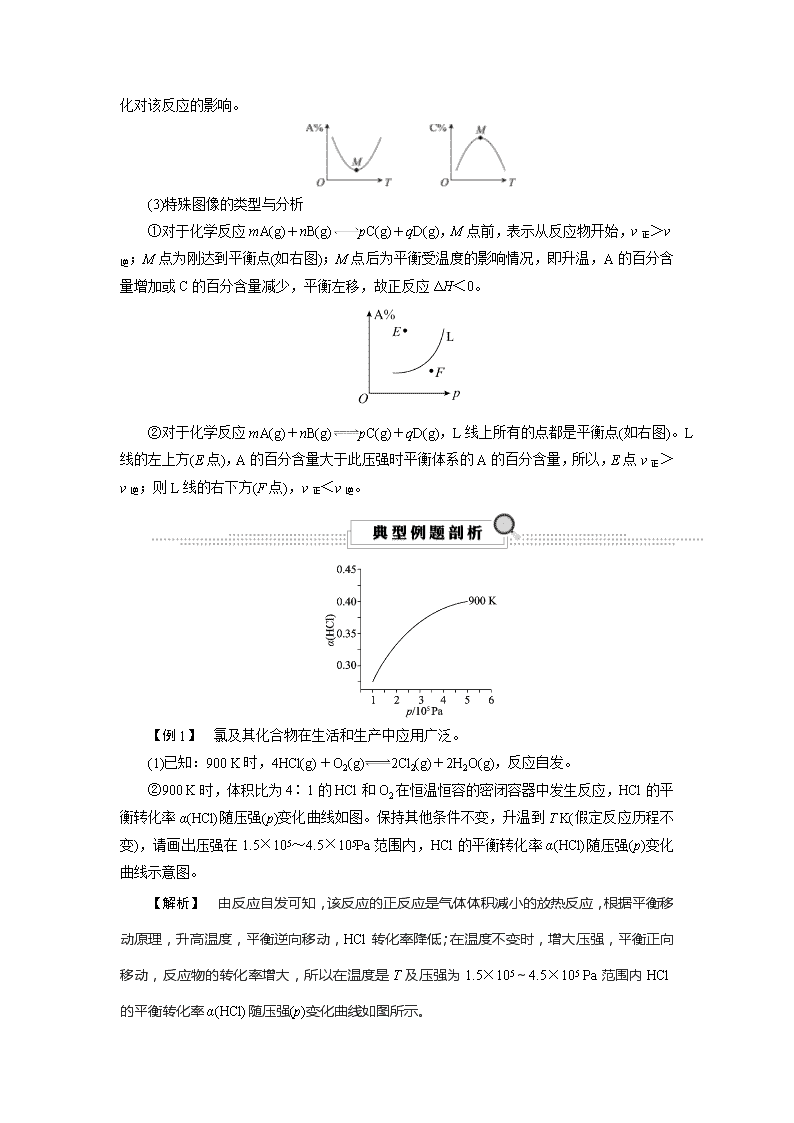
考点41 化学反应速率与平衡图像分析 知识条目 必考要求 加试要求 1.图像分析与运用 b c 2.复合图像的分析与运用 c 1.解化学平衡图像题三步曲 (1)看懂图像:看图像要五看。 一看面,即看清横坐标和纵坐标,弄清纵、横坐标所代表的意义,并与有关原理相结合; 二看线,即看线的走向、变化趋势;看清曲线的变化趋势,注意渐变和突变,分清正、逆反应,从而判断反应特点; 三看点,即看曲线的起点、终点、交点、拐点、原点、极值点等。分清反应物、生成物,浓度减小的是反应物,浓度增大的是生成物,一般生成物多数以原点为起点; 四看要不要作辅助线,如等温线、等压线; 五看定量图像中有关量的多少。 (2)联想规律:联想外界条件对化学反应速率和化学平衡的影响规律。 (3)推理判断:结合题中给定的化学反应和图像中的相关信息,根据有关知识规律分析作出判断。 2.解答化学平衡图像问题的技巧 (1)“先拐先平,数值大”:在含量—时间曲线中,先出现拐点的,则先达到化学平衡状态,说明该曲线的温度较高或压强较大或加入了催化剂。 (2)“定一议二”:在含量—温度(或压强)曲线中,图像中有三个变量,先确定一个量不变,再讨论另外两个量的关系(因为化学平衡移动原理只适用于外界“单因素”的改变,导致的平衡移动的分析),即确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后(通常作一条横坐标的垂线),讨论横坐标与曲线的关系。 3.常见图像类型 (1)速率变化图像 反应mA(g)+nB(g)pC(g)+qD(g) ΔH>0, 反应速率—时间(vt)图像中,在平衡后的某时刻t1改变某一条件后,v正与v逆的变化有两种情况: ①v正、v逆同时突变 ②v正、v逆之一渐变 (2)平衡移动图像 反应mA(g)+nB(g)pC(g)+qD(g),m+n>p+q,且ΔH>0 ①速率—时间图像: t1时增大反应物的浓度,正反应速率瞬间增大,然后逐渐减小,而逆反应速率逐渐增大;t2时升高温度,对任何反应,正反应和逆反应速率均增大,吸热反应的正反应速率增大较快;t3时减小压强,容器容积增大,浓度变小,正反应速率和逆反应速率均减小;t4时使用催化剂,正反应速率和逆反应速率均瞬间增大。 ②转化率(或含量)—时间图像: 图甲表示压强对反应物转化率的影响,对于气体反应物化学计量数之和大于气体生成物化学计量数之和的反应,压强越大,反应物的转化率越大;图乙表示温度对反应物转化率的影响,对于吸热反应,温度越高,反应物的转化率越大;图丙表示催化剂对反应物转化率的影响,催化剂只能改变化学反应速率,不能改变反应物的转化率。 ③恒压(温)线: 分析时可沿横轴作一条平行于纵轴的虚线,即为等压线或等温线, 然后分析另一条件变化对该反应的影响。 (3)特殊图像的类型与分析 ①对于化学反应mA(g)+nB(g)pC(g)+qD(g),M点前,表示从反应物开始,v正>v逆;M点为刚达到平衡点(如右图);M点后为平衡受温度的影响情况,即升温,A的百分含量增加或C的百分含量减少,平衡左移,故正反应ΔH<0。 ②对于化学反应mA(g)+nB(g)pC(g)+qD(g),L线上所有的点都是平衡点(如右图)。L线的左上方(E点),A的百分含量大于此压强时平衡体系的A的百分含量,所以,E点v正>v逆;则L线的右下方(F点),v正<v逆。 【例1】 氯及其化合物在生活和生产中应用广泛。 (1)已知:900 K时,4HCl(g)+O2(g)2Cl2(g)+2H2O(g),反应自发。 ②900 K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。 【解析】 由反应自发可知,该反应的正反应是气体体积减小的放热反应,根据平衡移动原理,升高温度,平衡逆向移动,HCl转化率降低;在温度不变时,增大压强,平衡正向移动,反应物的转化率增大,所以在温度是T及压强为1.5×105~4.5×105 Pa范围内HCl的平衡转化率α(HCl)随压强(p)变化曲线如图所示。 【答案】 【例2】 氯化铵、甲醇、氧化铝都是重要化合物。 (1)已知:Ⅰ.NH4Cl(s)NH3(g)+HCl(g) ΔH=+163.9 kJ·mol-1 Ⅱ.HCl(g)+CH3OH(g)CH3Cl(g)+H2O(g) ΔH=-31.9 kJ·mol-1 Ⅲ.NH4Cl(s)+CH3OH(g)NH3(g)+CH3Cl(g)+H2O(g) ②图1是反应Ⅲ使用三种不同催化剂时得到的CH3Cl产率与温度关系的变化图。 已知:催化剂用量、催化剂粒数、n(甲醇)∶n(氯化铵)的值、甲醇进料速度、反应时间等测试条件都相同。 图1中a曲线CH3Cl产率先增大后减小的原是________________________________________________________________________。 请在图2中画出其他条件都相同时,在370 ℃下使用三种不同催化剂至反应平衡时,CH3Cl的产率与时间关系的变化曲线,并用a、b、c标出对应的曲线。 【解析】 随着温度升高,反应速率加快,CH3Cl产率逐渐增大,410 ℃之后,随着温度升高,催化剂活性降低,反应速率减小,因此CH3Cl产率逐渐减小。催化剂只是加快化学反应速率,对化学平衡不影响,故在370 ℃下使用三种不同催化剂至反应平衡时,CH3Cl的产率相同,由图1可知,370 ℃下,三种催化剂的反应速率由大到小的顺序为c>b>a,故图像如答案图所示。 【答案】 温度越高反应速率越快,因此随着温度升高,CH3Cl产率逐渐增大,410 ℃ 之后,随着温度升高,催化剂活性降低,反应速率减小,因此CH3Cl产率逐渐减小 【提炼】 在分析复合型图像时要先判断图像上的点是否达到平衡状态: (1)若已达到平衡状态,则用平衡移动原理来分析图像变化趋势及其形成的原因。如例1中,要画的曲线上的点都已达到平衡状态,只需考虑温度升高,平衡向逆反应方向移动,使得相同压强下HCl的平衡转化率比900 K时低。 (2)若未达到平衡状态,则需从速率角度去分析,考虑浓度(压强变化可视为浓度变化)、温度、催化剂(考虑不同的催化剂的效果不同、催化剂的活性温度)的影响。如例2的图1中,相同条件下,使用不同催化剂对应的CH3Cl的产率c>b>a,从而可以判断出曲线a未达到平衡状态,那曲线形成的原因要从速率影响因素角度考虑,410 ℃以前,温度升高速率增大,CH3Cl产率逐渐增大,410 ℃之后,随着温度升高,催化剂活性降低,反应速率减小,因此CH3Cl产率逐渐减小。查看更多