- 2021-07-08 发布 |
- 37.5 KB |
- 29页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版氯及其重要化合物学案
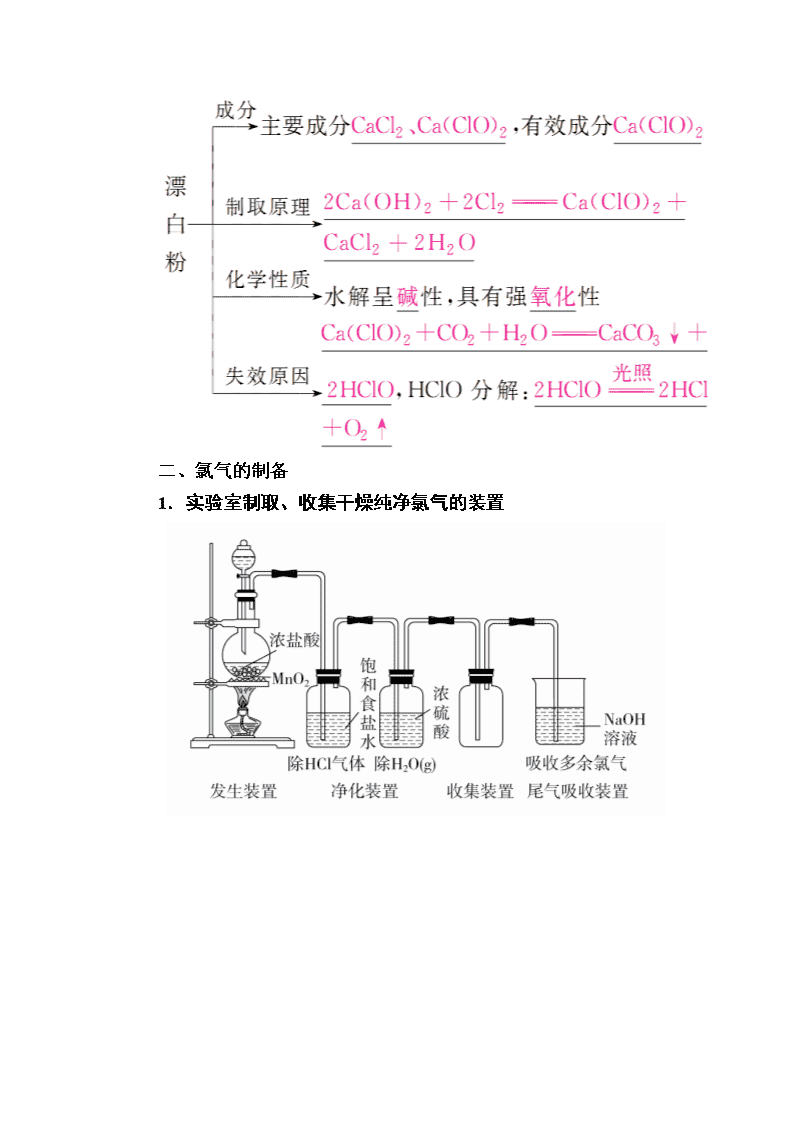
第14讲 氯及其重要化合物 一、氯气及其化合物的性质及应用 1.氯气的物理性质 颜色 状态 气味 密度 溶解性 黄绿 气体 刺激性气味 比空气大 1(水)∶2(Cl2) 2.氯气的化学性质 (1)与金属反应 与变价金属反应生成最高价态金属氯化物。 ①与铁反应:2Fe+3Cl22FeCl3。 ②与铜反应:Cu+Cl2CuCl2。 (2)与非金属反应 与H2反应:H2+Cl22HCl, (3)与水反应 溶于水的氯气部分与水反应,离子方程式为 Cl2+H2O??H++Cl-+HClO。 (4)与碱反应 与NaOH溶液反应,离子方程式为 Cl2+2OH-===Cl-+ClO-+H2O。 (5)与还原性无机化合物反应 ①与碘化钾溶液反应:Cl2+2I-===I2+2Cl-。 ②与SO2水溶液反应:Cl2+SO2+2H2O===2Cl-+SO+4H+。 ③与FeCl2溶液反应:2Fe2++Cl2===2Fe3++2Cl-。 3.次氯酸的性质 (1)不稳定性:2HClO2HCl+O2↑(填化学方程式);氯水须现用现配,保存在棕色瓶中,置于冷暗处。 (2)强氧化性 ①能将有色物质氧化为无色物质,作漂白剂。 ②杀菌、消毒。 (3)弱酸性 NaClO溶液中通入少量CO2,化学方程式为 ClO-+CO2+H2O===HClO+HCO。 4.漂白粉的性质 二、氯气的制备 1.实验室制取、收集干燥纯净氯气的装置 2.氯气的工业制备 (1)电解饱和食盐水(氯碱工业) 化学方程式: 2NaCl+2H2O2NaOH+Cl2↑+H2↑; 离子方程式: 2Cl-+2H2O2OH-+Cl2↑+H2↑。 (2)电解熔融的氯化钠 化学方程式:2NaCl2Na+Cl2↑。 三、卤素的性质、卤素离子的检验 1.卤素单质性质的相似性 (1)都能与大多数金属反应,如2Fe+3Br2===2FeBr3,但I2与Fe反应生成FeI2。 (2)都能与H2反应生成HX:X2+H2===2HX(X代表F、Cl、Br, I2与H2反应可逆)。 (3)都能与水反应:X2+H2O??HX+HIO(F2例外:2F2+2H2O===4HF+O2)。 (4)都能与碱溶液反应:X2+2OH-===H2O+X-+XO-(F2例外)。 2.递变性 3.特殊性 (1)氟 ①无正价,非金属性最强,F-的还原性最弱。 ②2F2+2H2O===4HF+O2,与H2反应在黑暗处即爆炸。 ③氢氟酸是弱酸,能腐蚀玻璃,故应保存在塑料瓶中;有毒。 (2)溴 ①Br2是深红棕色液体,易挥发。 ②Br2易溶于有机溶剂。 ③盛溴的试剂瓶中加水,进行水封,保存液溴不能用橡胶塞。 (3)碘 ①淀粉遇I2变蓝色。 ②I2加热时易升华。 ③I2易溶于有机溶剂。 四、海水中卤素的提取 1.海水中提溴 流程 发生反应的离子方程式 ①2Br-+Cl2===Br2+2Cl-; ②Br2+SO2+2H2O===2Br-+SO+4H+; ③2Br-+Cl2===Br2+2Cl-。 2.海带中提取碘的流程 发生反应的离子方程式:Cl2+2I-===I2+2Cl-。 正误判断,正确的画“√”,错误的画“×”。 (1)氯分子的电子式:。( ) (2)Cl2与H2O或NaOH的反应中氯气既是氧化剂又是还原剂。( ) (3)氯气溶于水的离子方程式为Cl2+H2O===2H++Cl-+ClO-。( ) (4)为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可。( ) (5)漂白粉和明矾都常用于处理自来水,二者的作用原理是不同的。( ) (6)利用硝酸银溶液可以鉴别KCl和KI。( ) (7)可以采用加热的方法分离I2和NaCl的混合物。( ) (8)类比Fe与Cl2的反应判断Fe与I2反应生成FeI3。( ) 答案 (1)√ (2)√ (3)× (4)× (5)√ (6)√ (7)√ (8)× 考点1 氯气的性质 典例1 (江苏高考)在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( ) A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO 解析 Cl2的颜色为黄绿色,正因为氯水中溶解了黄绿色的Cl2,才使得氯水显示了浅黄绿色,A正确。Cl-与Ag+结合生成AgCl白色沉淀,B正确。Cl2与水反应生成HCl和HClO,H+与NaHCO3反应生成CO2气体,C正确。氯水中的Cl2也能将Fe2+氧化为Fe3+,D错误。 答案 D 名师精讲 1.氯水的成分及性质模型 氯水性质的多重性:新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。 2.氯水的组成及应用中需注意的问题 (1)氯水中因HClO见光分解,随着HClO的消耗,最后成为盐酸,故久置氯水酸性增强,无漂白性。因此,氯水要现用现配。 (2)制取氯水的反应为Cl2+H2O??HCl+HClO,反应中Cl2既是氧化剂,又是还原剂,且向水中通入1 mol Cl2,转移电子数小于NA。 (3)Cl2尽管有较强氧化性,但没有漂白性,湿润Cl2具有漂白性是因为Cl2与水反应生成了强氧化性的HClO。 (4)ClO-与Fe2+、I-、S2-、HS-、SO等在水中因发生氧化还原反应不能大量共存。 3.Cl2+H2O??HCl+HClO平衡移动的应用 1.下列说法正确的是( ) ①Cl2的性质活泼,它与H2混合后立即发生爆炸 ②实验室制取Cl2时,为了防止环境污染,多余的Cl2可以用Ca(OH)2溶液吸收 ③新制氯水的氧化性强于久置氯水的 ④检验HCl气体中是否混有Cl2,方法是将气体通入AgNO3溶液中 ⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水中 A.①②③ B.②③④ C.③ D.③⑤ 答案 C 解析 Cl2与H2混合,达到爆炸极限,在点燃或光照的条件下能发生爆炸,①错误;Ca(OH)2溶液中溶质含量少,实验中常用NaOH溶液吸收多余的氯气,②错误;排除A、B项;HCl气体与AgNO3溶液反应可产生沉淀,④错误;将气体通入饱和食盐水中,除去的是HCl气体,而不是Cl2,⑤错误,排除D项。 考点2 氯气的制备 典例2 如图是实验室制备氯气并进行一系列相关实验的装置(加热及夹持装置已略)。 (1)制备氯气选用的药品为固体二氧化锰和浓盐酸,相应的化学方程式为______________________。 (2)装置B中饱和食盐水的作用是________________________。 同时装置B亦是安全瓶,当C中发生堵塞时,B中的现象为______________________。 (3)装置C的实验目的是验证氯气是否具有漂白性,因此C中Ⅰ、Ⅱ、Ⅲ依次放入的物质为________(填字母)。 (4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓慢通入一定量的氯气时,可以看到无色溶液逐渐变为________色,说明氯的非金属性大于溴的。 (5)打开活塞,将装置D中少量溶液滴入装置E中,振荡。观察到的现象是________。 (6)装置F中用足量的Na2SO3溶液吸收多余的氯气,试写出相应的离子反应方程式:____________________。 解析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水。 (2)饱和食盐水可吸收HCl,装置B中饱和食盐水的作用是除去Cl2中的HCl;若装置C堵塞,B中压强增大,长颈漏斗中液面会上升,形成水柱。 (3)装置C的实验目的是验证氯气是否具有漂白性,氯气和水反应生成的次氯酸具有漂白性,则可通过将Cl2依次通入湿润的有色布条、干燥剂、干燥的有色布条来验证氯气的漂白性。Ⅱ中应放固体干燥剂,所以选d。 (4)当向D中缓慢通入少量氯气时,Cl2+2NaBr===Br2+2NaCl,所以可以看到无色溶液逐渐变为橙红色。 (5)打开活塞,将装置D中含溴单质的少量溶液加入含碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡后观察到的现象:E中溶液分为两层,上层(苯层)为紫红色。 (6)Cl2具有氧化性,可将SO氧化为SO。 答案 (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2)除去Cl2中的HCl B中长颈漏斗中液面上升,形成水柱 (3)d (4)橙红 (5)E中溶液分为两层,上层(苯层)为紫红色 (6)SO+Cl2+H2O===SO+2Cl-+2H+ 名师精讲 氯气制取过程中的四注意 (1)反应物的选择:必须用浓盐酸,稀盐酸与MnO2不反应,且随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的HCl不可能全部参加反应。 (2)加热温度:不宜过高,以减少HCl挥发。 (3)实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置,避免污染空气。 (4)尾气吸收:Cl2有毒,必须有尾气吸收装置,常用吸收剂为NaOH溶液或碱石灰,不用澄清石灰水,因澄清石灰水中Ca(OH)2浓度小,吸收慢且吸收不完全。 2.已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并使它与金属反应。每个虚线框表示一个单元装置,其中错误的是( ) A.①和② B.② C.②和③ D.②③④ 答案 D 解析 NaOH与氯气反应,不能用氢氧化钠溶液除去氯气中的氯化氢杂质,②错误;③中的进气管短,出气管浸入液面下,错误;④不应为密闭装置,错误。 考点3 氯的重要化合物 典例3 (2015·北京高考)某消毒液的主要成分为NaClO,还含有一定量的NaOH。下列用来解释事实的方程式中,不合理的是(已知:饱和NaClO溶液的pH约为11)( ) A.该消毒液可用NaOH溶液吸收Cl2制备: Cl2+2OH-===ClO-+Cl-+H2O B.该消毒液的pH约为12:ClO-+H2O??HClO+OH- C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-===Cl2↑+H2O D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-===HClO+CH3COO- 解析 A项,将Cl2通入NaOH溶液中可制得消毒液,离子方程式为2OH-+Cl2===Cl-+ClO-+H2O。B项,饱和NaClO溶液的 pH约为11,现在该消毒液的pH为12,故不可能仅为ClO-的水解所致,该消毒液中还含有一定量的NaOH,是使消毒液的pH约为12的主要原因。C项,该消毒液与洁厕灵混用时,ClO-与Cl-会发生氧化还原反应生成Cl2。D项,HClO有较强的漂白性。因为CH3COOH的酸性强于HClO,在该消毒液中加入CH3COOH,会使CH3COOH与ClO-反应生成HClO,增强其漂白性。 答案 B 名师精讲 1.次氯酸盐的强氧化性 ClO-不论是在酸性、碱性条件下都能跟亚铁盐、碘化物、硫化物、亚硫酸盐等发生氧化还原反应,即ClO-与I-、Fe2+、S2-、SO不论是在酸性环境还是在碱性环境中均不能大量共存。如漂白粉遇到亚硫酸盐:Ca2++ClO-+SO===CaSO4↓+Cl-。 2.氯的化合物的特性 (1)HClO不稳定,不能单独存在,只存在于氯水、次氯酸盐溶液或次氯酸盐与酸反应的混合物中。 (2)不能用pH试纸测量氯水的pH,原因是氯水中的HClO具有漂白性。 (3)工业上制取漂白粉是用氯气与石灰乳反应制得,而不是用氯气与石灰水反应。 (4)“84”消毒液的主要成分为NaClO,漂粉精的有效成分为Ca(ClO)2。“84”消毒液和洁厕灵不能混合使用,其原因是ClO-+Cl-+2H+===Cl2↑+H2O。 3.在淀粉KI溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是( ) A.氧化性:ClO->I2>SO B.漂白粉溶液可使淀粉KI试纸变蓝 C.次氯酸钠可以与亚硫酸钠大量共存 D.向氯水中加入亚硫酸钠溶液,氯水褪色 答案 C 解析 在酸性条件下发生反应:ClO-+2H++2I-===Cl-+I2+H2O,I2遇淀粉溶液变为蓝色,证明氧化性ClO->I2;在溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失,是因为又发生了反应:I2+H2O+SO===2I-+2H++SO,证明氧化性I2>SO,所以微粒的氧化性:ClO->I2>SO,A正确。漂白粉的有效成分是Ca(ClO)2,电离产生ClO-,由于氧化性ClO->I2,所以漂白粉溶液可使淀粉KI试纸变蓝,B正确。由于氧化性:ClO->SO,所以当次氯酸钠与亚硫酸钠混合时,会发生反应:ClO-+SO===Cl-+SO,因此二者不能大量共存,C错误。在氯水中会发生反应产生次氯酸,Cl2+H2O??HCl+HClO,由于氧化性ClO->SO,所以向氯水中加入亚硫酸钠溶液,会发生反应:HClO+SO===H++Cl-+SO,使ClO-浓度减小,氯气的溶解平衡正向移动,氯气的浓度减小,故氯水会逐渐褪色,D正确。 考点4 卤素的性质和卤离子的检验 典例4 为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。 实验过程: Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。 Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。 Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。 Ⅳ.…… (1)A中产生黄绿色气体,其电子式是________。 (2)验证氯气的氧化性强于碘的实验现象是________________________________________。 (3)B中溶液发生反应的离子方程式是_______________________ _________________________________________________________。 (4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 _________________________________________________________________________________________________________________________________________________________________________________。 (5)过程Ⅲ实验的目的是__________________。 (6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下________,得电子能力逐渐减弱。 解析 (1)A中产生的黄绿色气体为Cl2,其电子式为。 (2)氯气遇湿润的淀粉KI试纸时,发生反应:Cl2+2KI===I2+2KCl,产生的I2遇淀粉变蓝,可以证明氯气的氧化性强于碘。 (3)B中Cl2与NaBr发生置换反应,离子方程式为Cl2+2Br-===2Cl-+Br2。 (4)C中NaBr与氯气反应生成NaCl和Br2,将C中溶液滴入D中,振荡,发生反应:Br2+2KI===I2+2KBr,静置后D中溶液分层,下层为碘的四氯化碳溶液,显紫红色,可以说明溴的氧化性强于碘。 (5)过程Ⅲ主要是为了确认C的黄色溶液中无Cl2,排除对溴置换碘实验的干扰。 (6)氯、溴、碘单质的氧化性逐渐减弱,是因为从Cl到I,原子半径逐渐增大,得电子能力逐渐减弱。 答案 (1) (2)淀粉KI试纸变蓝 (3)Cl2+2Br-===Br2+2Cl- (4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡;静置后CCl4层变为紫红色 (5)确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰 (6)原子半径逐渐增大 名师精讲 1.卤素单质及其化合物的特性 (1)Br2是常温下唯一呈液态的非金属单质;液溴易挥发且有毒,通常用水液封来保存。 (2)I2易升华,I2使淀粉变蓝。 (3)Br2和I2都可被某些有机溶剂(如四氯化碳、汽油、苯)萃取。 (4)氟元素无正价,F2与H2O发生置换反应生成O2(2F2+2H2O===4HF+O2),F2与Xe、Kr等稀有气体可反应生成氟化物。 (5)氢氟酸是氢卤酸(HX)中唯一的弱酸,且是与SiO2反应的唯一酸,能腐蚀玻璃,应保存在铅制器皿或塑料瓶中。 (6)HX的酸性:HF查看更多