- 2021-07-05 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习新课改省份专版8-6应用层面“物质结构与性质”综合题型分析学案
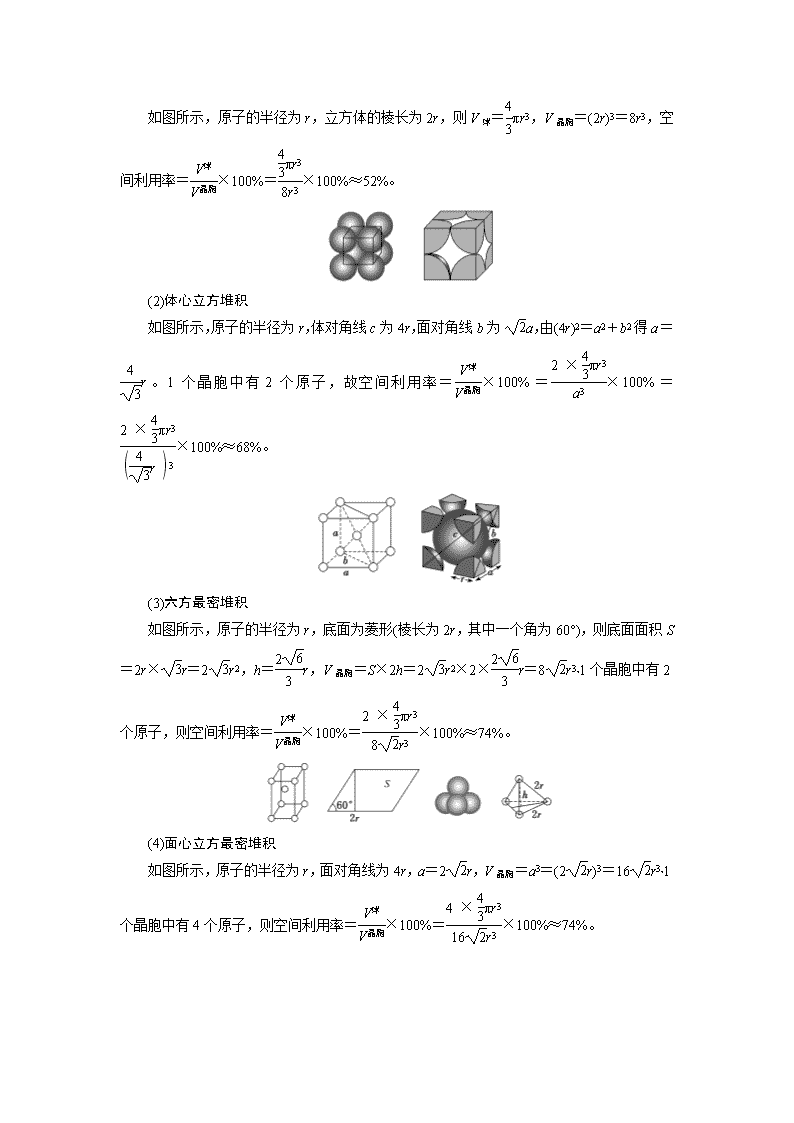
第6课时 应用层面——“物质结构与性质”综合题型分析 [题型分析] 物质结构与性质综合大题是高考命题的重要题型之一,试题把原子、分子结构与性质、晶体结构与性质等知识拼盘成一个大题,设置若干个问题,每个问题又相对独立。题目主要考查电子排布式、电负性和第一电离能大小比较、共价键分类及数目判断、杂化轨道类型、分子的空间构型、等电子体、分子极性的判断、晶体类型的判断及熔、沸点高低的比较等。难点是根据晶胞结构推断物质的化学式、晶体的密度、原子半径和空间利用率的计算等。 题目的考查方式灵活,一般有两种命题方式:一是题目给出物质或元素,直接回答题设问题;二是给出一定原子结构与性质的信息来推出元素,再结合推出的元素回答相关问题。 [难点点拨] 晶胞参数的计算方法 1.晶胞参数 (1)晶胞的形状和大小可以用6个参数来表示,包括晶胞的3组棱长a、b、c和3组棱相互间的夹角α、β、γ,此即晶格特征参数,简称晶胞参数。如立方晶胞中,晶胞参数a=b=c,α=β=γ=90°。 (2)晶胞参数的计算 2.晶体密度的计算方法 3.金属晶体空间利用率的计算方法 空间利用率=×100%,球体积为金属原子的总体积。 (1)简单立方堆积 如图所示,原子的半径为r,立方体的棱长为2r,则V球=πr3,V晶胞=(2r)3=8r3,空间利用率=×100%=×100%≈52%。 (2)体心立方堆积 如图所示,原子的半径为r,体对角线c为4r,面对角线b为a,由(4r)2=a2+b2得a=r。1个晶胞中有2个原子,故空间利用率=×100%=×100%=×100%≈68%。 (3)六方最密堆积 如图所示,原子的半径为r,底面为菱形(棱长为2r,其中一个角为60°),则底面面积S=2r×r=2r2,h=r,V晶胞=S×2h=2r2×2×r=8r3,1个晶胞中有2个原子,则空间利用率=×100%=×100%≈74%。 (4)面心立方最密堆积 如图所示,原子的半径为r,面对角线为4r,a=2r,V晶胞=a3=(2r)3=16r3,1个晶胞中有4个原子,则空间利用率=×100%=×100%≈74%。 [典例剖析] [典例] (2018·全国卷Ⅰ)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题: (1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)。 (2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是_____________________。 (3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是________、中心原子的杂化形式为________。LiAlH4中,存在________(填标号)。 A.离子键 B.σ键 C.π键 D.氢键 (4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。 可知,Li原子的第一电离能为________kJ·mol-1,O===O键键能为______kJ·mol-1,Li2O晶格能为______kJ·mol-1。 (5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O的密度为____________g·cm-3(列出计算式)。 [解析] (1)D选项表示基态,为能量最低状态;A、B、C选项均表示激发态,但C 选项被激发的电子处于高能级的电子数多,为能量最高状态。 (2)Li+与H-具有相同的电子构型,Li的核电荷数大于H的核电荷数,因此Li的原子核对电子的吸引能力强,即Li+半径小于H-半径。 (3)LiAlH4的阴离子为AlH,AlH中Al的杂化轨道数为=4,Al采取sp3杂化,为正四面体构型。LiAlH4是离子化合物,存在离子键,H和Al间形成的是共价单键,为σ键。 (4)由题给信息可知,2 mol Li(g)变为2 mol Li+(g)吸收1 040 kJ热量,因此Li原子的第一电离能为520 kJ·mol-1;0.5 mol氧气生成1 mol氧原子吸收249 kJ热量,因此O===O键的键能为498 kJ·mol-1;Li2O的晶格能为2 908 kJ·mol-1。 (5)由题给图示可知,Li位于晶胞内部,O位于顶点和面心,因此一个晶胞有8个Li,O原子个数=6×+8×=4。因此一个Li2O晶胞的质量= g,一个晶胞的体积为(0.466 5×10-7)3 cm3,即该晶体密度= g·cm-3。 [答案] (1)D C (2)Li+核电荷数较大 (3)正四面体 sp3 AB (4)520 498 2 908 (5) [对点练1] 2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅22岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。 (1)图甲中,1号C与相邻C形成σ键的个数为________。 (2)图乙中,1号C的杂化方式是__________,该C与相邻C形成的键角________(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。 (3)我国制墨工艺是将50 nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是___________________________________________ ________________________________________________________________________。 (4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为________,该材料的化学式为________。 (5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为________。 (6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如图丁所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。 ①“可燃冰”中分子间存在的2种作用力是______________________________ ________________________________________________________________________。 ②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知图丁中笼状结构的空腔直径为0.586 nm,结合图表从物质结构及性质的角度分析,该设想的依据是:________________________________________________________________________ ________________________________________________________________________。 参数 分子 分子直径/nm 分子与H2O的结合能 E/(kJ·mol-1) CH4 0.436 16.40 CO2 0.512 29.91 解析:(1)题图甲中,1号C与相邻3个碳原子成键,σ键的个数为3。(2)题图乙中,1号C与3个C、1个—OH成键,无孤电子对,杂化轨道数为4,杂化方式为sp3。题图乙中1号C与相邻C形成的键角约为109°28′,而题图甲中1号C为sp2杂化,1号C与相邻C形成的键角为120°,故题图乙中1号C与相邻C形成的键角<题图甲中1号C与相邻C形成的键角。(3)氧化石墨烯中含有羟基、羧基,能与水形成氢键,因此氧化石墨烯溶于水得到的分散系更稳定。(4)该晶胞中,12个M在晶胞的棱心,9个M在晶胞内部,M的个数为12×+9=12,而6个C60在晶胞面心,8个C60在晶胞的顶点,C60的个数为6×+8×=4,M和C60的个数比为12∶4=3∶1,故该材料的化学式为M3C60。(5)金刚石的晶胞结构中碳原子位于立方体的顶点(8个)、面心(6个)及内部(4个),将立方体切割成8个小立方体,在其中4个互不相邻的小立方体体心各有1个碳原子。根据硬球接触模型,立方体体对角线长度的就是C—C键的键长,晶胞立方体体对角线长度为a,所以×a=2r,所以r=a 。碳原子数为8×+6×+4=8,晶胞的体积为a3,碳原子的体积为8×πr3,空间占有率为×100%=×100%=34%。(6)①可燃冰为甲烷的水合物,甲烷和甲烷间、甲烷和水分子间为范德华力,水分子间为氢键。②根据题表中提供的数据可知,CO2的分子直径小于笼状结构的空腔直径,且CO2与H2O的结合能大于CH4与H2O的结合能,因此科学家提出用CO2置换CH4的设想。 答案:(1)3 (2)sp3 < (3)氧化石墨烯可与水形成氢键,更稳定 (4)12 M3C60 (5)×100%(或34%) (6)①氢键、范德华力 ②CO2的分子直径小于笼状结构的空腔直径,且CO2与水的结合能大于CH4与水的结合能 [对点练2] 元素X、Y、Z为前四周期元素,X的基态原子核外电子有21种运动状态,元素Y的原子最外层电子数是其内层的3倍,Z与X、Y不在同一周期,且Z原子核外p电子比s电子多5个。 (1)X基态原子的核外电子排布式为________________。 (2)X是石油化工中重要的催化剂之一,如催化异丙苯()裂化生成苯和丙烯。 ①1 mol苯分子中含有σ键的数目为________mol。 ②异丙苯分子中碳原子轨道的杂化类型为________。 (3)与Y3分子互为等电子体的阳离子为________。 (4)XZ3易溶于水,熔点为960 ℃,熔融状态下能够导电,据此可判断XZ3晶体属于________(填晶体类型)。 (5)元素Ce与X同族,其与Y形成的化合物晶体的晶胞结构如图所示,该化合物的化学式为________________。 解析:(1)X核外有21个电子,X为Sc元素,故X的核外电子排布式为1s22s22p63s23p63d14s2或[Ar]3d14s2。(2)①苯分子中,C—H键为σ键,苯环上的C—C键也为σ键,故含有12 mol σ键。②异丙苯分子中苯环上的碳原子采取sp2杂化,其余C原子采用sp3杂化。(3)最外层电子数是内层电子数3倍的元素是O元素,在O3分子中,含有3个原子、18个价电子,与其互为等电子体的阳离子是ClO。 (4)根据晶体在熔融状态下能导电可知其为离子晶体。(5)根据晶胞的结构,O原子全部在体内,故含有8个O原子,Ce原子位于顶点和面心,含有Ce原子的个数=8×+6×=4,故化学式为CeO2。 答案:(1)[Ar]3d14s2 (2)①12 ②sp2、sp3 (3)ClO (4)离子晶体 (5)CeO2查看更多