- 2021-07-05 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习化学反应中的热效应学案
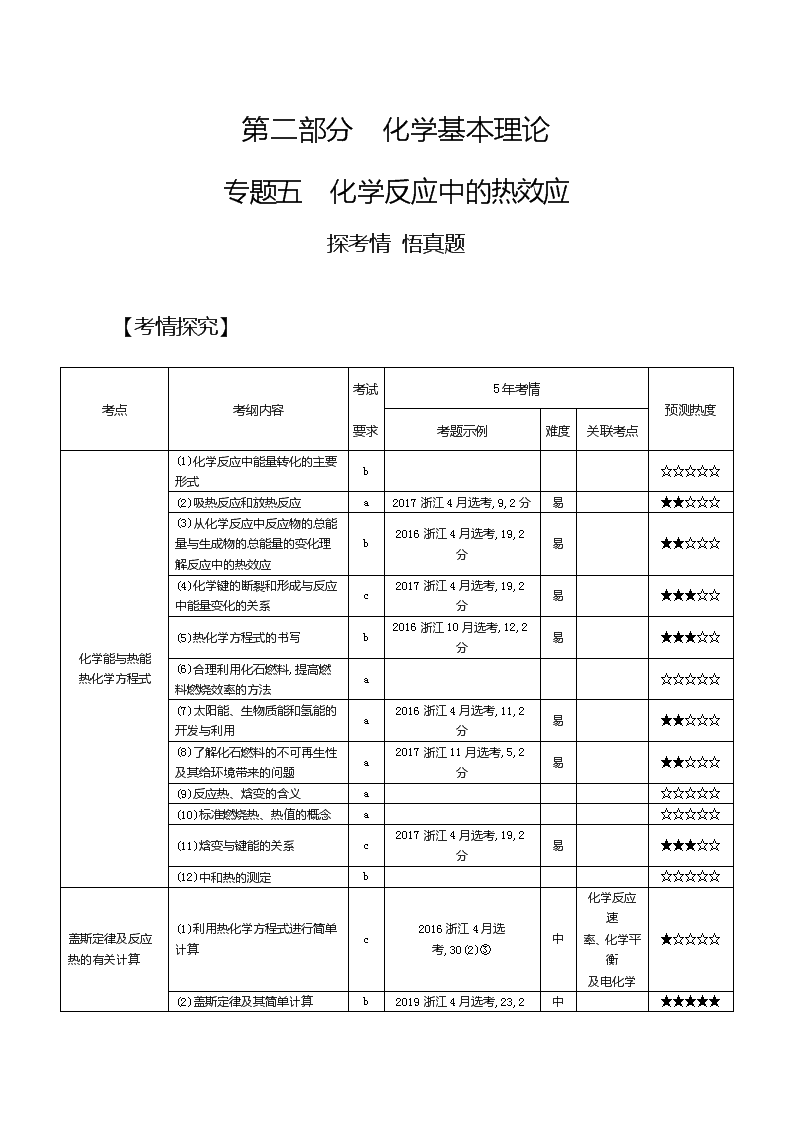
第二部分 化学基本理论 专题五 化学反应中的热效应 探考情 悟真题 【考情探究】 考点 考纲内容 考试 要求 5年考情 预测热度 考题示例 难度 关联考点 化学能与热能 热化学方程式 (1)化学反应中能量转化的主要形式 b ☆☆☆☆☆ (2)吸热反应和放热反应 a 2017浙江4月选考,9,2分 易 ★★☆☆☆ (3)从化学反应中反应物的总能量与生成物的总能量的变化理解反应中的热效应 b 2016浙江4月选考,19,2分 易 ★★☆☆☆ (4)化学键的断裂和形成与反应中能量变化的关系 c 2017浙江4月选考,19,2分 易 ★★★☆☆ (5)热化学方程式的书写 b 2016浙江10月选考,12,2分 易 ★★★☆☆ (6)合理利用化石燃料,提高燃料燃烧效率的方法 a ☆☆☆☆☆ (7)太阳能、生物质能和氢能的开发与利用 a 2016浙江4月选考,11,2分 易 ★★☆☆☆ (8)了解化石燃料的不可再生性及其给环境带来的问题 a 2017浙江11月选考,5,2分 易 ★★☆☆☆ (9)反应热、焓变的含义 a ☆☆☆☆☆ (10)标准燃烧热、热值的概念 a ☆☆☆☆☆ (11)焓变与键能的关系 c 2017浙江4月选考,19,2分 易 ★★★☆☆ (12)中和热的测定 b ☆☆☆☆☆ 盖斯定律及反应热的有关计算 (1)利用热化学方程式进行简单计算 c 2016浙江4月选考,30(2)③ 中 化学反应速 率、化学平衡 及电化学 ★☆☆☆☆ (2)盖斯定律及其简单计算 b 2019浙江4月选考,23,2分 中 ★★★★★ 分析解读 分析已有的选考试题可以发现,本专题选择题主要考点集中在以下几个方面:①能量的转化及应用,主要涉及能量变化的本质,以图像的形式表示能量变化过程;②热化学方程式的书写及含义,主要根据题给信息正确书写热化学方程式或根据热化学方程式进行相关判断;③ 化石燃料、太阳能、生物质能和氢能的基础知识,主要涉及合理利用化石燃料及新能源的开发和利用;④盖斯定律及其有关计算,主要根据题给能量关系图,运用盖斯定律寻找相关过程的ΔH间的相互关系进行相关计算或做出正误判断。填空题常与化学反应速率、化学平衡及电化学进行联合考查,重点考查反应热和键能的关系、盖斯定律及其有关计算。随着能源问题的日益突出,对本专题的考查仍将维持较高的热度。 【真题探秘】 破考点 练考向 【考点集训】 考点一 化学能与热能 热化学方程式 1.(2020届浙江名校协作体期始,16)下列有关化学反应与能量变化的说法正确的是( ) A.如图所示的化学反应中,反应物的键能之和大于生成物的键能之和 B.相同条件下,氢气和氧气反应生成液态水比生成等质量的气态水放出的热量少 C.金刚石在一定条件下转化成石墨能量变化如图所示,则热反应方程式可表示为:C(s,金刚石) C(s,石墨) ΔH=-(E2-E3)kJ·mol-1 D.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件下的ΔH相同 答案 D 2.(2019杭州学军中学选考模拟,19)工业生产水煤气的反应为C(s)+H2O(g) CO(g)+H2(g) ΔH=131.4 kJ/mol。下列判断正确的是( ) A.反应物的总能量大于生成物的总能量 B.CO(g)+H2(g) C(s)+H2O(l) ΔH=-131.4 kJ/mol C.水煤气反应中生成1 mol H2(g)吸收131.4 kJ热量 D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 答案 C 3.(2016浙江10月选考,19,2分)根据能量变化示意图,下列热化学方程式正确的是( ) A.N2(g)+3H2(g) 2NH3(g) ΔH=-(b-a)kJ·mol-1 B.N2(g)+3H2(g) 2NH3(g) ΔH=-(a-b)kJ·mol-1 C.2NH3(l) N2(g)+3H2(g) ΔH=2(a+b-c)kJ·mol-1 D.2NH3(l) N2(g)+3H2(g) ΔH=2(b+c-a)kJ·mol-1 答案 D 考点二 盖斯定律及反应热的有关计算 4.(2019浙江南名校联盟期末联考,13)NH4X(X为卤素原子)的能量关系如下图所示: 下列说法正确的是( ) A.ΔH1<ΔH5 B.ΔH6=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5 C.已知NH4Cl溶于水吸热,则ΔH6>0 D.相同条件下,NH4Cl的(ΔH2+ΔH3+ΔH5)比NH4Br的大 答案 D 5.(2019浙江三地市联考,21)氢气和氧气反应生成水的能量关系如图所示: 2H(g) + O(g) H2O(g) H2(g)+12O2(g) H2O(l) 下列说法正确的是( ) A.ΔH5<0 B.ΔH1>ΔH2+ΔH3+ΔH4 C.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0 D.O—H键的键能为|ΔH1| 答案 B 6.(2018浙江4月选考,21,2分)氢卤酸的能量关系如图所示: 下列说法正确的是( ) A.已知HF气体溶于水放热,则HF的ΔH1<0 B.相同条件下,HCl的ΔH2比HBr的小 C.相同条件下,HCl的(ΔH3+ΔH4)比HI的大 D.一定条件下,气态原子生成1 mol H—X键放出a kJ能量,则该条件下ΔH2=a kJ·mol-1 答案 D 7.(2020届宁波效实中学复习检测,23)(1)甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下: Ⅰ.CO(g)+2H2(g) CH3OH(g) ΔH1 Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1 Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH3 已知:化学反应热ΔH=生成物标准生成热总和-反应物标准生成热总和,四种物质的标准生成热如下表: 物质 CO(g) CO2(g) H2(g) CH3OH(g) 标准生成热 (kJ·mol-1) -110.52 -393.51 0 -201.25 请回答下列问题: ①计算ΔH1= kJ·mol-1。 ②ΔH3 0(填“=”“>”或“<”)。 (2)某课题组实现了在常温常压下,以氮气和液态水为原料制备氨气,同时有氧气生成。 已知:在一定温度和压强下,由最稳定的单质生成1 mol纯物质的热效应,称为该物质的生成热(ΔHfθ)。常温常压下,相关物质的生成热如表所示: 物质 NH3(g) H2O(l) ΔHfθ/(kJ·mol-1) -46 -286 上述合成氨反应的热化学方程式为 。 答案 (1)-90.73 > (2)2N2(g)+6H2O(l) 3O2(g)+4NH3(g) ΔH=+1 532 kJ·mol-1 【方法集训】 方法 反应热的计算方法 1.(2020届杭州学军中学检测,14)利用CO2可以制取甲醇,有关化学反应如下: ①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-178 kJ·mol-1 ②2CO(g)+O2(g) 2CO2(g) ΔH2=-566 kJ·mol-1 ③2H2(g)+O2(g) 2H2O(g) ΔH3=-483.6 kJ·mol-1 已知反应①中相关的化学键键能数据如下: 化学键 C—H H—H C—O H—O 键能/(kJ·mol-1) 413 436 358 463 则断开1 mol CO需要的能量和CO(g)+2H2(g) CH3OH(g)的ΔH分别为( ) A.吸收750 kJ·mol-1 +219.2 kJ·mol-1 B.放出750 kJ·mol-1 -143.2 kJ·mol-1 C.吸收1 500 kJ·mol-1 -438.4 kJ·mol-1 D.吸收750 kJ·mol-1 -219.2 kJ·mol-1 答案 D 2.(2019嘉兴一中单元测试,10)亚磷酸(H3PO3,二元中强酸)及其盐在工农业生产中有着重要作用。在稀溶液中: ①H3PO3(aq) H2PO3-(aq)+H+(aq) ΔH=a kJ·mol-1 ②H2PO3-(aq) HPO32-(aq)+H+(aq) ΔH=b kJ·mol-1 ③H+(aq)+OH-(aq) H2O(l) ΔH=c kJ·mol-1 则H3PO3(aq)+2NaOH(aq) Na2HPO3(aq)+2H2O(l)的反应热为( ) A.(a+2b-c)kJ·mol- 1 B.(a+b+2c)kJ·mol-1 C.(a-2b-c)kJ·mol-1 D.(a+b-2c)kJ·mol-1 答案 B 3.(1)(2018北京理综,27节选)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下: 反应Ⅰ:2H2SO4(l)2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1 反应Ⅲ:S(s)+O2(g)SO2(g) ΔH3=-297 kJ·mol-1 反应Ⅱ的热化学方程式: 。 (2)(2016四川理综,11节选)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25 ℃,101 kPa时: CaO(s)+H2SO4(l) CaSO4(s)+H2O(l) ΔH=-271 kJ/mol 5CaO(s)+3H3PO4(l)+HF(g) Ca5(PO4)3F(s)+5H2O(l) ΔH=-937 kJ/mol 则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是 。 (3)(2016课标Ⅲ,27节选)已知下列反应: SO2(g)+2OH-(aq) SO32-(aq)+H2O(l) ΔH1 ClO-(aq)+SO32-(aq) SO42-(aq)+Cl-(aq) ΔH2 CaSO4(s) Ca2+(aq)+SO42-(aq) ΔH3 则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq) CaSO4(s)+H2O(l)+Cl-(aq)的ΔH= 。 答案 (1)3SO2 (g)+2H2O(g) 2H2SO4(l) +S(s) ΔH2=-254 kJ·mol-1 (2)Ca5(PO4)3F(s)+5H2SO4(l) 5CaSO4(s)+3H3PO4(l)+HF(g) ΔH=-418 kJ/mol (3)ΔH1+ΔH2-ΔH3 【五年高考】 A组 自主命题·浙江卷题组 考点一 化学能与热能 热化学方程式 1.(2017浙江11月选考,5,2分)下列不属于化石燃料的是( ) A.煤 B.石油 C.天然气 D.甲醇 答案 D 2.(2017浙江4月选考,9,2分)下列物质放入水中,会显著放热的是( ) A.食盐 B.蔗糖 C.酒精 D.生石灰 答案 D 3.(2017浙江4月选考,19,2分)已知断裂1 mol H2(g)中的H—H键需要吸收436.4 kJ的能量,断裂1 mol O2(g)中的共价键需要吸收498 kJ的能量,生成H2O(g)中的1 mol H—O键能放出462.8 kJ的能量。下列说法正确的是( ) A.断裂1 mol H2O中的化学键需要吸收925.6 kJ的能量 B.2H2(g)+O2(g) 2H2O(g) ΔH=-480.4 kJ·mol-1 C.2H2O(l) 2H2(g)+O2(g) ΔH=471.6 kJ·mol-1 D.H2(g)+12O2(g) H2O(l) ΔH=-240.2 kJ·mol-1 答案 B 4.(2016浙江4月选考,11,2分)下列说法正确的是( ) A.煤是无机化合物,天然气和石油是有机化合物 B.利用化石燃料燃烧放出的热量使水分解产生氢气,是氢能开发的研究方向 C.化学电源放电、植物光合作用都发生化学变化,并伴随能量的转化 D.若反应过程中断开化学键放出的能量大于形成化学键所吸收的能量,则反应放热 答案 C 5.(2016浙江4月选考,19,2分)2A(g) B(g) ΔH1(ΔH1<0);2A(g) B(l) ΔH2。下列能量变化示意图正确的是( ) 答案 B 6.(2015浙江10月选考,5,2分)下列物质中,属于可再生的能源是( ) A.氢气 B.石油 C.煤 D.天然气 答案 A 7.(2015浙江10月选考,12,2分)已知1 mol CH4气体完全燃烧生成气态CO2和液态H2O,放出890.3 kJ热量,则表示该反应的热化学方程式正确的是( ) A.CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH=+890.3 kJ·mol-1 B.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1 C.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1 D.CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 答案 B 考点二 盖斯定律及反应热的有关计算 8.(2018浙江11月选考,21,2分)已知: H2O(g) H2O(l) ΔH1 C6H12O6(g) C6H12O6(s) ΔH2 C6H12O6(s)+6O2(g) 6H2O(g)+6CO2(g) ΔH3 C6H12O6(g)+6O2(g) 6H2O(l)+6CO2(g) ΔH4 下列说法正确的是( ) A.ΔH1<0,ΔH2<0,ΔH3<ΔH 4B.6ΔH1+ΔH2+ΔH3-ΔH4=0 C.-6ΔH1+ΔH2+ΔH3-ΔH4=0 D.-6ΔH1+ΔH2-ΔH3+ΔH4=0 答案 B 9.(2017浙江11月选考,19,2分)根据Ca(OH)2/CaO体系的能量循环图: 下列说法正确的是( ) A.ΔH5>0 B.ΔH1+ΔH2=0 C.ΔH3=ΔH4+ΔH5 D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0 答案 D B组 统一命题、省(区、市)卷题组 考点一 化学能与热能 热化学方程式 1.(2019北京理综,7,6分)下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)( ) A B C D NaCl溶于水 电解CuCl2溶液 CH3COOH在 水中电离 H2与Cl2反应 能量变化 NaCl Na++Cl- CuCl2 Cu2++2Cl- CH3COOH CH3COO-+H+ H2(g)+Cl2(g) 2HCl(g) ΔH=-183 kJ·mol-1 答案 B 2.(2018北京理综,7,6分)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。 下列说法不正确的是( ) A.生成CH3COOH总反应的原子利用率为100% B.CH4→CH3COOH过程中,有C—H键发生断裂 C.①→②放出能量并形成了C—C键 D.该催化剂可有效提高反应物的平衡转化率 答案 D 3.(2016江苏单科,8,2分)通过以下反应均可获取H2。下列有关说法正确的是( ) ①太阳光催化分解水制氢:2H2O(l) 2H2(g)+O2(g) ΔH1=571.6 kJ·mol-1 ②焦炭与水反应制氢:C(s)+H2O(g) CO(g)+H2(g) ΔH2=131.3 kJ·mol-1 ③甲烷与水反应制氢:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH3=206.1 kJ·mol-1 A.反应①中电能转化为化学能 B.反应②为放热反应 C.反应③使用催化剂,ΔH3减小 D.反应CH4(g) C(s)+2H2(g)的ΔH=74.8 kJ·mol-1 答案 D 考点二 盖斯定律及反应热的有关计算 4.(2017江苏单科,8,2分)通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确···的是( ) ①C(s)+H2O(g) CO(g)+H2(g) ΔH1=a kJ·mol-1 ②CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=b kJ·mol-1 ③CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3=c kJ·mol-1 ④2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol-1 A.反应①、②为反应③提供原料气 B.反应③也是CO2资源化利用的方法之一 C.反应CH3OH(g) 12CH3OCH3(g)+12H2O(l)的ΔH=d2 kJ·mol-1 D.反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d)kJ·mol-1 答案 C 5.(2016海南单科,6,2分)油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应: C57H104O6(s)+80O2(g) 57CO2(g)+52H2O(l) 已知燃烧1 kg该化合物释放出热量3.8×104 kJ。油酸甘油酯的燃烧热ΔH为( ) A.3.8×104 kJ·mol-1 B.-3.8×104 kJ·mol-1 C.3.4×104 kJ·mol-1 D.-3.4×104 kJ·mol-1 答案 D 6.(2015重庆理综,6,6分)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为: S(s)+2KNO3(s)+3C(s) K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1 已知:碳的燃烧热ΔH1=a kJ·mol-1 S(s)+2K(s) K2S(s) ΔH2=b kJ·mol-1 2K(s)+N2(g)+3O2(g) 2KNO3(s) ΔH3=c kJ·mol-1 则x为( ) A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b 答案 A 7.(2019课标Ⅱ,27,15分)环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题: (1)已知:(g) (g)+H2(g) ΔH1=100.3 kJ·mol-1 ① H2(g)+I2(g) 2HI(g) ΔH2=-11.0 kJ·mol-1 ② 对于反应:(g)+I2(g) (g)+2HI(g) ③ ΔH3= kJ·mol-1。 (2)某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应③,起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为 ,该反应的平衡常数Kp= Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有 (填标号)。 A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度 (3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是 (填标号)。 A.T1>T2 B.a点的反应速率小于c点的反应速率 C.a点的正反应速率大于b点的逆反应速率 D.b点时二聚体的浓度为0.45 mol·L-1 (4)环戊二烯可用于制备二茂铁[Fe(C5H5)2,结构简式为],后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。 该电解池的阳极为 ,总反应为 。电解制备需要在无水条件下进行,原因为 。 答案 (1)89.3 (2)40% 3.56×104 BD (3)CD (4)Fe电极 水会阻碍中间物Na的生成;水会电解生成OH-,进一步与Fe2+反应生成Fe(OH)2 C组 教师专用题组 考点一 化学能与热能 热化学方程式 1.(2015北京理综,9,6分)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下: 下列说法正确的是( ) A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O C.CO和O生成了具有极性共价键的CO2 D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 答案 C 考点二 盖斯定律及反应热的有关计算 2.(2015海南单科,4,2分)已知丙烷的燃烧热ΔH=-2 215 kJ·mol-1。若一定量的丙烷完全燃烧后生成1.8 g水,则放出的热量约为( ) A.55 kJ B.220 kJ C.550 kJ D.1 108 kJ 答案 A 3.(2016课标Ⅱ,26,14分)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题: (1)联氨分子的电子式为 ,其中氮的化合价为 。 (2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 。 (3)①2O2(g)+N2(g) N2O4(l) ΔH1 ②N2(g)+2H2(g) N2H4(l) ΔH2 ③O2(g)+2H2(g) 2H2O(g) ΔH3 ④2N2H4(l)+N2O4(l) 3N2(g)+4H2O(g) ΔH4=-1 048.9 kJ·mol-1 上述反应热效应之间的关系式为ΔH4= ,联氨和N2O4可作为火箭推进剂的主要原因为 。 (4)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数值为 (已知:N2H4+H+ N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。 (5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1 kg的联氨可除去水中溶解的O2 kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 。 答案 (14分)(1)H∶N··H··∶N··H··∶H -2 (2)2NH3+NaClO N2H4+NaCl+H2O (3)2ΔH3-2ΔH2-ΔH1 反应放热量大、产生大量气体 (4)8.7×10-7 N2H6(HSO4)2 (5)固体逐渐变黑,并有气泡产生 1 N2H4的用量少,不产生其他杂质(产物为N2和H2O,而Na2SO3产生Na2SO4) 4.(2015福建理综,24,15分)无水氯化铝在生产、生活中应用广泛。 (1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为 。 (2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下: 已知: 物质 SiCl4 AlCl3 FeCl3 FeCl2 沸点/℃ 57.6 180(升华) 300(升华) 1 023 ①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是 (只要求写出一种)。 ②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是 。 ③已知:Al2O3(s)+3C(s) 2Al(s)+3CO(g) ΔH1=+1 344.1 kJ·mol-1 2AlCl3(g) 2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ·mol-1 由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为 。 ④步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为 。 ⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是 。 答案 (15分)(1)Al3++3H2O Al(OH)3+3H+ (2)①防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率 ②铁或Fe ③Al2O3(s)+3C(s)+3Cl2(g) 2AlCl3(g)+3CO(g) ΔH=+174.9 kJ·mol-1 ④NaCl、NaClO、Na2CO3 ⑤除去FeCl3,提高AlCl3纯度 【三年模拟】 一、选择题(每小题2分,共26分) 1.(2020届浙江名校联盟入学调研,13)1 mol白磷(P4,s)和4 mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是( ) A.P4(s,白磷) 4P(s,红磷) ΔH>0 B.以上变化中,白磷和红磷所需活化能相等 C.白磷比红磷稳定 D.红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g) P4O10(s) ΔH=-(E2-E3)kJ/mol 答案 D 2.(2020届舟山普陀中学复习检测,2)下图为氟利昂(如CFCl3)破坏臭氧层的反应过程示意图,下列不正确的是( ) A. 过程Ⅰ中断裂极性键C—Cl键 B.过程Ⅱ可表示为O3+Cl ClO+O2 C.过程Ⅲ中O+O O2是吸热过程 D.上述过程说明氟利昂中氯原子是破坏O3的催化剂 答案 C 3.(2019杭州二中选考模拟,21)肼(N2H4)在不同条件下分解产物不同。200 ℃时,其在Cu表面分解的机理如图。 已知200 ℃时:反应Ⅰ:3N2H4(g) N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1,反应Ⅱ:N2H4(g)+H2(g) 2NH3(g) ΔH2=-41.8 kJ·mol-1,下列说法不正确的是( ) A.图所示过程①是放热反应 B.反应Ⅱ的能量过程示意图如图所示 C.断开3 mol N2H4(g)的化学键吸收的能量大于形成1 mol N2(g)和4 mol NH3(g)的化学键释放的能量 D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g) N2(g)+2H2(g) ΔH=+50.7 kJ·mol-1 答案 C 4.(2019温州新力量联盟期末,19)某反应由两步反应A B C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( ) A.A C的反应为放热反应 B.稳定性C>A>B C.A C的反应中,ΔH=(E2+E4)-(E1+E3) D.加入催化剂不会改变反应的焓变 答案 C 5.(2020届浙江名校联盟入学调研2,7)下列四幅图示所表示的信息与对应的叙述相符的是( ) A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1 B.图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 C.图3表示一定条件下H2和Cl2生成HCl的反应热与途径无关,则ΔH1=ΔH2+ΔH3 D.图4表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 答案 C 6.(2019温州模拟,19)H2与ICl的反应分①、②两步进行,其能量曲线如图所示,下列有关说法正确的是( ) A.反应①、反应②的ΔH均大于零 B.反应①、反应②均为氧化还原反应 C.反应①比反应②的速率慢,与相应正反应的活化能无关 D.该反应的热反应方程式可表示为H2(g)+2ICl(g) I2(g)+2HCl(g) ΔH=-218 kJ 答案 B 7.(2019诸暨中学阶段考试,19)根据合成氨反应的能量变化示意图,下列有关说法正确的是( ) A.N2(g)+3H2(g) 2NH3(g) ΔH=-2(a-b) kJ·mol-1 B.断裂0.5 mol N2 (g)和1.5 mol H2(g)中所有的化学键释放a kJ热量 C.2NH3(l) N2(g)+3H2(g) ΔH=2(b+c-a) kJ·mol-1 D.若合成氨反应使用催化剂,反应放出的热量增多 答案 C 8.(2018浙江名校协作体2月期始联考,19)一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( ) A.这些离子中结合H+能力最强的是E B.A、B、C、D、E五种微粒中C最稳定 C.C B+D的反应中,反应物的总键能大于生成物的总键能 D.B A+D反应的热化学方程式为3ClO-(aq) ClO3-(aq)+2Cl-(aq) ΔH=-116 kJ·mol-1 答案 D 9.(2020届绍兴一中测试,12)根据以下热化学方程式,ΔH1和ΔH2的大小比较错误的是( ) A.2H2S(g)+3O2(g) 2SO2(g)+2H2O(l) ΔH1 2H2S(g)+O2(g) 2S(s)+2H2O(l) ΔH2,则有ΔH1>ΔH2 B.Br2(g)+H2(g) 2HBr(g) ΔH1 Br2(l)+H2(g) 2HBr(g) ΔH2,则有ΔH1<ΔH2 C.4Al(s)+3O2(g) 2Al2O3(s) ΔH1 4Fe(s)+3O2(g) 2Fe2O3(s) ΔH2,则有ΔH1<ΔH2 D.Cl2(g)+H2(g) 2HCl(g) ΔH1 Br2(g)+H2(g) 2HBr(g) ΔH2,则有ΔH1<ΔH2 答案 A 10.(2020届湖州中学复习检测,7)用H2可将工业废气中的NO催化还原为N2,其能量转化关系如图(图中计量单位为mol): 则:NO(g)+H2(g) 12 N2(g)+H2O(g)的ΔH为( ) A.12(a+b-c-d) kJ·mol-1 B.12(c+a-d-b) kJ·mol-1 C.12(c+d-a+b) kJ·mol-1 D.12(c+d-a-b) kJ·mol-1 答案 A 11.(2020届宁波慈溪中学期始,8)N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应原理为N2O(g)+CO(g) CO2(g)+N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下: 下列说法不正确的是( ) A.ΔH=ΔH1+ΔH2 B.ΔH=-226 kJ/mol C.该反应正反应的活化能小于逆反应的活化能 D.为了实现转化需不断向反应器中补充Pt2O+和Pt2O2+ 答案 D 12.(2018嘉兴一中期末,16)已知下列热化学方程式: Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=-24.8 kJ·mol-1 3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ·mol-1 Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) ΔH=+640.5 kJ·mol-1 则14 g CO气体与足量FeO充分反应得到Fe单质和CO2气体时的反应热为( ) A.-109 kJ·mol-1 B.-218 kJ·mol-1 C.+109 kJ·mol-1 D.+218 kJ·mol-1 答案 A 13.(2019嘉兴下学期期末,12)已知:氧化锂(Li2O)晶体形成过程中的能量变化如图所示: 下列说法正确的是( ) A.ΔH1<0,ΔH2>0 B.-ΔH5+ΔH1+ΔH2+ΔH3+ΔH4+ΔH6=0 C.ΔH3<0,ΔH4<0 D.ΔH1+ΔH2+ΔH3+ΔH4=ΔH5+ΔH6 答案 B 二、非选择题(共14分) 14.(2020届宁波镇海中学复习检测,24)(6分)(1)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整。向反应容器中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有: 项目 化学方程式 焓变 ΔH/(kJ·mol-1) 甲烷氧化 CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH1 CH4(g)+O2(g) CO2(g)+2H2(g) -322.0 蒸气重整 CH4(g)+H2O(g) CO(g)+3H2(g) +206.2 CH4(g)+2H2O(g) CO2(g)+4H2(g) +165.0 ①反应CO(g)+H2O(g) CO2(g)+H2(g)的ΔH= kJ·mol-1。 ②甲烷的燃烧热为ΔH2,则ΔH2 (填“>”“=”或“<”)ΔH1。 (2)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 2(t-BuNO) ΔH。实验测得该反应的ΔH=+50.5 kJ·mol-1,活化能Ea=90.4 kJ·mol-1。下列能量关系图合理的是 。 (3)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO和H2,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需的热量为 。 答案 (1)①-41.2 ②< (2)D (3)5.52×103 kJ 15.(8分)(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常为kJ·mol-1。请认真观察下图,然后回答问题。 ①图中所示的反应是 (填“吸热”或“放热”)反应,该反应的ΔH= (用含E1、E2的代数式表示)。 ②已知热化学方程式:H2(g)+12O2(g) H2O(g) ΔH=-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为 。 ③对于同一反应,图中虚线Ⅱ与实线Ⅰ相比,活化能大大降低,活化分子百分数增大,反应速率加快,你认为最可能的原因是 。 (2)通常把拆开1 mol化学键所吸收的热量看成该化学键的键能。已知部分化学键的键能如下: 化学键 N—H N—N OO O—H 键能/kJ·mol-1 386 167 498 946 460 发射神舟飞船的长征火箭用了肼(N2H4,气态)作燃料,试写出它在氧气中燃烧生成N2和气态水的热化学方程式: 。 答案 (1)①放热 -(E1-E2) kJ·mol-1 ②409.0 kJ·mol-1 ③使用了催化剂 (2)N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH=-577 kJ·mol-1查看更多