- 2021-07-05 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版无机工艺流程学案
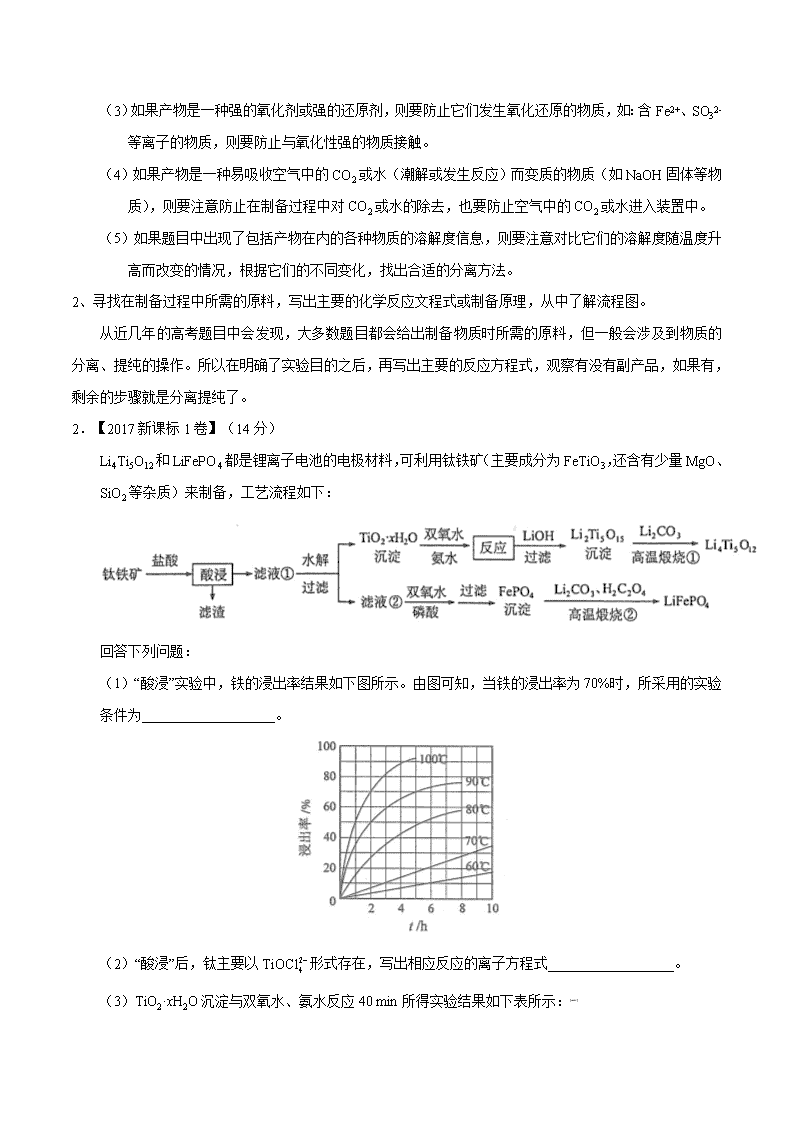
2019年全国卷高考化学总复习《无机工艺流程》专题突破 [题型分析]工艺流程题近几年是高考的热点,所占的分值也相当重,但由于此类试题陌生度高,对学生的能力要求也大,加上有的试题文字量大,学生在没做之前往往就会产生畏惧感,所以这类题的得分不是很理想。综合近几年的考查情况来看,预测2019年工艺流程在大部分省市卷中均会考查,这类题型一般有,从混合物中分离、提纯某一物质、利用某些物质制备另一物质、化工新技术类。 【例题演练】 ☆★考点一:物质分离提纯类 对于实验目的为一的题目,其实就是对混合物的除杂、分离、提纯。当遇到这一类题时,要求学生一定要认真在题目中找出要得到的主要物质是什么,混有的杂质有哪些,认真分析当加入某一试剂后,能与什么物质发生反应,生成了什么产物,要用什么样的方法才能将杂质除去。只有这样才能明白每一步所加试剂或操作的目的。这里特别提一提蒸发与结晶 。蒸发与结晶方法都可以将溶液中的溶质以固体形式析出,具体采用何种方法,主要取决于溶质的溶解度。 有的物质它的溶解度随温度的升高变化比较大,如NH4NO3、KNO3等物质,在蒸发过程中比较难析出来,所以要用冷却法使它结晶。而有的物质它的溶解度随温度的升高变化比较小,如NaCl、KCl等,有少数物质的溶解度随温度的升高而减小,如Ca(OH)2要使它们析出较多固体溶质时,则要用蒸发浓缩的方法。例如NaCl 和KNO3 混合溶液,如果将混合溶液蒸发一段时间,析出的固体主要是NaCl,母液中是KNO3 和少量NaCl 。如果将混合溶液加热后再降温,则析出的固体主要是KNO3,母液中是NaCl 和少量KNO3。如果是除杂,杂质所含的量比较少,一般是让主要物质析出来。如KNO3溶液中含少量NaCl,常用升温冷却结晶法,再经过过滤、洗涤、烘干(不同的物质在烘干时采取的方法不同),就可得到 KNO3固体了。如果NaCl溶液中含少量 KNO3,则用蒸发浓缩结晶法,这种方法一般要经过趁热过滤才能得到主要物质,主要原因是如果温度下降,杂质也会以晶体的形式析出来。 1.【2017江苏卷】(12分)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下: 注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。 (1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。 (2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。 (3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。 (4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。 (5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。 【答案】(1)Al2O3+2OH−=2AlO2-+H2O (2)减小(3)石墨电极被阳极上产生的O2氧化 (4)4CO32-+2H2O−4e−=4HCO3-+O2↑ H2 (5)NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜 ☆★考点二:制备某一物质的流程题 1、明确题目目的是制什么物质,从题干或问题中获取有用信息,了解产品的性质。 只有知道了实验目的,才能非常清楚的知道整个流程的意义所在,题目中的信息往往是制备该物质的关键所在。而产物如果具有某些特殊性质(由题目信息获得或根据所学知识判断),则要采取必要的措施来避免在生产过程中产生其它杂质。一般来说主要有如下几种情况: (1)如果在制备过程中出现一些受热易分解的物质或产物,则要注意对温度的控制。如:侯德榜制碱中的NaHCO3;还有如H2O2、Ca(HCO3)、KMnO4、AgNO3、HNO3(浓)等物质。 (2)如果产物是一种会水解的盐,且水解产物中有挥发性的酸产生时,则要加相对应的酸来防止水解。如:制备FeCl3、AlCl3、MgCl2、Cu(NO3)2等物质时,要蒸干其溶液得到固体溶质时,都要加相应的酸或在酸性气流中干燥来防止它水解,否则得到的产物分别是Fe2O3 、Al2O3 、MgO、CuO;而像Al2 (SO4)3 、NaAlO2 、Na2CO3等盐溶液,虽然也发生水解,但产物中Al(OH)3 、H2SO4 、NaHCO3、NaOH 都不是挥发性物质,在蒸发时,抑制了盐的水解,最后得到的还是溶质本身。 (3)如果产物是一种强的氧化剂或强的还原剂,则要防止它们发生氧化还原的物质,如:含Fe2+、SO32-等离子的物质,则要防止与氧化性强的物质接触。 (4)如果产物是一种易吸收空气中的CO2或水(潮解或发生反应)而变质的物质(如NaOH固体等物质),则要注意防止在制备过程中对CO2或水的除去,也要防止空气中的CO2或水进入装置中。 (5)如果题目中出现了包括产物在内的各种物质的溶解度信息,则要注意对比它们的溶解度随温度升高而改变的情况,根据它们的不同变化,找出合适的分离方法。 2、寻找在制备过程中所需的原料,写出主要的化学反应文程式或制备原理,从中了解流程图。 从近几年的高考题目中会发现,大多数题目都会给出制备物质时所需的原料,但一般会涉及到物质的分离、提纯的操作。所以在明确了实验目的之后,再写出主要的反应方程式,观察有没有副产品,如果有,剩余的步骤就是分离提纯了。 2.【2017新课标1卷】(14分) Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下: 回答下列问题: (1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________。 (2)“酸浸”后,钛主要以形式存在,写出相应反应的离子方程式__________________。 (3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:[来源:] 温度/℃ 30 35 40 45 50 TiO2·xH2O转化率% 92 95 97 93 88 分析40 ℃时TiO2·xH2O转化率最高的原因__________________。 (4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。 (5)若“滤液②”中,加入双氧水和磷酸(设溶液体积增加1倍),使恰好沉淀完全即溶液中,此时是否有Mg3(PO4)2沉淀生成? (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为。 (6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 。 【答案】(1)100℃、2h,90℃,5h (2)FeTiO3+ 4H++4Cl− = Fe2++ + 2H2O (3)低于40℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降 (4)4 (5)Fe3+恰好沉淀完全时, c()=mol·L−1=1.3×10–17 mol·L−1,c3(Mg2+)×c2()=(0.01)3×(1.3×10–17)2=1.7×10–40<Ksp [Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀。学科&网 (6)2FePO4 + Li2CO3+ H2C2O42LiFePO4+ H2O↑+ 3CO2↑[来源:] 【真题回访】 1.【2017新课标3卷】(15分) 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示: 回答下列问题: (1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+ Fe2O3+CO2+ NaNO2 上述反应配平后FeO·Cr2O3与NaNO3的系数比为_______。该步骤不能使用陶瓷容器,原因是_____。 (2)滤渣1中含量最多的金属元素是_______,滤渣2的主要成分是__________及含硅杂质。 (3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是_____________(用离子方程式表示)。 (4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。 a.80℃ b.60℃ c.40℃ d.10℃ 步骤⑤的反应类型是_________________。 (5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_________。 【答案】(1)2∶7 陶瓷在高温下会与Na2CO3反应 (2)铁 Al(OH)3 (3)小 2+2H++H2O (4)d 复分解反应 (5)×100% 2.【2017北京卷】(13分)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下: 资料:TiCl4及所含杂质氯化物的性质 化合物 SiCl4 TiCl4 AlCl3 FeCl3 MgCl2 沸点/℃ 58 136 181(升华) 316 1412 熔点/℃ −69 −25 193 304 714 在TiCl4中的溶解性 互溶 —— 微溶 难溶 (1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。 已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1 ① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。 ② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。 ③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是______________________。 ④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。 (2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下: 物质a是______________,T2应控制在_________。 【答案】(1)①TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H=-45.5 kJ/mol ②> 随温度升高,CO含量增大,说明生成CO的反应是吸热反应 学科&网 ③H2O、FeCl2溶液、NaOH溶液 ④MgCl2、AlCl3、FeCl3 (2)SiCl4 高于136℃,低于181℃ 3.以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下: (1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。 (2)过程Ⅰ中,Fe2+催化过程可表示为: i:2Fe2++ PbO2+4H++SO42−=2Fe3++PbSO4+2H2O ii: …… ①写出ii的离子方程式:________________。 ②下列实验方案可证实上述催化过程。将实验方案补充完整。 a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。 b.______________。 (3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)NaHPbO2(aq),其溶解度曲线如图所示。 ①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是_____(选填序号)。 A.减少PbO的损失,提高产品的产率 B.重复利用氢氧化钠,提高原料的利用率 C.增加Na2SO4浓度,提高脱硫效率 ②过滤Ⅲ的目的是提纯,综合上述溶解度曲线,简述过程Ⅲ的操作_______________________。 【答案】(1)Pb + PbO2 + 2H2SO4=2PbSO4+ 2H2O。 (2)①2Fe3++Pb+SO42—=PbSO4+2Fe2+; ②取a中红色溶液少量,加入过量Pb,充分反应后,红色褪去。 (3)①A、B;②将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤、洗涤并干燥得到PbO固体。 4.(12分)以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下: (1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。 ①生成Ca(ClO)2的化学方程式为 ▲ 。 ②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 ▲ (填序号)。 A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解 (2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为 6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O 氯化完成后过滤。 ①滤渣的主要成分为 ▲ (填化学式)。 ②滤液中Ca(ClO3)2与CaCl2的物质的量之比 n[Ca(ClO3)2] ∶n[CaCl2] ▲ 1∶5 (填“>”、“<”或“=”)。 (3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100g▪L-1,从该溶液中尽可能多地析出KClO3固体的方法是 ▲ 。 【答案】(1)①2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;②AB (2)①CaCO3、Ca(OH)2 ②<; (3)蒸发浓缩、冷却结晶 5.资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3 。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下: 已知:①Ca5(PO4)3F在950℃不分解; ②4Ca5(PO4)3F+18SiO2+30C2CaF2+30CO+18CaSiO3+3P4 请回答下列问题: (1)950℃煅烧磷尾矿生成气体的主要成分是___________。 (2)实验室过滤所需的玻璃仪器是_____________。 (3)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是__________。 (4)在浸取液II中通入NH3,发生反应的化学方程式是____________。 (5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时: CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol 5 CaO(s)+H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) △H=-937kJ/mol 则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。 (6)在一定条件下CO(g)+H2O(g) CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了5/6.若akg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。 【答案】(1)CO2 (2)漏斗、烧杯、玻璃棒。 (3)NH4+ 水解使溶液呈酸性,与CaO、Ca(OH)2反应生成Ca2+ (4)MgSO4+2NH3+2H2O=Mg(OH)2↓+(NH4)2SO4 。 (5)Ca5(PO4)3F (s)+ 5H2SO4(l)=5CaSO4(s) +H3PO4(l)+HF(g) △H=-418kJ/mol 。 (6) 6.为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。 活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题: (1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。 (2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。 A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液 (3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。 (4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。 已知25℃,101kPa时:4Fe(s) + 3O2 (g) =2Fe2O3(s) =-1648kJ/mol C(s)+O2(g)=CO2(g) =-393kJ/mol 2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) =-1480kJ/mol FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。 (5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2= Fe +2Li2S,正极反应式是 。 (6)假如烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。 【答案】 (1)Fe2O3+6H+=2Fe3++3H2O (2)C (3)Fe2+被氧化为Fe3+,Fe3+水解产生H+。学科&网 (4)4FeCO3(s)+O2(g) =2Fe2O3(s)+ 4CO2(g) =-260kJ/mol。 (5)FeS2+4e-= Fe +2S2- (6)-kg。 7.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下: (1)毒重石用盐酸浸取前需充分研磨,目的是 。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的 。 a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管 (2) Ca2+ Mg2+ Fe3+ 开始沉淀时的pH 11.9 9.1 1.9 完全沉淀时的pH 13.9 11.1 3.2 加入NH3·H2O调节pH=8可除去 (填离子符号),滤渣Ⅱ中含 (填化学式)。加入H2C2O4时应避免过量,原因是 。 已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9 (3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行。 已知:2CrO42—+2H+=Cr2O72—+H20 Ba2++CrO42—=BaCrO4↓ 步骤Ⅰ 移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。 步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。 滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的 (填“上方”或“下方”)。BaCl2 溶液的浓度为 mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将 (填“偏大”或“偏小”)。 【答案】(1)增大接触面积从而使反应速率加快;ac (2)Fe3+;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少。 (3)上方;(V0b—V1b)/y;偏小。 8.碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下: 已知TeO2微溶于水,易溶于较浓的强酸和强喊。 (1)“碱浸”时发生反应的离子方程式为____________________。 (2)碱浸后的“滤渣”可以部分溶于稀硝酸,发生反应的化学方程式是______________。 (3)“沉碲”时控制溶液的pH为4.5〜5.0,生成TeO2沉淀。酸性不能过强,其原因是_______________;防止局部酸度过大的操作方法是_________。 (4)“酸溶”后,将SO2通人TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是__________。 (5)25°C 时,亚碲酸(H2TeO3) 的Ka1=1×10-3,Ka2=2×10-8。 ①0.1 mol·L-1 H2TeO3电离度α约为_____________。(α=×100%) ②0.lmol • L-1的NaH TeO3溶液中,下列粒子的物质的量浓度关系正确的是___________。 A.c(Na+ )>c(HTeO3- )>c(OH-)>c(H2TeO3)>c(H+ ) B.c(Na+) + c( H+) >= c(HTeO3- ) +c(TeO32-) +c(OH- ) C.c(Na+ ) =c(TeO32-) +c( HTeO3-) + c( H2TeO3) D.c(H+)+c(H2TeO3)=c(OH-)+e(TeO32-) 【答案】 TeO2+2OH-=TeO32-+H2O 3Ag +4HNO3 = 3AgNO3 +NO↑+2H2O 溶液酸性过强,TeO2会继续与酸反应导致碲元素损失 缓慢加入H2SO4,并不断搅拌 TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4 10% C D 9.金属钒主要用于冶炼特种钢和在化学工业、炼油工业中作催化剂,被誉为“合金的维生素”。回收利用废钒催化剂(主要成分为V2O5、VOSO4和二氧化硅)的工艺流程如下图所示。 (1)粉碎的作用是_______,滤渣可用于_______(填用途)。 (2)25时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表所示: pH 1.3 1.4 1.5 1.6 1.7 1.8 1.9 2.0 2.1 钒沉淀率/% 8.1 91.8 96.5 98 99.8 9.8 96.4 93.0 89.3 根据上表数据判断,加入氨水调节溶液pH的最佳选择为_____;上述过滤操作过程中所需用到的玻璃仪器有__________。 (3)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中还原产物和氧化产物的物质的量之比为_______。 (4)完成并配平氧化过程中的离子方程式:_____ _____ClO3-+ VO2+ + = VO3++ Cl-+ 。 (5)废钒催化剂中V2O5的质量分数为6%(原料中的所有钒已换算成V2O5)。取100g此废钒催化剂按上述流程进行实验,当加入105 mL 0.1 mol·L-1的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该工业生产中钒的回收率是________。 【答案】提高VOSO4(可溶性钒化合物)的浸出率 制作光导纤维、建筑材料等(写出一种即可得分) 1.7-1.8(或1.7或1.8) 漏斗、烧杯、玻璃棒 2:1 1 6 6H+ 6 1 3H2O 95.55% 10.硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的工业原料,能溶于水,不溶于乙醇,其工业制法如下。请回答: (1)步骤①中碱液洗涤的目的是 ▲ 。若将碱液换为酸液,可能产生的问题是_▲ 。 (2)步骤②中B可以是 ▲ (填字母),加入少量B的目的是 ▲ 。 a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4 (3)步骤⑥中要用到少量乙醇洗涤,其目的是 ▲ 。 (4)用硫酸亚铁按晶体配制溶液时,需加入一定量硫酸,目的是 ▲ 。工业上常用酸性KMnO4溶液通过滴定的方法测定硫酸亚铁铵样品的纯度,反应的离子方程式为 ▲ 。准确量取硫酸亚铁铵溶液时,硫酸亚铁铵溶液应盛放于 ▲ (填“酸式”或“碱式”)滴定管中。 (5)硫酸亚铁铵晶体的样品中可能含有的杂质离子是 ▲ ,实验室的检验方法是 ▲ 。 【答案】(15分)(1)除去油污和锌层(2分);铁部分损失(或油污未除净)(1分) (2) b、d(2分);加快铁与稀硫酸的反应速率(1分); [来源:] (3)除去少量水并避免硫酸亚铁铵晶体因溶解而损失(2分) (4)避免样品水解(1分);MnO4-+5Fe2++8H+ =Mn2++5Fe3++4H2O(2分);酸式(1分); (5)Fe3+(或铁离子)(1分);取少许样品加入到KSCN溶液中,观察是否有血红色出现(2分)。 11.利用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)可制备高性能磁性材料(MnCO3)及纯净的氯化铜晶体(CuCl2•2H2O)。工业流程如下: 已知:几种金属离子沉淀的pH如表 金属离子 Fe2+ Fe3+ Cu2+ Mn2+ 开始沉淀的pH 7.5 3.2 5.2 8.8 完全沉淀的pH 9.7 3.7 6.4 10.4 回答下列问题: (1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为 (2)过程②中,所得滤渣W的成分是 。 (3)过程③中,调pH=6.4目的是 。 (4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是 。 (5)将滤渣Q溶解在过量的盐酸中,经过 ,过滤、洗涤、低温烘干,即可获得纯净的氯化铜晶体(CuCl2•2H2O)。 (6)过程④中,298K、c(Mn2+)为1.05mol/L时,实验测得MnCO3 的产率与溶液pH、反应时间关系如右图。 据图中信息,你选择的最佳pH是 ;理由是 。 (7)从滤液C可得到的副产品是 (填化学式)。 【答案】(14分)(每空2分) (1)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O; (2)Fe(OH)3和过量的MnO2 (3)使Cu2+ 完全沉淀为Cu(OH)2 (4)Mn2++2HCO3-= MnCO3 ↓+ CO2↑+H2O (5)加热浓缩,降温结晶 (其它合理答案也给分) (6)7.0(1分) pH等于7.0时反应速率最快,且MnCO3产率最高 (7)NH4Cl(1分)。 12.(10分)电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。其工业制取流程如下: (1)滤渣A的成分除过量的Co3(PO4)2和Fe(OH)3外还有 (填化学式)。 (2)加入Co3(PO4)2的目的是__________________。 (3)Co与稀硝酸反应生成Co2+的离子方程式为 。 (4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:[来源:] 写出B点物质的化学式:__________,C点物质的化学式:________________。 【答案】(10分)(1) Si(2分) (2)调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀(2分) (3)3Co+8H++2NO===3Co2++4H2O+2NO↑(2分) (4)①CoO (2分) ②Co3O4(2分) 13.(15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。高铁酸钾为暗红色粉末状晶体,干燥的晶体80℃以下十分稳定,它极易溶于水,难溶于异丙醇。实验室模拟生产工艺流程如下: 已知:①2KOH+Cl2=KCl+KClO+H2O(条件:较低温度) ②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:较高温度) ③K2FeO4 在水溶液中易水解:4FeO42-+10H2O4Fe(OH)3(胶体)+8OH-+3O2↑ 回答下列问题: 实验室可利用右图装置完成流程①和② (1)仪器a的名称是 ▲ ,恒压滴液漏斗支管的作用是 ▲ ,两水槽中的水为 ▲ (填“热水”或“冷水”)。 (2)反应一段时间后,停止通氯气,再往仪器a中加入浓KOH溶液的目的是 ▲ ;判断浓KOH溶液已过量的实验依据是 ▲ 。 (3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子方程式为: ▲ 。 (4)用重结晶法提纯粗产品:将粗产品先用KOH稀溶液溶解,再加入饱和的KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。 ① 粗产品用KOH溶解的目的是 ▲ 。 ② 如何判断K2FeO4晶体已经洗涤干净 ▲ 。 (5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如右图。电解过程中阳极的电极反应式为 ▲ 。 【答案】(1)三颈烧瓶;平衡压强;冷水 (2)与过量的氯气继续反应,生成更多的KClO,并提供碱性环境;三颈烧瓶内颜色彻底变为无色,再加适量的浓KOH溶液 (3)2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O (4)①增大c(0H—)浓度,抑制FeO42-的水解 ②取最后一次洗涤液,加硝酸酸化的硝酸银溶液,若无白色沉淀,则已洗涤干净 (5)Fe—6e—+80H-=FeO42-+4H2O 14.工业上用重晶石(BaSO4)制备其他钡盐的常用方法主要有高温煅烧还原法、沉淀转化法等。 I. 高温煅烧还原法 工业上利用重晶石高温煅烧还原法制备BaCl2的工艺流程图如下: 某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得: BaSO4(s) + 4C(s)4CO(g) + BaS(s) △H1 = + 571.2 kJ·mol-1 ① BaSO4(s) + 2C(s)2CO2(g) + BaS(s) △H2 = + 226.2 kJ·mol-1 ② (1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为: 。 (2)反应C(s) + CO2(g)2CO(g)的△H= kJ·mol-1。 (3)实际生产中必须加入过量的炭,同时还要通入空气,其目的可能是 。 II.沉淀转化法 (4)已知KSP(BaSO4) =1.0×10-10,KSP(BaCO3)=2.5×10-9。某同学设想用饱和Na2CO3溶液和盐酸将 BaSO4转化成BaCl2,若用10 L Na2CO3溶液一次性溶解并完全转化1.0 mol BaSO4(溶液体积变化可忽略不计), 则该转化过程的离子方程式为 ; 反应的平衡常数K= ;Na2CO3溶液的最初浓度不得低于 。 【答案】(1)S2- + H2O HS- +OH-;HS- + H2O H2S +OH-(写第一步即可)(2分) (2)+ 172.5 ;(2分) (3)使BaSO4得到充分的还原(或提高BaS的产量);①②为吸热反应,炭和氧气反应放热维持反应所需高温。(其他合理答案也给分)(2分) (4)BaSO4(s) + CO32-(aq)BaCO3(s) + SO42-(3分) 0.04(2分);2.6 mol/L(2分)查看更多