- 2021-05-14 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学广东卷试题及答案
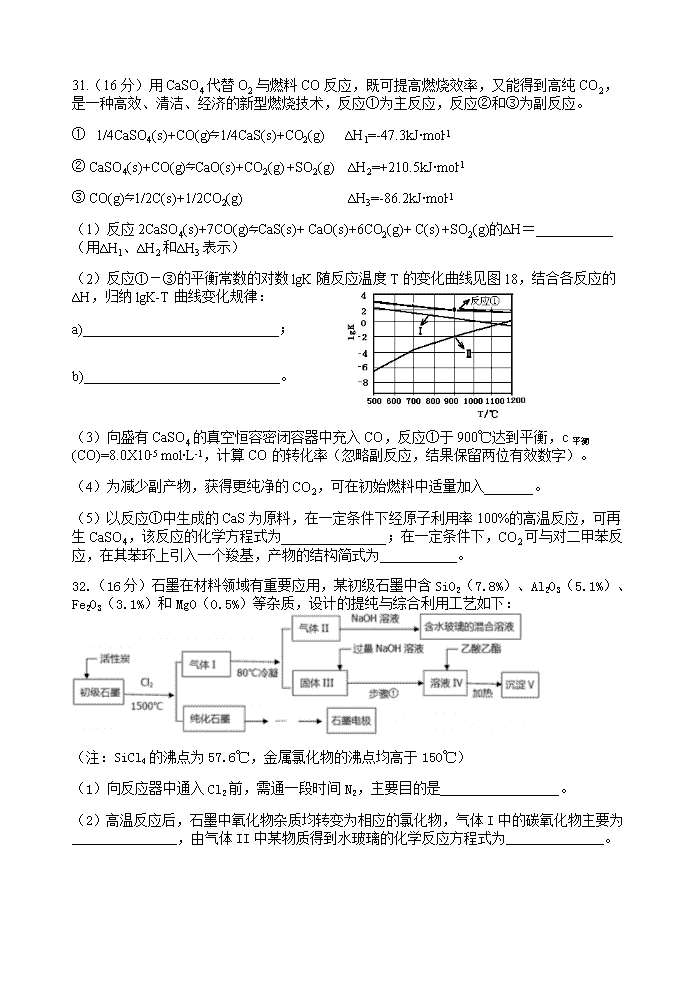
2014广东高考化学试题及答案 7.生活处处有化学。下列说法正确的是 A.制饭勺、饭盒、高压锅等的不锈钢是合金 B.做衣服的棉和麻均与淀粉互为同分异构体 C.煎炸食物的花生油和牛油都是可皂化的饱和酯类 D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 8.水溶液中能大量共存的一组离子是 A.Na+、Ca2+、Cl-、SO42- B.Fe2+、H+、SO32-、ClO- C.Mg2+、NH4+、Cl-、SO42- D.K+、Fe3+、NO3-、SCN- 9. 下列叙述I和II均正确并有因果关系的是 选项 叙述I 叙述II A KNO3的溶解度大 用重结晶法除去KNO3中混有的NaCl B BaSO4难溶于酸 用盐酸和BaCl2溶液检验SO42- C NH3能使酚酞溶液变红 NH3可用于设计喷泉实验 D Ca(OH)2能制成澄清石灰水 可配制2.0 mol∙L-1的Ca(OH)2溶液 10.设nA为阿伏加德罗常数的数值。下列说法正确的是 A.1mol甲苯含有6nA个C-H键 B.18gH2O含有10nA个质子 C.标准状况下,22.4L氨水含有nA个NH3分子 D.56g铁片投入足量浓H2SO4中生成nA个SO2分子 11.某同学组装了图4所示的电化学装置,电极ⅠAl,其它均为Cu,则 A、 电流方向:电极Ⅳ→A→电极Ⅰ B、 电极Ⅰ发生还原反应 C、 电极Ⅱ逐渐溶解 D、 电极Ⅲ的电极反应:Cu2+ + 2e- = Cu 12.常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液 等体积混合后,所得溶液中部分微粒组分及浓度 如图5所示,下列说法正确的是 A、 HA为强酸 B、 该混合液pH=7 C、 图中X表示HA,Y表示OH-,Z表示H+ D、 该混合溶液中:c(A-)+ c(Y)=c(Na+) 22.下列实验操作、现象和结论均正确的是 选项 实验操作 现象 结论 A 向苏打和小苏打溶液中分别加入盐酸 均冒气泡 两者均能与盐酸反应 B 向AgNO3溶液中滴加过量氨水 溶液澄清 Ag+与NH3∙H2O能大量共存 C 将可调高度的铜丝伸入到稀HNO3中 溶液变蓝 Cu与稀HNO3发生置换反应 D 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 下层溶液显紫红色 氧化性:Fe3+>I2 23.甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是 A.金属性:甲>乙>丁 B.原子半径:辛>己>戊 C.丙与庚的原子核外电子数相差13 D.乙的单质在空气中燃烧生成只含离子键的化合物 30.(15分)不饱和酯类化合物在药物、涂料等应用广泛。 (1)下列化合物I的说法,正确的是 。 A.遇FeCl3溶液可能显紫色 B.可发生酯化反应和银镜反应 C.能与溴发生取代和加成反应 D.1mol化合物I最多能与2molNaOH反应 一定条件 -CH=CH2+2ROH+2CO+O2 ① 2CH3- -CH=CHCOOR+2H2O 2CH3- Ⅱ (2)反应①是一种由烯烃直接制备不饱和酯的新方法: 化合物II的分子式为 ___ ,1mol化合物II能与___molH2恰好完全反应生成饱和烃类化合物。 (3)化合物II可由芳香族化合物III或IV分别通过消去反应获得,但只有II能与Na反应产生H2,II的结构简式为________(写1种);由IV生成II的反应条件为_______。 (4)聚合物可用于制备涂料,其单体结构简式为____________________。利用类似反应①的方法,仅以乙烯为有机物原料合成该单体,涉及的反应方程式为____________________________________________________。 31.(16分)用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。 ① 1/4CaSO4(s)+CO(g)⇋1/4CaS(s)+CO2(g) ∆H1=-47.3kJ∙mol-1 ② CaSO4(s)+CO(g)⇋CaO(s)+CO2(g) +SO2(g) ∆H2=+210.5kJ∙mol-1 ③ CO(g)⇋1/2C(s)+1/2CO2(g) ∆H3=-86.2kJ∙mol-1 (1)反应2CaSO4(s)+7CO(g)⇋CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)的∆H=___________(用∆H1、∆H2和∆H3表示) (2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图18,结合各反应的∆H,归纳lgK-T曲线变化规律: a)____________________________; b)____________________________。 (3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900℃达到平衡,c平衡(CO)=8.0X10-5 mol∙L-1,计算CO的转化率(忽略副反应,结果保留两位有效数字)。 (4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入_______。 (5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为_______________;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为___________。 32.(16分)石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下: (注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃) (1)向反应器中通入Cl2前,需通一段时间N2,主要目的是_________________。 (2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物,气体I中的碳氧化物主要为_______________,由气体II中某物质得到水玻璃的化学反应方程式为______________。 (3)步骤①为:搅拌、________、所得溶液IV中的阴离子有_______________。 (4)由溶液IV生成沉淀V的总反应的离子方程式为___________________,100kg初级石墨最多可获得V的质量为___________kg。 (5)石墨可用于自然水体中铜件的电化学防腐,完成图19防腐示意图,并作相应标注。 33.(17分)H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。 (1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol∙L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器 ①写出本实验H2O2分解反应方程式 并标明电子转移的方向和数目:_____________________ ②设计实验方案:在不同H2O2浓度下,测定___________ (要求所测得的数据能直接体现反应速率大小)。 ③设计实验装置,完成图20的装置示意图。 ④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。 (2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_________________________________________________。 7.解析:答案为A。注意抽象出化学概念,A项:“不锈钢是合金”,不锈钢是铁、钴、镍的合金。B项:棉和麻主要成分是纤维素与淀粉不属于同分异构。C项:花生油是植物是不饱和酯类。D项:蛋白质要在催化剂作用下才能水解为氨基酸。 8.解析:答案为C。A项:CaSO4微溶不可大量共存。B项:ClO-氧化Fe2+、SO32-。D项:Fe3+和SCN-不可共存。 9.解析:答案为B。A项:重结晶分离物质的条件是:溶解度随温度变化大与溶解度随温度变化小的可溶性物质。D项:Ca(OH)2微溶于水,常温下溶解度为0.02克左右。不可能配制出2.0 mol∙L-1的Ca(OH)2溶液。 10.解析:答案为B。A项:甲苯化学式为C7H8,有8个C-H键。B项:18gH2O为1mol水有10摩尔质子。C项:22.4L氨水非气体不可计算。D项:铁片与浓H2SO4中钝化,只有表面反应,不可计算。 11.解析:答案为A。注意左边两个烧杯形成双桶原电池,最右边烧杯是电镀池。各电极名称依次是Ⅰ(负极)Ⅱ(正极)Ⅲ(阳极)Ⅳ(阴极)。A项:电子从Ⅰ经A流向Ⅳ,电流方向相反,故A正确。B项:Al铝是金属失电子,还原剂发生氧化反应。C项:Ⅱ极上有铜析出。D项:Ⅲ阳极铜溶解,Ⅳ阴析铜析出。 12.解析:答案为D。一元酸HA与等浓度的NaOH溶液等体积混合后,两者恰反应,溶液中只有溶质NaA且浓度为0.1 mol/L。由图5中A-离子浓度小于0.1mol/L,说明A- 离子发生了水解,从而可知HA是弱酸,故A错误项。B项:水解显碱性 pH>7。故B项错误。此外,溶液中除Na+,其它离子大小为c(A-)>c(OH-)>c(HA)>c(H+)可知C项错。由物料守恒知D项正确。 22.解析:答案为AD。A项:B项氨水可与Ag+发生络合反应,先生成沉淀Ag(OH)后溶解生成Ag(NH3)2OH溶液,故B项错误。C项铜与稀酸发生的反应不是置换反应,故C明显错误。 23.解析:答案为BC。由题给信息可知戊是“碳”,因此己是“硅”;庚是“锗”,且锗的原子序数是14(硅)+18(同主族短长周期相差)=32;再由甲与戊的原子序数相差3,可知甲是“锂”;乙是“钠”,丙是“钾”;丁是“钙”。据可知:A项明显错,C项锗与钾32-19=13正确。D项钠的氧化物,过氧化钠中含有共价键,故D项错误。 30.参考答案:NaOH醇溶液/△。 -CH(OH)-CH3 CH3- 或 -CH2-CH2-OH CH3- (1)AC (2)C9H10 4 CH2=CHCOOCH2CH3 催化剂 CH2=CH2+ H2O CH3CH2OH 一定条件 2CH2=CH2+2CH3CH2OH+2CO+O2 2CH2=CHCOOCH2CH3+2H2O (3) (4) (1)∆H=4∆H1+∆H2+2∆H3=-151.1 kj/mol (2)a)反应②为吸热反应,温度升高K值增大,lgK也增大。 -CH3 | COOH CH3- b)反应①③为放热反应,温度升高K值减小,lgK也减小。 (3)99% (4)氧气 (5)CaS+2O2高温CaSO4 解析:(3)由图可以得在900℃时1/4CaSO4(s)+CO(g)⇋1/4CaS(s)+CO2(g)的lgK=2,即K=100 K=c(CO2)/c(CO)= 100,可知平衡时c(CO2)= 8.0X10-3 mol∙L-1 故:CO的转化率为8.0X10-3 mol∙L-1÷(8.0X10-3 mol∙L-1+8.0X10-5 mol∙L-1)=99% 32.参考答案: (1) 通入N2作保护气,排尽装置中的氧气,以防在高温下与活性炭和石墨反应。 (2) CO , SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O(3) 静置、过滤。Cl-、AlO2-。 (4) AlO2- +CH3COOCH2CH3+2H2O CH3COO- + Al(OH)3↓+CH3CH2OH ,7.8Kg (5) 外加电流阴极保护法。 解析(2)只能是CO不可能是CO2,因为石墨与CO2高温下也会转化CO (3)固体Ⅲ含AlCl3、FeCl3、MgCl2加过量NaOH溶液有沉淀Mg(OH)2Fe(OH)3和溶液NaAlO2、NaCl。要分离出沉淀的操作是过滤。(4) Al2O3~2Al(OH)3 100Kg×5.1%÷102×156=7.8Kg 33(1)① ②相同时间产生氧气的体积。 ③ ④ (2)深。原因是2NO2(红棕色)⇋N2O4(无色),△H<0是放热反应,且双氧水的分解反应也是放热反应。当右边双氧水分解时放出的热量会使B瓶升温,使瓶中反应朝逆反应方向移动,即向生成NO2移动,故B瓶颜色更深。查看更多