- 2021-05-14 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学二轮复习化学实验方案设计与评价专题跟踪训练
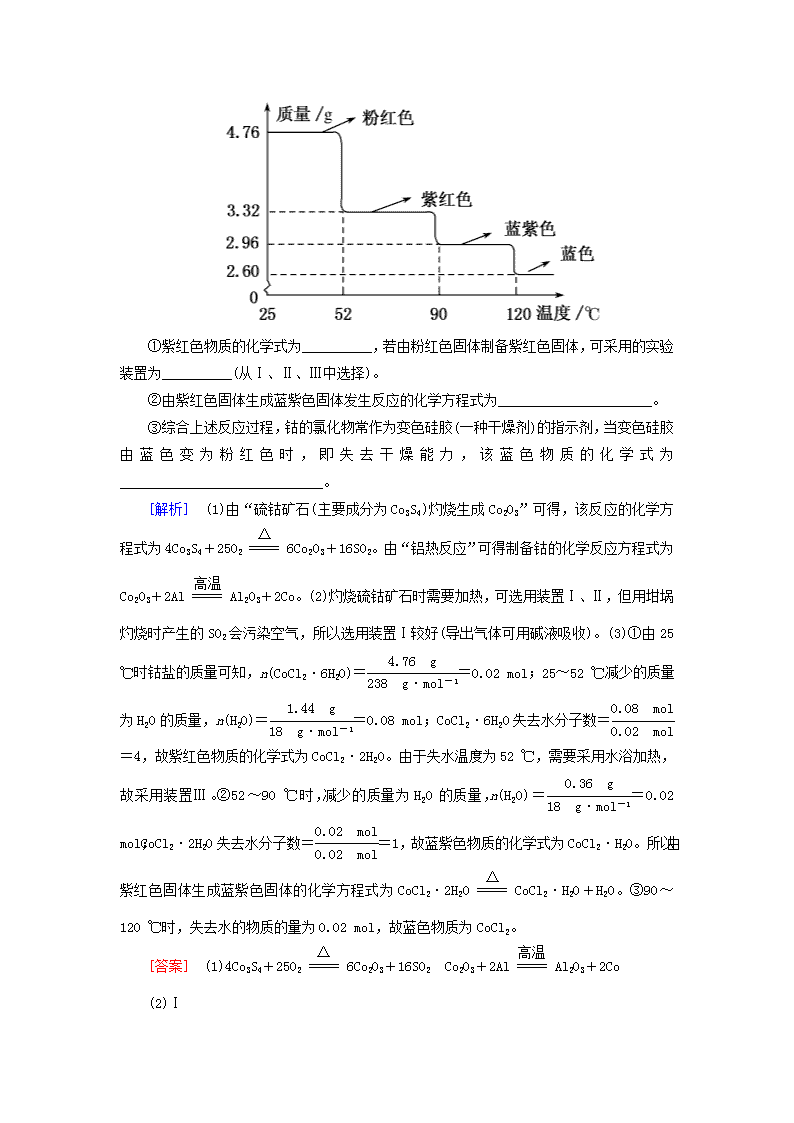
第13讲 化学实验方案设计与评价 专题跟踪训练(十三) 能力练(20分钟 50分) 非选择题(共50分) 1.(16分)三氯化硼是一种重要的化工原料。某同学设计的三氯化硼制备装置如图所示。 [查阅资料]①BCl3的熔点为-107.3 ℃,沸点为12.5 ℃; ②2B+6HCl2BCl3+3H2; ③硼与铝的性质相似,氯化物也易水解,硼也能与碱反应。 请回答下列问题: (1)装置A是用高锰酸钾固体与浓盐酸反应制氯气,反应的离子方程式为___________________________________________________。 (2)为了完成三氯化硼的制备,装置从左到右的接口连接顺序为________________________。 (3)装置E中的试剂为__________,如果拆去装置E,可能的后果是__________________________________。 (4)装置D中发生反应前先通入一段时间的氯气,其目的是__________________________,该装置中发生反应的化学方程式为____________________________。 (5)BCl3与水能剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式______________________________________________。 (6)请设计一个简易实验,验证制得的产品中是否含有硼粉__________________________。 [解析] (1)装置A中发生反应的离子方程式为2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O。(2)由于制取的Cl2中含杂质HCl、H2O,所以Cl2与硼反应前需要先除去Cl2中含有的杂质,又因为“硼与铝的性质相似,氯化物也易水解”,生成BCl3的装置中应防止水蒸气进入,故右侧应连接盛有浓H2SO4 的干燥装置。装置的连接顺序为a→hi→fg→bc→de→j(f和g可互换,b和c可互换)。(3)装置E中的试剂为饱和食盐水,目的是除去Cl2中的HCl;若拆去装置E,杂质HCl与硼反应产生的H2与Cl2混合,加热时可能会引起爆炸。(4)硼粉能与空气中的氧气反应,故反应前应通入Cl2排尽装置中的空气。(5)由“生成硼酸(H3BO3)和白雾”可知该反应为BCl3+3H2O===H3BO3+3HCl。(6)由“硼也能与碱反应”可知在产品中加入NaOH溶液,若产生气泡,则说明含有硼粉。 [答案] (1)2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O (2)a→hi→fg→bc→de→j(f和g可互换,b和c可互换) (3)饱和食盐水 HCl与硼反应产生的H2与Cl2混合,加热时可能会引起爆炸 (4)通入Cl2以排尽装置中的空气,防止硼被氧化 2B+3Cl22BCl3 (5)BCl3+3H2O===H3BO3+3HCl (6)取少量产品于试管中,加入NaOH溶液,若产生气泡(H2),则说明含有硼粉 2.(18分)Co-60可用于癌症的放射性治疗和蔬菜保鲜。已知:硫钴矿石(主要成分为Co3S4)灼烧会生成Co2O3(黑色),Co2O3与Al发生铝热反应可生成Co。请回答下列问题: (1)写出“已知”中的两个反应的化学方程式:________________________、______________________。 (2)实验室由硫钴矿石(主要成分为Co3S4)灼烧生成Co2O3时,可选用下面的装置__________(填序号)。 (3)钴单质可与稀盐酸反应生成CoCl2(蓝色)和H2。CoCl2吸水后会生成不同颜色的物质,如CoCl2·6H2O为粉红色。如图所示为CoCl2·6H2O受热时的温度与质量的关系图。 ①紫红色物质的化学式为__________,若由粉红色固体制备紫红色固体,可采用的实验装置为__________(从Ⅰ、Ⅱ、Ⅲ中选择)。 ②由紫红色固体生成蓝紫色固体发生反应的化学方程式为______________________。 ③综合上述反应过程,钴的氯化物常作为变色硅胶(一种干燥剂)的指示剂,当变色硅胶由蓝色变为粉红色时,即失去干燥能力,该蓝色物质的化学式为_____________________________。 [解析] (1)由“硫钴矿石(主要成分为Co3S4)灼烧生成Co2O3”可得,该反应的化学方程式为4Co3S4+25O26Co2O3+16SO2。由“铝热反应”可得制备钴的化学反应方程式为Co2O3+2AlAl2O3+2Co。(2)灼烧硫钴矿石时需要加热,可选用装置Ⅰ、Ⅱ,但用坩埚灼烧时产生的SO2会污染空气,所以选用装置Ⅰ较好(导出气体可用碱液吸收)。(3)①由25 ℃时钴盐的质量可知,n(CoCl2·6H2O)==0.02 mol;25~52 ℃减少的质量为H2O的质量,n(H2O)==0.08 mol;CoCl2·6H2O失去水分子数==4,故紫红色物质的化学式为CoCl2·2H2O。由于失水温度为52 ℃,需要采用水浴加热,故采用装置Ⅲ。②52~90 ℃时,减少的质量为H2O的质量,n(H2O)==0.02 mol;CoCl2·2H2O失去水分子数==1,故蓝紫色物质的化学式为CoCl2·H2O。所以由紫红色固体生成蓝紫色固体的化学方程式为CoCl2·2H2OCoCl2·H2O+H2O。③90~120 ℃时,失去水的物质的量为0.02 mol,故蓝色物质为CoCl2。 [答案] (1)4Co3S4+25O26Co2O3+16SO2 Co2O3+2AlAl2O3+2Co (2)Ⅰ (3)①CoCl2·2H2O Ⅲ ②CoCl2·2H2OCoCl2·H2O+H2O ③CoCl2 3.(16分)亚硝酰氯(NOCl)的沸点为-5.5 ℃,具有刺鼻恶臭味,溶于发烟硫酸,遇水则分解,是有机合成中的重要试剂。某同学用如图装置,由NO与干燥纯净的Cl2反应制备NOCl。 已知:①Cl2的沸点为-34.6 ℃,NO2Cl的沸点为-15 ℃; ②2NO+Cl2===2NOCl,2NO2+Cl2===2NO2Cl。 回答下列问题: (1)铜与稀硝酸反应的化学方程式为__________________; 装置A中设计了可上下移动的铜丝,其优点是_________________________________________。 (2)题图中实验装置的连接顺序:a→_____________________________________________。 (3)实验时,先制取氯气使其充满除A、B、C外的整套装置,目的是_____________________________________; 装置中充满氯气后,下一步是制取NO,具体操作是_____________________________________________________; E中冰盐水的温度可低至-22 ℃,其作用是______________。 (4)该同学的实验设计可能的不足之处是_______________________________________________________。 (5)若无C装置,则不利于NOCl的制备,主要原因是______________________________(用化学方程式表示)。 [解析] (1)铜与稀硝酸反应的化学方程式为3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。上下移动的铜丝的作用是可以控制反应的开始与停止。(2)由已知②和NOCl遇水则分解可知,需制取纯净的Cl2和NO,并在制备与收集NOCl前后连接干燥管防止水蒸气进入装置,才能制备NOCl,最后还需要尾气处理装置。装置的连接顺序为a→d→e→b→c→i→j→f→g→h。(3)“先制取氯气使其充满除A、B、C外的整套装置”的目的是排尽装置中的空气,以防止NO被氧化成NO2而生成杂质NO2Cl。向下移动铜丝与稀硝酸接触,即可反应制得NO。E中冰盐水的作用是使NOCl冷凝成液态,分离NOCl与尾气。(4)该实验设计中B、C中有少量空气,可能会将NO氧化为NO2,使制备的产物中含杂质NO2Cl。(5)若无C装置,NOCl会与水反应生成HCl和HNO2。 [答案] (1)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O 可以控制反应的开始与停止 (2)d→e→b→c→i→j→f→g→h (3)排尽装置中的空气 向下移动铜丝,与稀硝酸接触 使NOCl冷凝成液态,分离NOCl与尾气 (4)B、C中有少量空气,可能会将NO氧化为NO2,使制备的产物中含杂质NO2Cl (5)NOCl+H2O===HNO2+HCl 拔高练(25分钟 50分) 非选择题(共50分) 1.(16分)氯苯是染料、医药、有机合成的中间体,是重要的有机化工产品。实验室制取氯苯的装置如图所示(加热和夹持装置已略去)。回答下列问题: (1)仪器a、b组合成制取氯气的装置,反应不需要加热,则仪器a中的固体反应物可以是________(填标号)。 A.MnO2 B.KMnO4 C.K2Cr2O7 (2)把氯气通入仪器d中(仪器d中有FeCl3和苯),加热维持反应温度为40~60 ℃,温度过高会生成过多的二氯苯。对仪器d加热的方法是____________________________________________。 (3)仪器c的名称是________,仪器c出口的气体成分有HCl、Cl2、水蒸气和________。 (4)制取氯苯的化学方程式为______________________。 (5)仪器d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。 ①碱洗之前要进行水洗,其目的是________________________________________________。 ②用10% NaOH溶液碱洗时发生氧化还原反应的化学方程式为__________________________________________________。 (6)工业生产中苯的流失情况如表所示: 则10 t苯可得成品氯苯________________t。(列出计算式即可) [解析] [答案] (1)BC (2)水浴加热 (3)球形冷凝管 苯蒸气 (4) (5)①洗去产品中的FeCl3、HCl,节省碱的用量,降低成本 ②Cl2+2NaOH===NaCl+NaClO+H2O (6) 2.(14分)磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成: 请回答: (1)A的组成元素为________(用元素符号表示),化学式为__________________________。 (2)溶液C可溶解铜片,列举该反应的一个实际应用__________________________。 (3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为________________,写出该反应的离子方程式________________。 (4)写出F→G反应的化学方程式_______________,设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________ ________________________________。 [解析] (1)由C中加入KSCN溶液后呈红色,可推出B为Fe2O3,C为FeCl3 。由无色酸性溶液F与I2的KI溶液反应后生成无色溶液G,说明无色酸性溶液F具有还原性,结合“A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(M=22.4 L·mol-1×1.518 g·L-1≈34 g·mol-1,为H2S)”,说明A中含有S元素,则无色气体E为SO2,无色酸性溶液F为H2SO3溶液,与I2反应的化学方程式为H2SO3+I2+H2O===H2SO4+2HI。由“2.960 g化合物A”“2.400 g红棕色固体B”,可得n(Fe)=0.03 mol,n(S)=0.04 mol,A的化学式为Fe3S4。 (2)FeCl3与铜片的反应为2FeCl3+Cu===CuCl2+2FeCl2,该反应在工业上可用于制印刷电路板。 [答案] (1)Fe、S Fe3S4 (2)制印刷电路板 3.(20分)(2018·山东日照二模)水合肼(N2H4·H2O)又名水合联氨,无色液体,具有腐蚀性和强还原性,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO===N2H4·H2O+Na2CO3+NaCl。 实验1:制备NaClO溶液(已知:3NaClO2NaCl+NaClO3)。 (1)图甲装置Ⅰ中烧瓶内发生反应的化学方程式______________。 (2)用NaOH固体配制溶质质量分数为30% NaOH溶液时,所需玻璃仪器除量筒外还有________(填标号)。 a.烧杯 b.容量瓶 c.玻璃棒 d.烧瓶 (3)图甲装置Ⅱ中用冰水浴控制温度的目___________________。 实验2:制取水合肼。 (4)图乙中若分液漏斗滴液速率过快,部分N2H4·H2O会参与A中反应并产生大量氮气,降低产品产率。写出该过程中反应生成氮气的化学方程式:____________________________。 充分反应后,蒸馏A中溶液即可得到水合肼的粗产品。 实验3:测定馏分中水合肼的含量。 (5)称取馏分3.0 g,加入适量NaHCO3固体,加水配成250 mL溶液,移出25.00 mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.15 mol·L-1的碘的标准溶液滴定(滴定过程中,调节溶液的pH保持在6.5左右)。(已知:N2H4·H2O+2I2===N2↑+4HI+H2O) ①滴定时,碘的标准溶液盛放在________(填“酸式”或“碱式”)滴定管中。 ②下列能导致馏分中水合肼的含量测定结果偏高的是________(填标号)。 a.锥形瓶清洗干净后未干燥 b.滴定前,滴定管内无气泡,滴定后有气泡 c.读数时,滴定前平视,滴定后俯视 d.盛标准液的滴定管水洗后,直接装标准液 ③实验测得消耗碘的标准溶液的平均值为20. 00 mL,馏分中水合肼(N2H4·H2O)的质量分数为________。 [解析] (1)实验室用浓盐酸和二氧化锰共热制备氯气。(2)配制一定质量分数的氢氧化钠溶液,分三步:计算;称量(用托盘天平);溶解(用玻璃棒、量筒和烧杯)。(3) Cl2与NaOH的反应为放热反应,由已知信息知,温度过高,次氯酸钠易发生歧化反应,导致次氯酸钠含量降低,影响产品的产率,故应用冰水浴控制温度。(4)水合肼与次氯酸钠发生氧化还原反应生成氮气、氯化钠和水。(5)①碱式滴定管下部有一段橡胶管,橡胶中含碳碳双键,能与碘单质发生加成反应,所以,用酸式滴定管盛装碘的标准溶液。②锥形瓶作反应容器,残留蒸馏水不会影响实验,a项错误;滴定前滴定管内无气泡,滴定后有气泡,测得溶液体积偏小,结果偏低,b项错误;滴定管的0刻度在上部,俯视读数结果偏小,测定结果偏低,c项错误:如果没有用待装液润洗,则测得消耗碘的标准溶液的体积偏大,结果偏高,d项正确。③w(N2H4·H2O)= ×100%=25%。 [答案] (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2)ac (3)防止NaClO分解,影响水合肼的产率 (4)N2H4·H2O+2NaClO===N2↑+3H2O+2NaCl (5)①酸式 ②d ③25%查看更多