高考化学真题与模拟类编专题13元素及其化合物知识的综合应用
2018年高考试题 ,
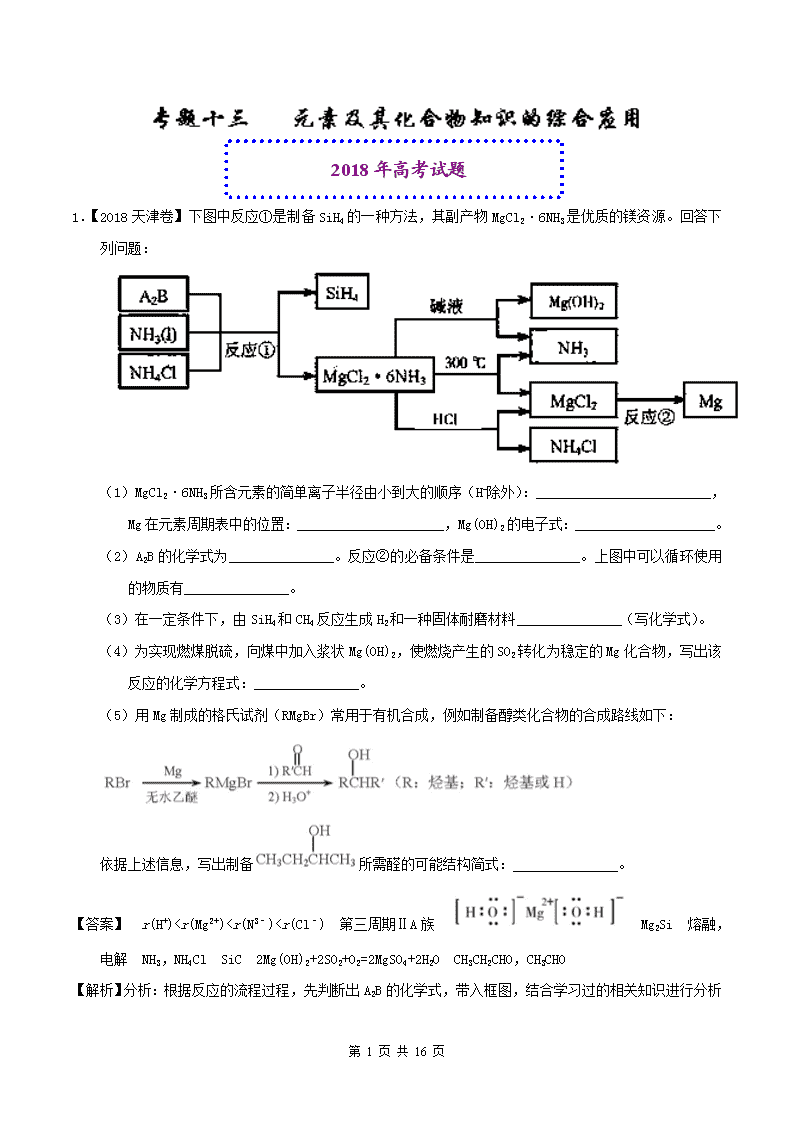
1.【2018天津卷】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
依据上述信息,写出制备所需醛的可能结构简式:_______________。
【答案】 r(H+)
7.0时,生成的沉淀为__________(填化学式);此时pH越大HAP对Pb(Ⅱ)平衡吸附量越小,其原因是__________。
【答案】 b 10Ca2++6HPO42-+8NH3·H2OCa10(PO4)6(OH)2↓+8NH4++6H2O 防止F-及其水解生成的HF与玻璃中SiO2反应 Ksp(HAP)/K10sp(CaF2) Pb2++OH-=Pb(OH)+ 溶液中c(H+)大,大量H+占据HAP 对Pb2+的吸附位,物理吸附能力减弱 Pb10(PO4)6(OH)2 和Pb(OH)2 c(H+)减小,会减少HAP 在溶液中的溶解量,便生成的c(PO43-)减小,溶解-沉淀吸附能力减弱且改变了吸附机理
第 16 页 共 16 页
5.【2018届红桥区二模】I.铁是生产、生活及生命中的重要元素。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生_____反 应(填“氧化”或“还原”)。
(2)现有一瓶放置了一段时间的某浓度的FeCl3溶液,请设计实验检验其中是否含有Fe3+_____。
(3)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。若一定量的普通铁粉和水蒸气在高温下反应生成44.8LH2 (已换算到标况下),则转移电子数目为_______;“引火铁” 是一种极细的铁粉,它在空气中可以自燃,其原因是_____________。
II.化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:
气体甲可使湿润红色石蕊试纸交蓝。请回答:
第 16 页 共 16 页
(1) M的化学式___________,气体甲的电子式__________。
(2)白色沉淀乙在空气中变成红褐色沉淀丙的原因是(用化学方程式表示)_______________。(3) 高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为______________。
【答案】 氧化 取少量待测液,滴加KSCN溶液,若溶液呈血红色,说明原溶液中有Fe3+,反之则没有 4NA 引火铁表而积很大,加快了与氧气反应速度 Fe4N 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe2O3 +2NH32Fe +N2 +3H2O
【解析】I.(1)NaNO2因具有氧化性能使血红蛋白丧失与O2结合能力,原因是氧化了血红蛋白中的二价铁,药品美蓝是其有效的解毒剂,这说明该物质具有还原性,因此解毒时美蓝发生氧化反应;正确答案:氧化。
(2)一般用硫氰化钾溶液检验铁离子,操作过程:取少量待测液,滴加KSCN溶液,若溶液呈血红色,说明原溶液中有Fe3+,反之则没有;正确答案:取少量待测液,滴加KSCN溶液,若溶液呈血红色,说明原溶液中有Fe3+,反之则没有。
(3)标况下44.8LH2,其物质的量为2mol,反应转移的电子数目为2×2×NA=4NA;引火铁表而积很大,加快了与氧气反应速度,因此在空气中可以自燃;正确答案:4NA ;引火铁表而积很大,加快了与氧气反应速度。
(2)白色沉淀乙是氢氧化亚铁,在空气中被氧气氧化为红褐色氢氧化铁,反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3;正确答案:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3) 高温条件下,氧化铁与氨气反应生成铁、氮气和水,该反应的化学方程式为:Fe2O3+2NH32Fe+N2+3H2O;正确答案:Fe2O3+2NH32Fe+N2+3H2O。
点睛:Fe(OH)2不稳定,易被氧气氧化为Fe(OH)3,所以Fe(OH)2在空气中迅速变为灰绿色,
第 16 页 共 16 页
最终变为红褐色,据此现象作为进行物质的推断的一个题眼。
6.【2018届南通市三模】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是一种重要的化工原料,可用于制取纳米Fe3O4和草酸合铁酸钾等。
(1)取一定质量摩尔盐样品与过量NaOH溶液反应。
①根据生成气体的体积计算得到摩尔盐的纯度小于实际值,其原因是______。
②向所得Fe(OH)2沉淀中加入NaNO2溶液可制得纳米Fe3O4,同时产生NO。该反应的离子方程式为______。
(2)摩尔盐经氧化后与KOH和H2C2O4反应可得到草酸合铁酸钾[KaFeb(C2O4)c·dH2O],其中Fe元素化合价为+3。
①已知25 ℃,H2C2O4的电离常数Ka1=5.6×10-2,Ka2=5.4×10-5。pH=4的H2C2O4溶液中c(C2O):c(HC2O)=______。
②为了确定草酸合铁酸钾的组成,准确称取4.910 g样品在氮气气氛下加热,固体样品的剩余质量随温度的变化如图所示。
已知:a.120℃时已完全失去结晶水。
b.200℃~580℃分解产生的CO和CO2恢复至标准状况下体积为1.008 L。
c.580℃以上残留固体为FeO和K2CO3的混合物。
根据以上实验数据计算草酸合铁酸钾中的n(Fe3+):n(C2O42-)_____________(写出计算过程)。
【答案】 氨气极易溶于水,溶液中有部分氨气没有逸出 3Fe(OH)2+ 2NO=Fe3O4+2NO↑+2OH—+2H2O 0.54 根据元素守恒得到分解产生的气体为CO和CO2,n(CO)+n(CO2)= =4.5×10-2 mol,2n(C2O42-)= n(K2CO3)+ n(CO)+n(CO2)= n(K2CO3)+ 4.5×10-2 mol,n(Fe3+)×72 g·mol-1+n(K+)×138 g·mol-1=2.79 g, 3n(Fe3+)+ n(K+)=2×[n(K+)+4.5×10-2 mol]×,解得:n(Fe3+)=1×10-2 mol n(K+)= 3×10-2 mol,n(C2O42-)=3×10-2 mol,n(Fe3+):n(C2O42-)=1×10-2 mol: 3×10-2 mol=1:3
【解析】(1)①摩尔盐[(NH4)2Fe(SO4)2·6H2O]
第 16 页 共 16 页
与氢氧化钠反应生成氨气,氨气极易溶于水,溶液中有部分氨气没有逸出,因此根据生成气体的体积计算得到摩尔盐的纯度小于实际值,故答案为:氨气极易溶于水,溶液中有部分氨气没有逸出;
②Fe(OH)2沉淀中加入NaNO2溶液可制得纳米Fe3O4,同时产生NO,反应的离子方程式为3Fe(OH)2+ 2NO2-=Fe3O4+2NO↑+2OH—+2H2O,故答案为:3Fe(OH)2+ 2NO2-=Fe3O4+2NO↑+2OH—+2H2O;
(2)①已知25 ℃,H2C2O4的电离常数Ka1=5.6×10-2,Ka2=5.4×10-5。pH=4的H2C2O4溶液中====0.54,故答案为:0.54;
7.【2018届宝山区二模】铝、铁是常见的两种金属,它们的单质及化合物在生活生产中处处可见。
(1)过量的铁和稀硝酸发生反应,产物是Fe(NO3)2和NO,写出该反应的化学方程式___________。
(2)实验室配制FeSO4溶液时,如果没有隔绝空气,FeSO4会被氧化为_______(填写化学式)。在该溶液中加入___________试剂,看到_____________________现象,证明溶液变质。
(3)KAl(SO4)2·12H2O俗称明矾,常用作净水剂,请述其原因并写出有关的离子方程式____________________。
(4)已知Ba(AlO2)2可溶于水,下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。
由图可知c点的沉淀是________(填化学式),已知a-b时存在的沉淀是Al(OH)3和BaSO4,两者的物质的量:________比________多。
第 16 页 共 16 页
【答案】 3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O Fe2(SO4)3 KSCN溶液 溶液变为血红色 明矾水解生成胶状Al(OH)3,它具有很强的吸附能力,可以吸附水中的杂质并沉降,使水澄清。Al3++3H2OAl(OH)3+3H+ BaSO4 BaSO4 Al(OH)3
点睛:本题考查学生离子之间的反应知识,结合图象知识来考查,增加了难度,熟悉每一段图中对应的化学反应是解答本题的关键,根据整个过程中离子之间的反应以及用量来确定沉淀的量的多少。
8.【2018届陕西省二模】亚硝酸钠(化学式为 NaNO2)是一种常用的防腐剂,回答下列问题:
(1)NaNO2 中 N 元素的化合价为_________.
(2)亚硝酸钠在 320°C 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。该反应的化学方程式_________________。
(3)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过 150 毫克,以此计算,200g 15%的亚硝酸钠溶液至少可用于生产火腿肠______千克。
(4)在酸性条件下,NaNO2与按物质的量 1:1 恰好完全反应,且I-被氧化为 I2时,产物中含氮的物质为________(填化学式)。
(5)工业废水中的 NaNO2 可用铝粉除去,已知此体系中包含 AI、NaAlO2、NaNO2、NaOH、NH3、H2O 六种物质。该反应的化学方程式为____________。
(6)某同学设计实验对工业产品中 NaNO2 的含量进行测定,你取固体样品 2g,完全溶解配制成溶液 100mL 取出 25mL 溶液用 0.100 mol/L 酸性 KMnO4 溶液进行滴定(杂质不与 KMnO4 反应),实验所得数据如下表所示:
滴定次数
1
2
3
4
消耗KMnO4
20.70
20.02
20.00
19.98
第 16 页 共 16 页
溶液体积/mL
该样品中亚硝酸钠的质量分数为_________.(已知:5NO2-+2MnO4-+6H+ = 5NO3-+2Mn2++3H2O)
【答案】 +3 4NaNO22Na2O+4NO↑+O2↑ 200 NO NaNO2+2Al+NaOH+H2O=2NaAlO2+NH3↑ 69%
【解析】(1)根据在化合物中正负化合价代数和为零,可设亚硝酸钠中氮元素的化合价为x,则:(+1)+x+(-2)×2=0,解得x=+3,故答案为:+3;
(2)因为亚硝酸钠在320℃时能分解产生氧化钠固体、一氧化氮气体和一种常见的助燃性气体,故反应的化学方程式为4NaNO22Na2O+4NO↑+O2↑;
(3)因为我国规定肉灌肠中亚硝酸钠添加标准为每千克食品含量不超过150毫克,所以200g、15%的亚硝酸钠溶液至少可用于生产肉灌肠的质量为 200g×15%÷═200kg,故答案为:200kg;
(6)消耗高锰酸钾的物质的量是0.1mol/L×0.02L=0.002mol,则根据方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可知,亚硝酸钠的物质的量是0.002mol×=0.005mol,则原样品中亚硝酸钠的物质的量是0.005mol×=0.02mol,其质量为0.02mol×69g/mol=1.38g,所以样品中亚硝酸钠的质量分数×100%=69.0%,故答案为:69.0%。
9.【2018届河北区第一次检测】A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。
请回答下列问题。
第 16 页 共 16 页
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,写出反应(Ⅲ)的化学方程式:_______________________。
(2)若D为氯碱工业的重要产品,A、B、C 为均含有同一种金属元素的无机化合物,反应(Ⅲ)的离子方程式为________________________。
(3)若B为非金属单质,且B 所含元素的原子最外层电子数与内层电子数之和的比值为3: 5,则反应(Ⅲ)中氧化产物与还原产物的物质的量之比为______,0.1mol A与含0.15molNaOH 的溶液充分反应后,溶液中所含离子浓度的大小关系为______。(已知: 常温下H2S 的电离平衡常数Ka1= 1.3×10-7 Ka2=7.1×10-15)
(4)若A、B、C 的溶液均显碱性,C 为焙制糕点的发酵粉的主要成分之一。
①A中所含化学键类型为________,D的电子式为_________
②25℃时,浓度均为0.1mol/L 的B、C 溶液,pH 较大的是______(填溶质的化学式)溶液,写出B 溶液中显电中性的原因:__________________(用B 溶液中有关粒子的浓度关系表示)
【答案】 4NH3+6NO=5N2+6H2O Al3++3AlO2-+6H2O=4Al(OH)3↓ 2:1 c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+) 离子键、共价键 Na2CO3 c(Na+)+ c(H+)=c(HCO3-)+2c(CO32-) +c(OH-)
(3) B 为非金属单质,所含元素的原子最外层电子数与内层电子数之和的比值为3: 5,可推知为S元素,则A为H2S,C为SO2,D为O2,反应(Ⅲ)的化学方程式为2H2S+ SO2=3S↓+ 2H2O,其中还原剂为H2S,生成的氧化产物为2S,氧化剂为SO2,生成的还原产物为S,所以氧化产物与还原产物的物质的量之比为2:1;0.1mol H2S与0.15molNaOH 充分反应后,溶液中的溶质为等物质的量的Na2S和NaHS,溶液中共有四个平衡体系:S2-+H2OHS-+OH-、HS-+H2OH2S+OH-、HS-H++S2-和H2OH++OH-,由于S2-的水解程度大于HS-的水解程度,且HS-的水解程度大于其电离程度,所以离子浓度的大小关系为c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+);
第 16 页 共 16 页
10.【2018届东北育才中学三模】近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
图1 图2
①在图示的转化中,被还原的元素是_______________,X的化学式为________________。
②钡元素在周期表中的位置是_________________。
(2)SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,写出发生反应的化学方程式:___________________。
(3)利用ClO2 氧化氮氧化物反应过程如下:NONO2N2
反应Ⅰ的化学方程式是2NO + ClO2 + H2O == NO2 + HNO3 + 2HCl,反应Ⅱ的离子方程式是______________。
(4)加入过量次氯酸钠可使废水中NH4+ 完全转化为N2,而本身被还原为NaCl。
①写出次氯酸钠的电子式_________________。
②检验废水中是否存在NH4+的方法是____________________________。
③若处理废水产生了0.448LN2(标准状况),则需消耗浓度为2mol·L-1的次氯酸钠的体积为_______________mL。
【答案】 N、O Ba(NO3)2 第六周期第IIA族 16NH3+12NO+6NO2=17N2+24H2O 2NO2+4SO32-=N2+4SO42-
第 16 页 共 16 页
取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口。若试纸变蓝,则A中生成NH4+ 30
点睛:本题的难点是氧化还原反应方程式的书写,如本题(2),生成无害物质,先写出NO+NO2+NH3→N2+H2O,参与反应NO和NO2物质的量之比为2:1,因此写成2NO+NO2+NH3→N2+H2O,根据化合价的升降法,进行配平。
第 16 页 共 16 页