- 2021-05-14 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学一轮复习 有机化合物章末质量检测
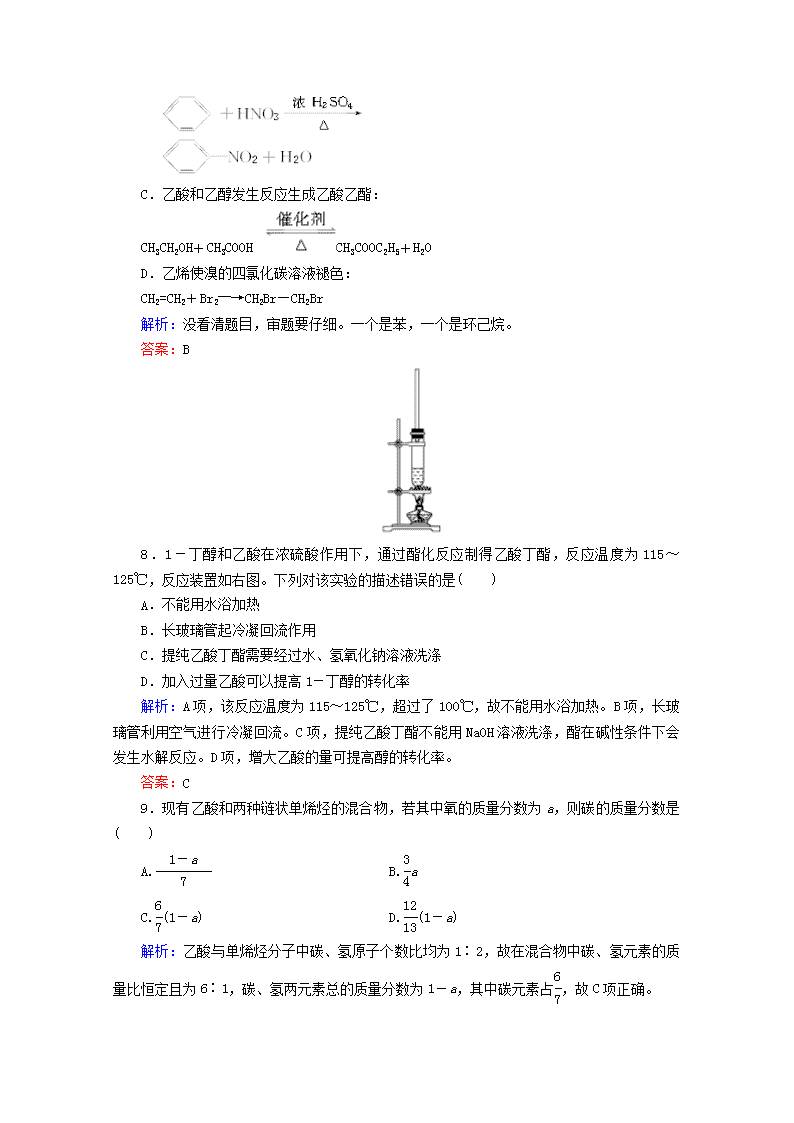
2012届高考化学一轮复习章末质量检测: 第十章 有机化合物 测试时间:90分钟 满分:100分 第Ⅰ卷(选择题,共48分) 一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意) 1.天然气的主要成分是甲烷,其分子式为CH4,下列四位同学在讨论分子式CH4的意义,其中错误的是( ) 解析:物质由元素组成,分子由原子组成。 答案:D 2.下列说法不正确的是( ) A.苯和乙烯都能与H2发生加成反应 B.蔗糖在人体内水解的产物只有葡萄糖 C. 食醋中含有乙酸,乙酸可由乙醇氧化得到 D.煤可与水蒸气反应制成水煤气,水煤气的主要成分为CO和H2 解析:蔗糖在人体内的水解产物为葡萄糖和果糖。 答案:B 3.下列关于有机物的叙述中正确的是( ) A.含碳量最高的烃类物质一定是苯 B.相对分子质量相同的不同物质一定是同分异构体 C.液化石油气和天然气的主要成分都是甲烷 D.油脂在碱的催化作用下可发生水解反应,工业上利用该反应生产肥皂 解析:苯与苯乙烯()都属于烃类物质,二者含碳量相等;甲酸与乙醇是相对分子质量相同的不同物质,但二者不是同分异构体;天然气的主要成分是甲烷,而液化石油气的成分是4个碳以下的气态烃。 答案:D 4.有机物的种类繁多,但其命名是有规则的。下列有机物命名正确的是( ) D.CH2Cl—CH2Cl 二氯乙烷 解析:A项,是己烷。B项,是3甲基1丁烯。D项,是1,2二氯乙烷。 答案:C 5.在通常条件下,下列各组物质的性质排列正确的是( ) A.熔点:CO2>KCl>SiO2 B.水溶性:HCl>H2S>SO2 C.沸点:乙烷>戊烷>丁烷 D.热稳定性:HF>H2O>NH3 解析:A项,SiO2是原子晶体,其熔点高于离子晶体KCl,KCl的熔点又高于分子晶体CO2。B项,SO2的水溶性大于H2S。C项,烷烃所含碳原子数越多,其沸点越高。D项,非金属性越强,其气态氢化物越稳定,非金属性的强弱顺序是:F>O>N,故热稳定性是:HF>H2O>NH3。故选D。 答案:D 6.(2011年原创卷八)下列关于有机物的说法正确的是( ) A.乙烷、乙烯和苯都能与溴水发生化学反应 B.乙酸乙酯、蛋白质和蔗糖在一定条件下都能水解 C.所有烷烃和蛋白质中都存在碳碳单键 D.纤维素和淀粉都是多糖,二者互为同分异构体 解析:乙烷和苯不能与溴水发生化学反应;甲烷分子中没有碳碳单键;纤维素和淀粉的相对分子质量和分子式均不同,不互为同分异构体。 答案:B 7.下列方程式书写错误的是( ) A.乙醇催化氧化制取乙醛: 2CH3CH2OH+O22CH3CHO+2H2O B.苯与浓硫酸、浓硝酸的混合液共热制硝基苯: C.乙酸和乙醇发生反应生成乙酸乙酯: CH3CH2OH+CH3COOH CH3COOC2H5+H2O D.乙烯使溴的四氯化碳溶液褪色: CH2=CH2+Br2―→CH2Br—CH2Br 解析:没看清题目,审题要仔细。一个是苯,一个是环己烷。 答案:B 8.1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图。下列对该实验的描述错误的是( ) A.不能用水浴加热 B.长玻璃管起冷凝回流作用 C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 D.加入过量乙酸可以提高1-丁醇的转化率 解析:A项,该反应温度为115~125℃,超过了100℃,故不能用水浴加热。B项,长玻璃管利用空气进行冷凝回流。C项,提纯乙酸丁酯不能用NaOH溶液洗涤,酯在碱性条件下会发生水解反应。D项,增大乙酸的量可提高醇的转化率。 答案:C 9.现有乙酸和两种链状单烯烃的混合物,若其中氧的质量分数为a,则碳的质量分数是( ) A. B.a C.(1-a) D.(1-a) 解析:乙酸与单烯烃分子中碳、氢原子个数比均为1∶2,故在混合物中碳、氢元素的质量比恒定且为6∶1,碳、氢两元素总的质量分数为1-a,其中碳元素占,故C项正确。 答案:C 10.酯类物质广泛存在于草莓、香蕉、梨等水果中,王彬同学从成熟的香蕉中分离出一种酯,然后将该酯在酸性条件下进行水解,得到分子式为C2H4O2和C4H10O的两种物质。下列有关判断正确的是( ) A.该同学分离出的酯的分子式可表示为C6H14O3 B.水解得到的两种物质中,C2H4O2能与金属钠反应产生氢气,而C4H10O不能 C.C4H10O的同分异构体有很多种,其中属于醇类的只有四种 D.水解得到的物质C2H4O2和葡萄糖的最简式相同,所以两者的化学性质相似 答案:C 11.(2010年山东威海统考)下列叙述中,正确的是( ) A.将乙烯通入溴水中,溴水褪色,是因为发生了加成反应 B.除去苯中少量乙醇,加浓硫酸、乙酸加热,通过发生酯化反应而除去乙醇 C.变质的油脂有特殊难闻的气味,是由于油脂发生了水解反应 D.高分子材料、盐酸、水煤气、沼气、石油等是混合物,而C5H12一定是纯净物 解析:除去苯中的乙醇应该加入水后分液,B项错;油脂变质的原因是分子中的碳碳双键被氧化的缘故,C项错;C5H12存在三种同分异构体,D项错。 答案:A 12.(2009年台湾高考)食品中的蛋白质含量,可由测定其氮元素的含量来间接推算。台湾在97年9月间发生的[毒奶]风波,系不肖厂商在奶粉中添加三聚氰胺(分子式C3H6N6、分子量126 g/mol),以造成蛋白质含量较高的假象所导致。假设正常奶粉中的蛋白质,其平均含氮量约16.6%,则三聚氰胺的含氮量约为正常奶粉中蛋白质平均含氮量的几倍( ) A.2 B.3 C.4 D.5 E.6 解析:三聚氰胺中含氮量:×100%=66.7%。三聚氰胺与蛋白质含氮量的比值:=4。 答案:C 13.下列实验操作与实验目的不相符的是( ) 选项 实验操作 实验目的 A 向醋酸溶液中加入少量石灰石固体 验证醋酸与碳酸的酸性强弱 B 在淀粉溶液中加入20%的稀H2SO4水解后,立即加入银氨溶液做银镜反应实验 验证淀粉水解是否有葡萄糖生成 C 在CuSO4溶液中加入过量NaOH溶液振荡,立即加入某同学尿液并加热 验证该同学是否患有糖尿病 D 在乙醇溶液中插入一根灼热变黑的铜丝 验证乙醇是否被氧化成醛 答案:B 14.我国有部分城市已开始使用乙醇汽油,目前工业制乙醇的主要方法为:石油。某制糖厂以甘蔗为原料制得蔗糖,并对甘蔗渣进行综合处理制得乙醇,主要生产流程如下: 酒化酶, 下列说法中不正确的是( ) A.工业上可利用乙烯与水在催化剂的作用下发生加成反应来制取乙醇 B.蔗糖的分子式为C12H22O11,B的结构简式为 C.B转化为乙醇的化学方程式为 D.上述过程中,理论上0.1 mol A可制得9.2 g乙醇 答案:D 15.被誉为中国“新四大发明”之一的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品。其主要成分是青蒿素(一种从青蒿中分离得到的具有新型化学结构的抗疟药),其结构简式如下图所示。下列有关该有机物的叙述正确的是( ) A.该有机物的分子式为C16H22O5 B.该有机物不能与NaOH溶液反应 C.该有机物分子中含有过氧键,一定条件下具有氧化性 D.该有机物易溶于水 答案:C 16.有两种饱和一元醇的混合物2.293 g,与1.75 g Na充分反应,生成的氢气在标准状况下的体积为560 mL,这两种醇分子中相差一个碳原子。则这两种醇是( ) A.甲醇和乙醇 B.乙醇和丙醇 C.丙醇和丁醇 D.无法判断 解析:(1)判断过量物:n(H2)==0.025 mol。 2R—OH + 2Na―→2R—ONa+ H2↑ 0.05 mol 0.05 mol 0.025 mol m(Na)=0.05 mol×23 g·mol-1=1.15 g。现有Na 1.75 g,1.15 g<1.75 g,所以Na过量。 (2)混合醇的平均摩尔质量==45.86 g·mol-1两种饱和一元醇的相对分子质量必定有一种大于45.86,另一种小于45.86,可知其中必定含有甲醇(在饱和一元醇中,只有CH3OH的相对分子质量小于45.86),则另一种醇就是乙醇(两种醇分子中相差一个碳原子)。 答案:A 第Ⅱ卷(非选择题,共52分) 二、(本题包括3小题,共24分) 17.(5分)下列各组物质①O2和O3 ②1H、2H和3H ③12C和14C ④CH3CH2CH2CH3和(CH3)2CHCH3 ⑤乙烷和丁烷 ⑥CH3CH2CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)C2H5 根据题意填空(只填序号),互为同系物的是________,互为同分异构体的是________,互为同位素的是________,互为同素异形体的是________,是同一物质的是________。 答案:⑤ ④ ②③ ① ⑥ 18.(9分)根据烷烃、烯烃、炔烃燃烧的反应式,有人总结出以下规律,对于烷烃有n(烷烃)=n(H2O)-n(CO2),对于烯烃有n(烯烃)=n(H2O)-n(CO2)=0,对于炔烃有n(炔烃)=n(CO2)-n(H2O)。请回答下列问题: (1)C2H6和C2H4混合气体1.0 L在氧气中充分燃烧生成2.0 L CO2和2.4 L水蒸气(相同条件下),则混合气体中C2H6与C2H4的体积比是________。 (2)某混合气体由烯烃、烷烃或炔烃组成,组成中为两种气体,将1.0 L混合气体在氧气中充分燃烧,产生3.0 L CO2和3.7 L水蒸气(相同状况下测定)。 ①判断混合气体由________和________组成; ②上述判断的理由是________________________________________________________________________ ________(简要的文字说明); ③上述两类烃的体积比为________。 解析:因为相同条件下体积之比等于物质的量之比,所以V烷烃=VH2O-VCO2,V烯烃=VH2O-VCO2=0,V炔烃=VCO2-VH2O。(1)VH2O-VCO2=2.4 L-2.0 L=0.4 L,所以C2H6为0.4 L,C2H4为0.6 L,C2H6与C2H4的体积比是2∶3;(2)VH2O-VCO2=3.7 L-3.0 L=0.7 L,故混合气体中一定有烷烃,若为烷烃、烯烃混合物,则V烷烃=0.7 L,V烯烃=0.3 L,二者体积比为7∶3,若为烷烃、炔烃混合物,二者体积比为17∶3。因为VH2O>VCO2,故不为烯烃、炔烃的混合物。 答案:(1)2∶3 (2)①烷烃、烯烃或炔烃 ②因为相同条件下体积之比等于物质的量之比,所以V烷烃=VH2O-VCO2,V烯烃=VH2O-VCO2=0,而V炔烃=VCO2-VH2O,又因为VH2O>VCO2,故混合气体由烷烃和烯烃或烷烃和炔烃组成 ③7∶3或17∶3 19.(10分)(一)糖类、油脂、蛋白质都是人体必需的营养物质。 (1)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和________(写名称),进而被氧化成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。 (2)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(—NH2)和________(写名称)。人体中共有二十多种氨基酸,其中人体自身________(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。 (3)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化成二氧化碳和水。写出葡萄糖在体内被氧化的化学方程式:________________________________________________________________________。 (二)《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯()是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下: (1)C的结构简式为_____________________________________________________。 (2)写出反应①的化学方程式: _____________________________________________。 (3)反应③的反应类型为__________________________________________________。 (4)反应________(填序号)原子的理论利用率为100%,符合绿色化学的要求。 解析:(一)(1)油脂是高级脂肪酸和丙三醇(俗名甘油)生成的酯类物质。(2)氨基酸有两种官能团(氨基和羧基),有的氨基酸在人体内不能合成,只能通过饮食获得,这类氨基酸就是人体必需的氨基酸。 (二)图示转化关系是较为典型的烃的衍生物转化关系,注意甲苯光照氯代是烃基上的取代反应。 答案:(一)(1)甘油 (2)羧基 不能 (3)C6H12O6+6O2―→6CO2+6H2O (二) (2)2CH3CH2OH+O22CH3CHO+2H2O (3)酯化(或取代)反应 (4)② 三、(本题包括2小题,共21分) 20.(9分)生活中有很多现象都蕴藏着化学秘密,如果你是一个细心的人,就一定会发现很多有趣的事。 (1)煤气灯曾是十八世纪的主要照明工具,但有一个奇怪的事引起了不少人的注意,那就是在有些煤气灯的附近,树叶比其他树要早落好长时间,但这个问题一直到1901年才由俄国的植物学家奈刘波夫证实是煤气灯产生的一种气体在作怪,你认为这种气体可能是________。 (2)为了证明你的判断,下列是一位同学做的实验及其装置: 如果实验时无水硫酸铜变蓝色,澄清的石灰水变浑浊;你认为通过以上实验可以得出的结论是________。 (3)若要进一步得出该分子的组成,下列是另一个同学的实验及其装置: 要达到实验的目的,需要下列哪些数据________。 ①此气体的质量 ②浓硫酸的增重 ③硬质玻璃管的增重 ④干燥管的增重 ⑤此气体的体积(标准状况下的) (4)将这种气体在高温高压条件下与苯甲醛按一定比例混合,结果发现苯甲醛的质量和性质都没有发生变化,且还得到了一种白色固体。试推测苯甲醛的作用是________。得到的白色固体是________,发生的反应是________。 解析:(1)乙烯具有催熟作用,可以使果子早熟、树叶早落、花儿早谢。而煤气灯周围的树叶早落可能是煤气灯产生了乙烯。 (2)装置中有两个主要仪器,一个是干燥管,其中盛放的是无水硫酸铜,如果燃烧产物通过时无水硫酸铜变蓝,则说明产物中有水,也就是说明原来的气体中含有氢元素;然后再通过另一个仪器,试管中盛有澄清的石灰水,当气体通过时,如果变浑浊,说明产物中含有二氧化碳气体,进一步说明原气体中含有碳元素。所以通过此实验可以说明碳元素和氢元素的存在,但没有定量关系,还不能说明两种原子的个数比,更不能说明每个分子中的原子个数,也不能说明是不是含有氧元素。 (3)这一问是一个定量问题,要想得出每个分子中的原子个数,显然是通过浓硫酸的增重得出氢元素的质量,然后根据碱石灰的增重得出碳元素的质量,总质量减去二者的质量和可得出该分子中是不是含有氧元素;但这样只能得出分子中的两种原子的个数比,还不能得出具体的一个分子中的原子个数,而如果已知此气体的物质的量或者标准状况下的体积,就可得出了。干燥管的作用是防止空气中的水蒸气进入硬质玻璃管中,而影响碳元素含量的测定。 (4)从题意可知,发生了化学反应,而且苯甲醛的质量和性质都没有发生改变,说明苯甲醛作催化剂;一开始是气体而在高温高压下变成了固体,一定是生成了相对分子质量很大的物体,根据乙烯中含有双键,应是大量的乙烯分子聚合在一起,形成了高分子化合物。 答案:(1)乙烯 (2)此物质中一定含有碳氢两种元素 (3)①②③⑤ (4)催化作用 聚乙烯 加聚反应 21.(12分)某化学小组采用类似制乙酸乙酯的装置(下图),用环己醇制备环己烯: 已知: 密度 (g·cm-3) 熔点(℃) 沸点(℃) 溶解性 环己醇 0.96 25 161 能溶于水 环己烯 0.81 -103 83 难溶于水 (1)制备粗品:将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。 ①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是________。 ②试管C置于冰水浴中的目的是________。 (2)制备精品:①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。 a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液 ②再将环己烯按下图装置蒸馏,冷却水从________口进入。蒸馏时加入生石灰,目的是________。 ③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________。 a.蒸馏时从70℃开始收集产品 b.环己醇实际用量多了 c.制备粗品时环己醇随产品一起蒸出 (3)以下区分环己烯精品和粗品的方法,合理的是________。 a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点 解析:(1)由于环己烯沸点较低,容易挥发,为防止逸出,因此采用冰水冷却。 (2)①环己醇和环己烯密度均小于水;为了洗涤其中的环己醇和酸性杂质,选用能中和酸的Na2CO3溶液;KMnO4溶液可把环己烯氧化。 ②冷却水与气体逆流冷凝效果好;发生CaO+H2O===Ca(OH)2反应,防止水随环己烯一起逸出而被收集。 ③比理论产量低是由于损失了环己醇,与开始的用量无关。a项得到的质量会高于环己烯的实际产量。 (3)根据官能团特性,在主要考虑醇羟基的性质,选b;由于其中环己醇含量很少,用测沸点的方法不可行。 答案:(1)①防止暴沸 冷凝回流 ②使生成的环己烯变为液体,防止挥发 (2)①上 c ②g 吸收生成的水,防止水蒸气随环己烯一起蒸出 ③83℃ c (3)b 四、(本题包括1小题,共7分) 22.(7分)生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有黑色CuO粉末的硬质玻璃管,发生氧化还原反应。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g,且玻璃管中有红色固体物质生成。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5 g。 (1)写出甲烷与氧化铜反应的化学方程式:____________________________________。 (2)原混合气体中甲烷的物质的量是________。 (3)原混合气体中氮气的体积分数为多少?(写出计算过程) 解析:(1)甲烷作为还原性气体,将铜从氧化铜中还原出来,另外该反应的产物还有二氧化碳与水蒸气。 (2)由反应方程式可知,玻璃管中减少的质量即反应的氧化铜中氧的质量,而甲烷与氧化铜反应的量的关系为CH4~4CuO,反应的氧化铜的物质的量为:=0.3 mol,故甲烷的物质的量为=0.075 mol。 答案:(1) (2)0.075 mol (3)碳酸钙沉淀的物质的量为:=0.085 mol。 由碳元素守恒可知混合气体中二氧化碳的物质的量 =0.085 mol-0.075 mol=0.01 mol,所以原混合气体中氮气的体积分数为: × 100%≈5.56%。查看更多