- 2021-05-13 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学实验知识必备
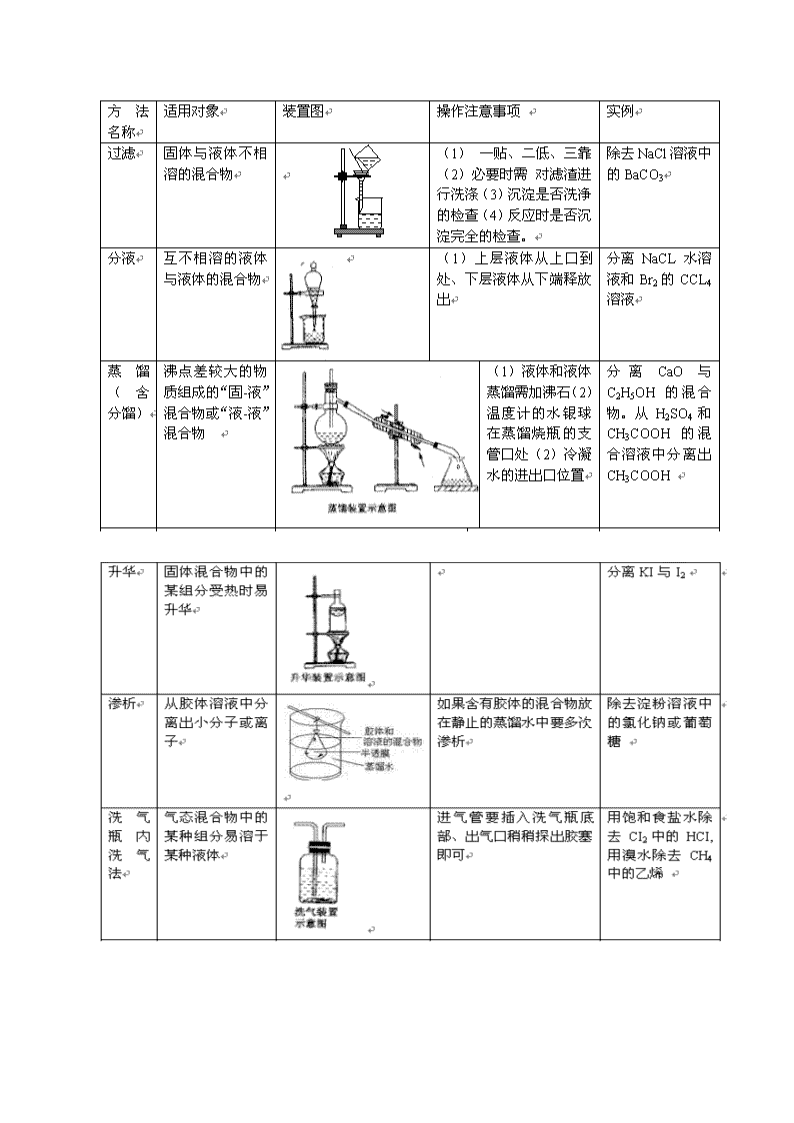
高考化学实验知识必备 一、基本操作 1、仪器洗涤 (1)内有油脂的试管 NaOH溶液 或洗衣粉或汽油 (2)附有银镜的试管 HNO3溶液 (3)还原CuO后的试管 硝酸 (4)粘有硫磺、白磷、碘的试管 CS2 (5)久置KMnO4溶液的试剂瓶 浓盐酸 (6)熔化硫的试管 NaOH溶液或CS2 (7)久置石灰水的试剂瓶 盐酸 (8)熔化苯酚的试管 酒精或NaOH溶液 (9)盛放乙酸乙酯的试管 NaOH溶 酒精(10)做过Cl—,Br—检验的试管 氨水 2、试纸的使用 红色石蕊试纸 测试碱性试剂或气体 蓝色石蕊试纸 测试酸性试剂或气体 KI淀粉试纸 测试氧化性气体 PH试纸 测试溶液酸碱性 使用方法:检验溶液 取试纸放在表面皿上,玻棒蘸取液体,沾在试纸中心,观察颜色的变化,判断溶液的性质。 注意:使用PH试纸不能用蒸馏水润湿。 3、各种装置的气密性检查方法归纳 (1)、基本方法: ①受热法:将装置只留下1个出口,并先将该出口的导管插入水中,后采用微热(手捂、热毛巾捂、酒精灯微热等),使装置内的气体膨胀。观察插入水中的导管是否有气泡。停止微热后,导管是否出现水柱。 ②压水法:如启普发生器气密性检查 ③吹气法 (2)、基本步骤: ①形成封闭出口 ②采用加热法、水压法、吹气法等进行检查 ③观察气泡、水柱等现象得出结论。 注:若连接的仪器很多,应分段检查。 二、混合物分离、提纯常用的方法: 按实验操作方法分类,将有关常用方法及其适应对象列表如下 Ⅱ.常见物质除杂方法 序号 原物 所含杂质 除杂质试剂 主要操作方法 1 N2 O2 灼热的铜丝网 用固体转化气体 2 CO2 H2S CuSO4溶液 洗气 3 CO CO2 NaOH溶液 洗气 4 CO2 CO 灼热CuO 用固体转化气体 5 CO2 HCI 饱和的NaHCO3 洗气 6 H2S HCI 饱和的NaHS 洗气 7 SO2 HCI 饱和的NaHSO3 洗气 8 CI2 HCI 饱和的食盐水 洗气 9 CO2 SO2 饱和的NaHCO3 洗气 10 炭粉 MnO2 浓盐酸(需加热) 过滤 11 MnO2 C -------- 加热灼烧 12 炭粉 CuO 稀酸(如稀盐酸) 过滤 13 AI2O3 Fe2O3 NaOH(过量),CO2 过滤 14 Fe2O3 AI2O3 NaOH溶液 过滤 15 AI2O3 SiO2 盐酸`氨水 过滤 16 SiO2 ZnO HCI溶液 过滤, 17 BaSO4 BaCO3 HCI或稀H2SO4 过滤 18 NaHCO3溶液 Na2CO3 CO2 加酸转化法 19 NaCI溶液 NaHCO3 HCI 加酸转化法 20 FeCI3溶液 FeCI2 CI2 加氧化剂转化法 21 FeCI3溶液 CuCI2 Fe 、CI2 过滤 22 FeCI2溶液 FeCI3 Fe 加还原剂转化法 23 CuO Fe (磁铁) 吸附 24 Fe(OH)3胶体 FeCI3 蒸馏水 渗析 25 CuS FeS 稀盐酸 过滤 三、气体的制备 1、气体实验装置的设计 (4)装置气密性的检验 【见专题】 3、净化、干燥与反应装置 ( 常用的气体干燥剂按酸碱性可分为三类: ①酸性干燥剂,如浓硫酸、五氧化二磷、硅胶。酸性干燥剂能够干燥显酸性或中性的气体,如CO2、SO2、NO2、HCI、H2、Cl2 、O2、CH4等气体。 ②碱性干燥剂,如生石灰、碱石灰、固体NaOH。碱性干燥剂可以用来干燥显碱性或中性的气体,如NH3、H2、O2、CH4等气体。 ③中性干燥剂,如无水氯化钙等,可以干燥中性、酸性气体,如O2、H2、CH4等。 在选用干燥剂时,显碱性的气体不能选用酸性干燥剂,显酸性的气体不能选用碱性干燥剂。有还原性的气体不能选用有氧化性的干燥剂。能与气体反应的物质不能选作干燥剂,如不能用CaCI2来干燥NH3(因生成 CaCl2·8NH3),不能用浓 H2SO4干燥 NH3、H2S、HBr、HI等。 法,将它转化为CO2气体。 4、收集装置 5、尾气处理装置-安全装置 防止倒吸装置的设计 (3)防污染安全装置:燃烧处理或袋装 三、检验 离子的检验 离子 试剂 现象 注意 沉淀法 Cl-、Br-、I-、 AgNO3+HNO3 AgCl↓白、AgBr↓淡黄、AgI↓黄 SO42- 稀HCl和BaCl2 白色沉淀 须先用HCl酸化 Fe2+ NaOH溶液 白色沉淀→灰绿色→红褐色沉淀 Fe3+ NaOH溶液 红褐色沉淀 Al3+ NaOH溶液 白色沉淀→溶解 不一定是Al3+ 气体法 NH4+ 浓NaOH溶液和湿润的红色石蕊试纸 产生刺激性气体,使试纸变蓝 要加热 CO32- 稀盐酸+石灰水 石灰水变浑浊 SO32-也有此现象 SO32- 稀H2SO4和品红溶液 品红溶液褪色 显色法 I- Cl2水(少量),CCl4 下层为紫色 Fe2+ KSCN溶液,再滴Cl2水 先是无变化,滴Cl2水后变红色 Fe3+ ①KSCN溶液 红色 ②苯酚溶液 紫色 Na+、K+ Pt丝+HCl 火焰为黄色、浅紫色 K+要透过蓝色钴玻璃片查看更多