- 2021-05-13 发布 |
- 37.5 KB |
- 2页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考电化学方程式汇总
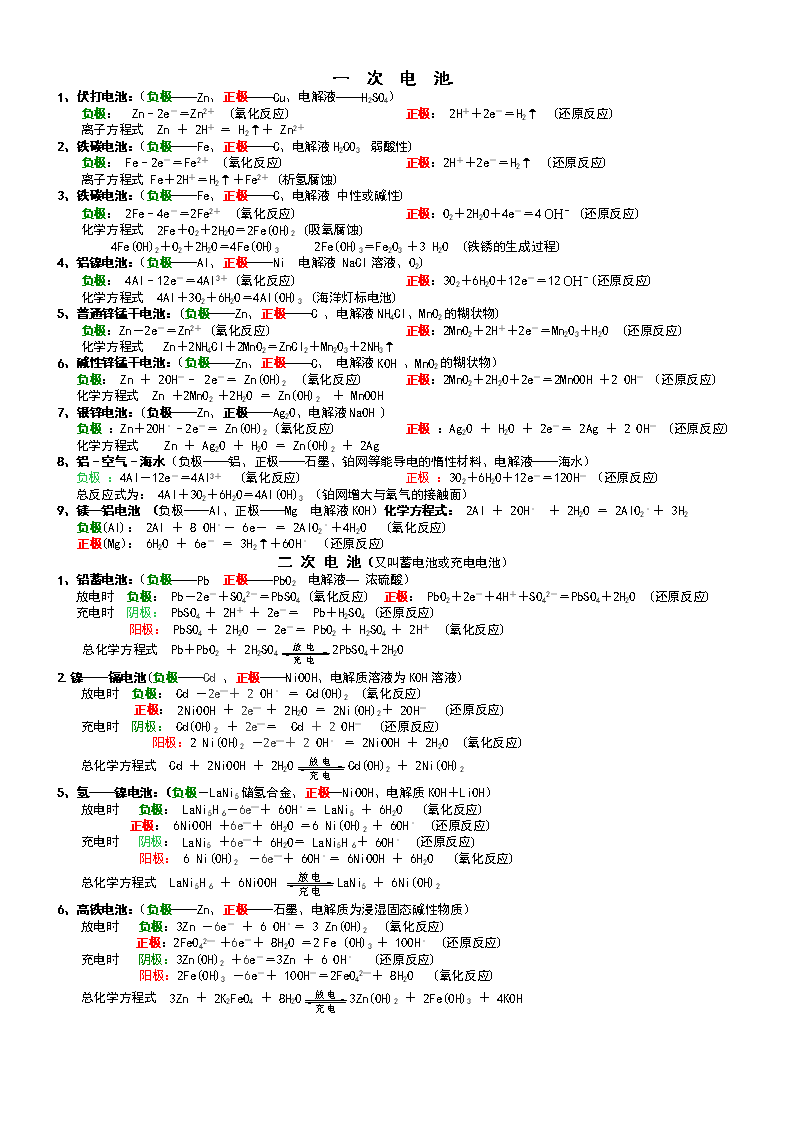
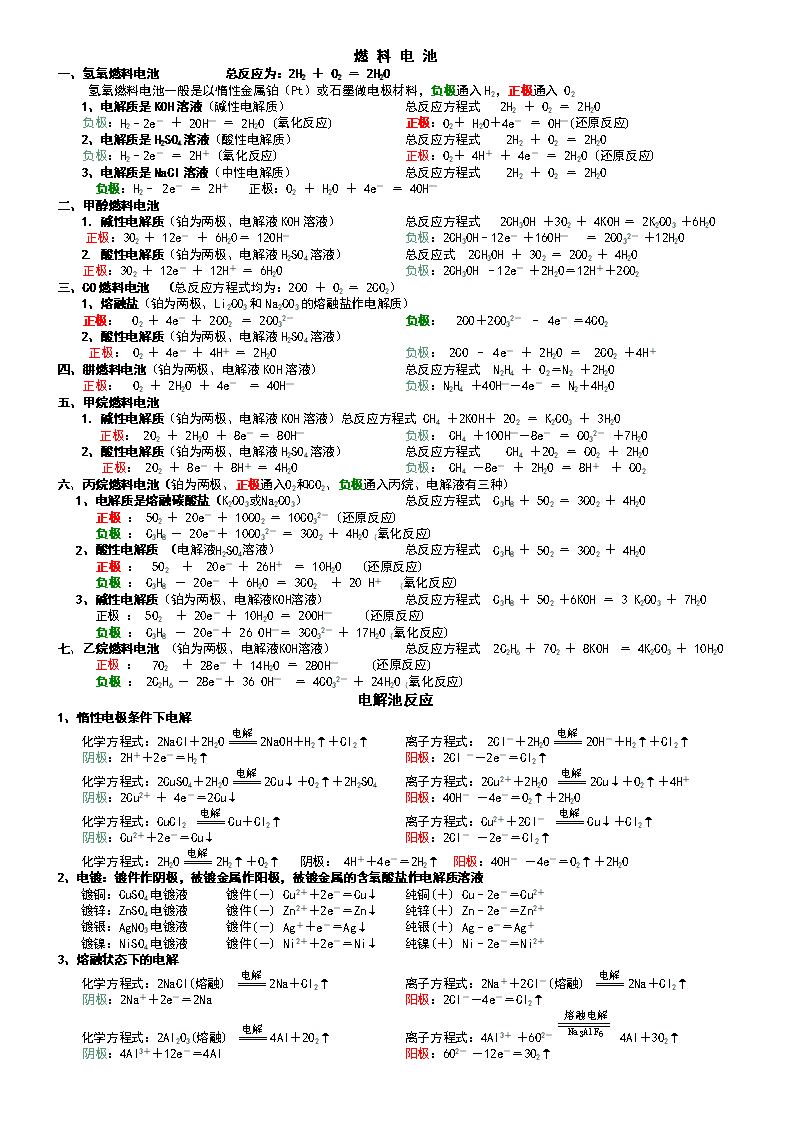
一 次 电 池. 1、伏打电池:(负极——Zn、正极——Cu、电解液——H2SO4) 负极: Zn–2e-=Zn2+ (氧化反应) 正极: 2H++2e-=H2↑ (还原反应) 离子方程式 Zn + 2H+ = H2↑+ Zn2+ 2、铁碳电池:(负极——Fe、正极——C、电解液H2CO3 弱酸性) 负极: Fe–2e-=Fe2+ (氧化反应) 正极:2H++2e-=H2↑ (还原反应) 离子方程式 Fe+2H+=H2↑+Fe2+ (析氢腐蚀) 3、铁碳电池:(负极——Fe、正极——C、电解液 中性或碱性) 负极: 2Fe–4e-=2Fe2+ (氧化反应) 正极:O2+2H2O+4e-=4 (还原反应) 化学方程式 2Fe+O2+2H2O=2Fe(OH)2 (吸氧腐蚀) 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe(OH)3=Fe2O3 +3 H2O (铁锈的生成过程) 4、铝镍电池:(负极——Al、正极——Ni 电解液 NaCl溶液、O2) 负极: 4Al–12e-=4Al3+ (氧化反应) 正极:3O2+6H2O+12e-=12(还原反应) 化学方程式 4Al+3O2+6H2O=4Al(OH)3 (海洋灯标电池) 5、普通锌锰干电池:(负极——Zn、正极——C 、电解液NH4Cl、MnO2的糊状物) 负极:Zn-2e-=Zn2+ (氧化反应) 正极:2MnO2+2H++2e-=Mn2O3+H2O (还原反应) 化学方程式 Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3↑ 6、碱性锌锰干电池:(负极——Zn、正极——C、 电解液KOH 、MnO2的糊状物) 负极: Zn + 2OH-– 2e-= Zn(OH)2 (氧化反应) 正极:2MnO2+2H2O+2e-=2MnOOH +2 OH- (还原反应) 化学方程式 Zn +2MnO2 +2H2O = Zn(OH)2 + MnOOH 7、银锌电池:(负极——Zn、正极——Ag2O、电解液NaOH ) 负极 :Zn+2OH––2e-= Zn(OH)2 (氧化反应) 正极 :Ag2O + H2O + 2e-= 2Ag + 2 OH- (还原反应) 化学方程式 Zn + Ag2O + H2O = Zn(OH)2 + 2Ag 8、铝–空气–海水(负极——铝、正极——石墨、铂网等能导电的惰性材料、电解液——海水) 负极 :4Al-12e-=4Al3+ (氧化反应) 正极 :3O2+6H2O+12e-=12OH- (还原反应) 总反应式为: 4Al+3O2+6H2O=4Al(OH)3 (铂网增大与氧气的接触面) 9、镁—铝电池 (负极——Al、正极——Mg 电解液KOH)化学方程式: 2Al + 2OH– + 2H2O = 2AlO2–+ 3H2 负极(Al): 2Al + 8 OH–- 6e- = 2AlO2–+4H2O (氧化反应) 正极(Mg): 6H2O + 6e- = 3H2↑+6OH– (还原反应) 二 次 电 池(又叫蓄电池或充电电池) 1、铅蓄电池:(负极——Pb 正极——PbO2 电解液— 浓硫酸) 放电时 负极: Pb-2e-+SO42-=PbSO4 (氧化反应) 正极: PbO2+2e-+4H++SO42-=PbSO4+2H2O (还原反应) 充电时 阴极: PbSO4 + 2H+ + 2e-= Pb+H2SO4 (还原反应) 阳极: PbSO4 + 2H2O - 2e-= PbO2 + H2SO4 + 2H+ (氧化反应) 总化学方程式 Pb+PbO2 + 2H2SO42PbSO4+2H2O 2.镍——镉电池(负极——Cd 、正极——NiOOH、电解质溶液为KOH溶液) 放电时 负极: Cd -2e—+ 2 OH– = Cd(OH)2 (氧化反应) 正极: 2NiOOH + 2e— + 2H2O = 2Ni(OH)2+ 2OH- (还原反应) 充电时 阴极: Cd(OH)2 + 2e—= Cd + 2 OH- (还原反应) 阳极:2 Ni(OH)2 -2e—+ 2 OH– = 2NiOOH + 2H2O (氧化反应) 总化学方程式 Cd + 2NiOOH + 2H2OCd(OH)2 + 2Ni(OH)2 5、氢——镍电池:(负极-LaNi5储氢合金、正极—NiOOH、电解质KOH+LiOH) 放电时 负极: LaNi5H 6-6e—+ 6OH–= LaNi5 + 6H2O (氧化反应) 正极: 6NiOOH +6e—+ 6H2O =6 Ni(OH)2 + 6OH– (还原反应) 充电时 阴极: LaNi5 +6e—+ 6H2O= LaNi5H 6+ 6OH– (还原反应) 阳极: 6 Ni(OH)2 -6e—+ 6OH–= 6NiOOH + 6H2O (氧化反应) 总化学方程式 LaNi5H 6 + 6NiOOH LaNi5 + 6Ni(OH)2 6、高铁电池:(负极——Zn、正极——石墨、电解质为浸湿固态碱性物质) 放电时 负极:3Zn -6e- + 6 OH–= 3 Zn(OH)2 (氧化反应) 正极:2FeO42— +6e-+ 8H2O =2 Fe (OH)3 + 10OH– (还原反应) 充电时 阴极:3Zn(OH)2 +6e-=3Zn + 6 OH– (还原反应) 阳极:2Fe(OH)3 -6e-+ 10OH-=2FeO42—+ 8H2O (氧化反应) 总化学方程式 3Zn + 2K2FeO4 + 8H2O3Zn(OH)2 + 2Fe(OH)3 + 4KOH 燃 料 电 池 一、氢氧燃料电池 总反应为:2H2 + O2 = 2H2O 氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,负极通入H2,正极通入 O2 1、电解质是KOH溶液(碱性电解质) 总反应方程式 2H2 + O2 = 2H2O 负极:H2–2e- + 2OH— = 2H2O (氧化反应) 正极:O2+ H2O+4e- = OH—(还原反应) 2、电解质是H2SO4溶液(酸性电解质) 总反应方程式 2H2 + O2 = 2H2O 负极:H2–2e- = 2H+ (氧化反应) 正极:O2+ 4H+ + 4e- = 2H2O (还原反应) 3、电解质是NaCl溶液(中性电解质) 总反应方程式 2H2 + O2 = 2H2O 负极:H2– 2e- = 2H+ 正极:O2 + H2O + 4e- = 4OH— 二、甲醇燃料电池 1.碱性电解质(铂为两极、电解液KOH溶液) 总反应方程式 2CH3OH +3O2 + 4KOH = 2K2CO3 +6H2O 正极:3O2 + 12e- + 6H20= 12OH- 负极:2CH3OH–12e- +16OH— = 2CO32- +12H2O 2. 酸性电解质(铂为两极、电解液H2SO4溶液) 总反应式 2CH3OH + 3O2 = 2CO2 + 4H2O 正极:3O2 + 12e- + 12H+ = 6H2O 负极:2CH3OH –12e- +2H2O=12H++2CO2 三、CO燃料电池 (总反应方程式均为:2CO + O2 = 2CO2) 1、熔融盐(铂为两极、Li2CO3和Na2CO3的熔融盐作电解质) 正极: O2 + 4e- + 2CO2 = 2CO32- 负极: 2CO+2CO32- – 4e- =4CO2 2、酸性电解质(铂为两极、电解液H2SO4溶液) 正极: O2 + 4e- + 4H+ = 2H2O 负极: 2CO – 4e- + 2H2O = 2CO2 +4H+ 四、肼燃料电池(铂为两极、电解液KOH溶液) 总反应方程式 N2H4 + O2=N2 +2H2O 正极: O2 + 2H2O + 4e- = 4OH— 负极:N2H4 +4OH—-4e- = N2+4H2O 五、甲烷燃料电池 1.碱性电解质(铂为两极、电解液KOH溶液)总反应方程式 CH4 +2KOH+ 2O2 = K2CO3 + 3H2O 正极: 2O2 + 2H2O + 8e- = 8OH— 负极: CH4 +10OH—-8e- = CO32- +7H2O 2、酸性电解质(铂为两极、电解液H2SO4溶液) 总反应方程式 CH4 +2O2 = CO2 + 2H2O 正极: 2O2 + 8e- + 8H+ = 4H2O 负极: CH4 -8e- + 2H2O = 8H+ + CO2 六、丙烷燃料电池(铂为两极、正极通入O2和CO2、负极通入丙烷、电解液有三种) 1、电解质是熔融碳酸盐(K2CO3或Na2CO3) 总反应方程式 C3H8 + 5O2 = 3CO2 + 4H2O 正极 : 5O2 + 20e- + 10CO2 = 10CO32- (还原反应) 负极 : C3H8 - 20e-+ 10CO32- = 3CO2 + 4H2O (氧化反应) 2、酸性电解质 (电解液H2SO4溶液) 总反应方程式 C3H8 + 5O2 = 3CO2 + 4H2O 正极 : 5O2 + 20e- + 26H+ = 10H2O (还原反应) 负极 : C3H8 - 20e- + 6H2O = 3CO2 + 20 H+ (氧化反应) 3、碱性电解质(铂为两极、电解液KOH溶液) 总反应方程式 C3H8 + 5O2 +6KOH = 3 K2CO3 + 7H2O 正极 : 5O2 + 20e- + 10H2O = 20OH— (还原反应) 负极 : C3H8 - 20e-+ 26 OH—= 3CO32- + 17H2O (氧化反应) 七、乙烷燃料电池 (铂为两极、电解液KOH溶液) 总反应方程式 2C2H6 + 7O2 + 8KOH = 4K2CO3 + 10H2O 正极 : 7O2 + 28e- + 14H2O = 28OH— (还原反应) 负极 : 2C2H6 - 28e-+ 36 OH— = 4CO32- + 24H2O (氧化反应) 电解池反应 1、惰性电极条件下电解 化学方程式:2NaCl+2H2O2NaOH+H2↑+Cl2↑ 离子方程式: 2Cl-+2H2O2OH-+H2↑+Cl2↑ 阴极:2H++2e-=H2↑ 阳极:2Cl --2e-=Cl2↑ 化学方程式:2CuSO4+2H2O2Cu↓+O2↑+2H2SO4 离子方程式:2Cu2++2H2O 2Cu↓+O2↑+4H+ 阴极:2Cu2+ + 4e-=2Cu↓ 阳极:4OH- -4e-=O2↑+2H2O 化学方程式:CuCl2 Cu+Cl2↑ 离子方程式:Cu2++2Cl- Cu↓+Cl2↑ 阴极:Cu2++2e-=Cu↓ 阳极:2Cl- -2e-=Cl2↑ 化学方程式:2H2O2H2↑+O2↑ 阴极: 4H++4e-=2H2↑ 阳极:4OH- -4e-=O2↑+2H2O 2、电镀:镀件作阴极,被镀金属作阳极,被镀金属的含氧酸盐作电解质溶液 镀铜:CuSO4电镀液 镀件(-) Cu2++2e-=Cu↓ 纯铜(+) Cu–2e-=Cu2+ 镀锌:ZnSO4电镀液 镀件(-) Zn2++2e-=Zn↓ 纯锌(+) Zn–2e-=Zn2+ 镀银:AgNO3电镀液 镀件(-) Ag++e-=Ag↓ 纯银(+) Ag–e-=Ag+ 镀镍:NiSO4电镀液 镀件(-) Ni2++2e-=Ni↓ 纯镍(+) Ni–2e-=Ni2+ 3、熔融状态下的电解 化学方程式:2NaCl(熔融) 2Na+Cl2↑ 离子方程式:2Na++2Cl-(熔融) 2Na+Cl2↑ 阴极:2Na++2e-=2Na 阳极:2Cl--4e-=Cl2↑ 化学方程式:2Al2O3(熔融) 4Al+2O2↑ 离子方程式:4Al3+ +6O2- 4Al+3O2↑ 阴极:4Al3++12e-=4Al 阳极:6O2- -12e-=3O2↑查看更多