- 2021-05-13 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学专题突破78微粒构成物质化学式和化合价
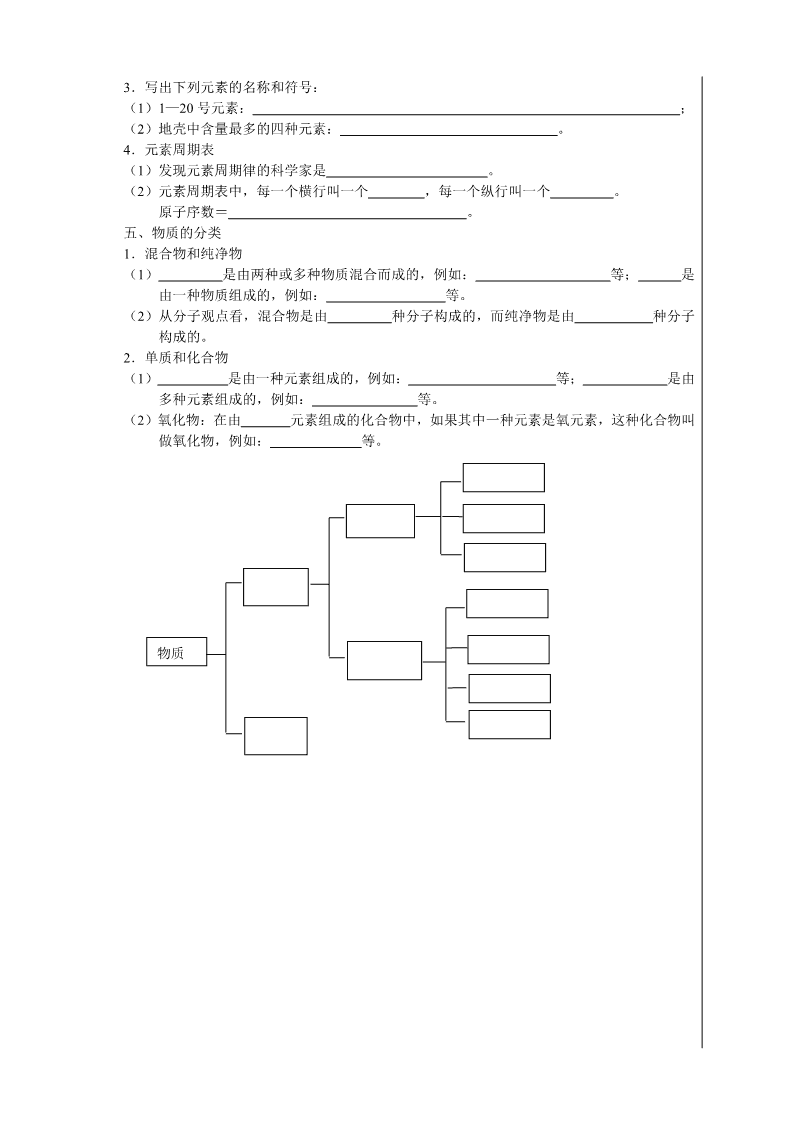
第二部分 基本概念和理论 专题七 微粒构成物质 一、物质的微粒性 1. 的创立奠定了控化学的基础。提出原子论的科 学家是 ,提出分子学说的科学家是 。 2.物质是由 、 、 等微小粒子构成的。 3.微粒的特征: (1)质量和体积都很 ; (2)不停的 (温度越高, ); (3)粒子间有 。 二、原子的构成 1.原子结构 原子是由居于原子中心带 电的 和核外带 电的 构成的。 原子核是由 和 构成的。 整个原子 电性,在原子中,核电荷数= = 。 2.相对原子质量(Ar) (1)国际上规定:以 为标准,其它原子的质量跟它相 所 得的值,就是该种原子的相对原子质量。若某原子的实际质量为 a kg,标准碳原子的质量 为 b kg,则该原子的相对原子质量为 。 (2)相对原子质量≈ + 。 4.核外电子的排布 (1)规律:第一层最多容纳 个电子,第二层最多容纳 个电子;最外层电子 数最多不超过 个(第一层为最外层时,不超过 个)。如氯的原子结构示意 图 。 (2)原子结构与元素性质的关系 ① 元素的原子最外层电子数为 (He 为 ),化学性质稳定; ② 元素的原子最外层电子数一般小于 4,在化学变化中容易 电子; ③ 元素的原子最外层电子数一般大于或等于 4,在化学变化中容易 电子。 三、分子、原子、离子的相互转化 1.分子是保持物质 性质的最小粒子,同种分子的化学性质 ,不同分子的 化学性质 。 2.原子是化学变化中的 粒子。化学变化的过程是 ; 在化学变化中, 可以再分, 不可再分。 3.离子是 的原子或原子团,阳离子带 电,阴离子带 电。 4.分子是由 构成的;原子得电子形成 ,原子失电子形成 ,写出硫 离子的离子结构示意图 。 5.由分子构成的物质有 ,由原子直接构成的物质 有 ,由离子构成的物质有 。物 质由什么粒子构成,就由什么粒子保持它的 性质。 四、元素 1.元素是具有相同 (即 )的一类原子的总称。 2.元素与原子的区别在于:元素是描述物质的_______组成的,只讲_______,不讲_______; 原子是描述物质的_______构成的,既讲_______,又讲_______。 3.写出下列元素的名称和符号: (1)1—20 号元素: ; (2)地壳中含量最多的四种元素: 。 4.元素周期表 (1)发现元素周期律的科学家是 。 (2)元素周期表中,每一个横行叫一个 ,每一个纵行叫一个 。 原子序数= 。 五、物质的分类 1.混合物和纯净物 (1) 是由两种或多种物质混合而成的,例如: 等; 是 由一种物质组成的,例如: 等。 (2)从分子观点看,混合物是由 种分子构成的,而纯净物是由 种分子 构成的。 2.单质和化合物 (1) 是由一种元素组成的,例如: 等; 是由 多种元素组成的,例如: 等。 (2)氧化物:在由 元素组成的化合物中,如果其中一种元素是氧元素,这种化合物叫 做氧化物,例如: 等。 物质 学习笔记 A 组 1. 吸烟有害健康。在公共场所,非吸烟者会因少数吸烟者吸烟造成被动吸烟,这是因为( ) A.分子很小 B.分子之间有间隔 C.分子在不断运动 D.分子是可分的 2.某同学为探究分子的特性,设计了如下四个实验,其中主要说明分子在不断运动的是( ) A.100mL 酒精和 100mL 水混合在一起体积小于 200mL B.品红放入水中,整杯水逐渐变红 C.在过氧化氢溶液中加入二氧化锰后得到了氧气 D.两支分别盛有相同体积空气和水的注射器,前者比后者容易压缩 3.常温下,容积为 35.5L 的液化石油气罐能装下几百升的石油气,合理的解释是( ) A.分子在不断运动 B.分子间有间隔 C.分子可以分成原子 D.分子保持物质化学性质 4.能说明分子在化学变化中可分这一事实的是( ) A.打开盛有浓盐酸的瓶子,瓶口出现白雾 B.无色酚酞试液滴在烧碱溶液中显红色 C.冷却热的饱和 KNO3 溶液,有 KNO3 晶体析出 D.加热红色 HgO 粉末,放出气体,同时试管内壁附着一层银白色物质 5.决定元素种类的是( ) A.质子数 B.中子数 C.电子数 D.最外层电子数 6.北京奥运住房场馆------鸟巢,使用了一种含镓(Ga)的新型复合材料,镓原子的核外电子 数为 31。下列有关镓元素的各种说法中正确的是( ) A.镓是一种非金属元素 B.镓原子的相对原子质量为 31 C.镓原子的中子数为 31 D.镓原子的质子数为 31 7.元素周期表是学习化学的重要工具,右图是元素周期表中的一格,从该图中,我们获取的 相关信息中错误的是( ) A.该元素的名称是镁 B.该元素的原子序数是 12 C.该元素的原子结构示意图为 D.该元素在地壳中的含量为 24.31% 8.1982 年发现了第 109 号化学元素,1997 年将其命名为 Meitnerium,1998 年中国命名为麦, 其元素符号书写正确的是( ) A.MT B.mt C.mT D.Mt 9.石油没有固定的沸点,加热石油使不同沸点的组成分别汽化、冷凝,分离后能得到汽油.煤 油.柴油等产品,由此可以判断石油属于( ) A.化合物 B.混合物 C.单质 D.纯净物 10.下列各组物质按照单质、氧化物、混合物的顺序排列的是( ) A.氮气、氧气、空气 B.石墨、熟石灰、生石灰 C.水银、水、糖水 D.冰、干冰、冰醋酸 11.“垃圾是放错了位置的资源”,应该分类回收。生活中废弃的铁锅.铝制品.铜导线可以归 为一类加一回收,它们属于( ) A.氧化物 B.碱 C.盐 D.金属或合金 12.下列物质中一定属于氧化物的是( ) A.含有氧元素的化合物 B.能分解出氧气的化合物 C.氧气跟某种物质反应的生成物 D.由氧元素和另一种元素组成的化合物 13.下列物质中,不属于有机物的是( ) 12Mg 镁 24.31 +12 2 8 2 A.糖类 B.蛋白质 C.二氧化碳 D.甲烷 14.碳元素(C)与氧元素(O)最本质的区别是( ) A.中子数不同 B.核电荷数不同 C.电子层数不同 D.相对原子质量不同 15.由种类相同的元素组成的一组物质是( ) A.冰和干冰 B.银和水银 C.烧碱和纯碱 D.水和双氧水 16.从图中水分子分解示意图中获得以下信息,其中不正确的是 A.水是由氢元素和氧元素组成 B.化学反应前后元素的种类不变 C.在化学变化中,分子可分原子也可分 D.1 个水分子由 2 个氢原子和 1 个氧原子构成 17.现有三种粒子结构示意图: 下列有关说法中正确的是( ) A.它们表示同一种元素 B.它们都是具有相对稳定结构的原子 C.它们都带有电荷 D.它们的核外电子数相同 18.科学家发现了新的氢微粒,它是由 3 个氢原子核(只含质子)和 2 个电子构成。下列说法 正确的是( ) A.该微粒不显电性 B.该微粒比一个普通 H2 分子多一个氢原子核 C.该微粒的组成可用 H3 表示 D.该微粒的相对原子质量比一个普通 H2 分子多 3 19.雄伟壮观的国家大剧院主体建筑表面安装了近 2 万块钛(Ti)金属板。已知 Ti 原子核内有 22 个质子,则下列叙述正确的是 A.Ti 可以表示一个钛原子 B.Ti4+核外有 26 个电子 C.TiO2 中含有氧分子 D.CaTiO3 属于金属氧化物 20.填写下表中的空格: 编号 元素名称 元素符号 质子数 中子数 电子数 相对原子质量 A 氧 8 8 B C 6 6 C Ca 20 40 D 铁 30 26 上面表格中属于金属元素的是_____________,地壳中含量最多的元素是__________。 21.由分子构成的物质在发生化学变化时,首先是分子分解成___________,然后分解成的 ___________重新组合成其他物质的分子或直接构成其他物质,因此___________是化学变 化中的最小粒子,分子是由___________构成的。 22.运用以下分子的基本性质填空(将序号填在相应的括号内)。 ①分子之间有间隔 ②分子的体积和质量很小 ③分子在不断地运动 ④同种物质的分子性质相同,不同种物质的分子性质不同 ⑴湿衣服晒一段时间后变干( ) ⑵25m3 的石油气在加压的情况下可装入容积为 0.24m3 的钢瓶中( ) ⑶一滴水中大约有 1.67×1021 个水分子( ) ⑷墙内开花墙外香( ) ⑸有的物质能与氧气反应,有的物质不能与氧气反应( ) B 组 1.下列物质中,只由一种分子构成的是( ) A.白糖水 B.空气 C.水蒸气 D.人呼出的气体 2.下列关于原子的说法中不正确的是( ) A.是构成物质的一种粒子 B.在原子里,质子数不一定等于中子数 C.在化学变化中可以再分 D.同类原子的质子数一定相等 3.下列关于微观粒子的说法中,正确的是( ) A.原子是由分子构成的 B.原子中一般含有质子、中子和核外电子 C.原子若失去最外层电子,则会变成阴离子 D.原子若得到核外电子,则会变成阳离子 4.原子不显电性的原因是( ) A.原子是化学变化中不可再分的粒子 B.原子中没有带电粒子 C.原子中质子数与中子数相等 D.原子中核电荷数等于核外电子总数 5.朝核问题引发了国际关注,核问题的关键是核能的如何利用。已知某种核原料的原子核中 含有 1 个质子和 2 个中子,则下列说法中正确的是( ) A.该原子是一种氢原子 B.该原子的相对原子质量为 2 C.该原子核外有 3 个电子 D.该原子核带 2 个单位的正电荷 6.我国著名化学家张青莲教授与另一位科学家合作,测定了铟元素的相对原子质量新值。铟 原子的核电荷数为 49,相对原子质量为 115。铟原子的核外电子数为( ) A.115 B.49 C.66 D.164 7.某原子的实际质量是一种碳原子(原子核内有 6 个质子和 6 个中子,且其相对原子质量为 12)实际质量的 2 倍,则该原子的相对原子质量是( ) A.2 B.12 C.24 D.36 8.下图表示物质中所含分子的示意图,图中“ ”和“ ”分别表示不同的原子,则图中 表示单质的是( ) A B C D 9.下列实例中,不能证明在化学变化中分子可以再分,而原子不能再分的是( ) A.湿衣服晒干了 B.通电分解水 C.磷单质在氧气中燃烧 D.氢气在氧气中燃烧 10.下列粒子中不能直接构成物质的是( ) A.原子 B.分子 C.离子 D.电子 11.下列叙述中正确的是( ) A.由不同种元素组成的物质一定是化合物 B.由同种元素组成的物质一定是单质 C.物质可以由分子、原子或离子构成 D.含有氧元素的化合物一定是氧化物 12.下列关于分子、原子、离子的说法中,正确的是( ) A.纯净的氢气在氧气中完全燃烧后,生成的物质是由一种粒子构成的 B.铜离子(Cu2+)是蓝色的 C.原子是微小的实心体,可以再分 D.气态物质的分子肉眼看不见,液态物质的分子肉眼看得见 13.与 n 个硫酸分子所含的氧原子个数相等的是( ) A.2n 个二氧化碳分子 B.2n 个水分子 C.4n 个氧气分子 D.4n 个二氧化硫分子 14.法国里昂的科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人 称之为“零号元素”。它与天体中的中子星构成类似。有关该粒子的说法不正确的是 ( ) A.不显电性 B.相当于一个氦(He)原子的质量 C.失去一个中子后显+1 价 D.在周期表中与氢元素占同一位置 15.我国最近又启动了“酱油加铁”工程。这里的铁是指( ) A.分子 B.原子 C.单质 D.元素 16.元素之间最本质的区别在于( ) A.质子数不同 B.核外电子数不同 C.电子层数不同 D.最外层电子数不同 17.下列说法中,正确的是( ) A.任何纯净物都是由一种元素组成的 B.任何物质都是由分子组成的 C.一种单质只能由一种元素组成 D.水是由氢分子和氧原子组成的 18.在水通电后产生氧气和氢气的反应中,反应前后发生改变的是( ) A.元素种类 B.原子种类 C.分子种类 D.各原子的相对原子质量 19.经分析,某种物质只含有一种元素,则该物质不可能是( ) A.混合物 B.化合物 C.纯净物 D.单质 20.下列说法中,正确的是( ) A.同种元素的原子质量相等 B.同种元素的粒子所含电子数相等 C.同种元素的原子核内质子数相同 D.同种元素的原子核内中子数相同 21.物质世界丰富多彩,下列几类物质属于纯净物的是( ) A.溶液 B.化石燃料 C.合金 D.氧化物 22.水是生命之源,以下生活中的“水”属于纯净物的是( ) A.矿泉水 B.食盐水 C.自来水 D.蒸馏水 23.下列物质属于纯净物的是( ) A.洁净的空气 B.氯化钠溶液蒸发后剩余的固体 C.不锈钢 D.加热高锰酸钾反应后的剩余物 24.根据组成元素的类别,对下列氧化物分类,其中一种与另外三种不属于同一类别,它是 A.MnO2 B.Cu2O C.P2O5 D.Fe3O4 25.科学家发现半胱氨酸(一种氨基酸)能增强艾滋病毒感染者的免疫能力,半胱氨酸的化学 式为 C3H7NSO2。下列说法正确的是( ) A.半胱氨酸属于无机物 B.半胱氨酸属于氧化物 C.半胱氨酸属于化合物 D.半胱氨酸由 15 个原子组成 26.在①MgO、CuO、Fe3O4、SO2 ②C、Fe、S、O2 ③ZnCl2、BaCO3、HCl、Na2SO4 三组物 质中,各有一种物质在分类上与组内的其他物质不同,这三种物质分别是( ) A.CuO、Fe、ZnCl2 B.SO2 、Fe、HCl C.Fe3O4、C、BaCO3 D.SO2、O2 、Na2SO4 27.构建和谐社会,建设社会主义新农村的目标之一是让农民饮用清洁的自来水。自来水消毒 过程中常会发生甲、乙化学反应,其反应的微观过程可用下图表示: 下列说法正确的是( ) A.物质 D 属于氧化物 B.物质 C 的水溶液 pH 大于 7 C.甲是复分懈反应 D.实验室可用 H2O2 和 MnO2 制取 E 28.已知碘元素(元素符号为 I)的原子结构示意图如右图,请回答下列问题: (1)x 的值为___________。 (2)一般情况下,最外层电子数相同的原子,具有相似的化学性质。 下列元素的化学性质与碘元素的化学性质最相似的是________。 29.在分子、原子、质子、中子、电子等粒子中,找出符合下列条件的粒子,填在相应的空格 内。 (1)化学变化中的最小粒子是__________。 (2)带正电荷的是__________。 (3)在同一原子中数目相等的是___________。 (4)质量最小的是_________。 30.元素的化学性质主要与原子的___________有关;化学变化中不能再分的粒子是_______; 干冰是__________(填“纯净物”或“混合物”);C60 分子是由________构成;用数字和 元素符号表示 3 个氧分子_________;硝酸镁的化学式为_________;FeS 的名称是 ________;过氧化钠(Na2O2)中氧元素的化合价是________。 31. 已知元素周期表中第三周期各元素原子结构示意图如图所示,请回答: (1)在化学反应中,钠元素的原子容易失去电子变成_______(填“阴”或“阳”)离子; (2)元素的化学性质与原子结构中的__________数关系密切; (3)从原子结构方面看:同一周期的元素具有相同的________数; (4)在此周期中,各元素的原子结构呈现的变化规律是:__________________________ __________依次递增。 32. A、B、C 三种元素,A 元素的单质是最清洁的燃料;B 元素的单质能在 C 元素的单质中 剧烈燃烧,火星四射,生成黑色固体;B 元素的单质是目前世界上年产量最高的金属。写 出 A、B、C 三种元素的名称或符号:A_______、B_______、C_______;写出由 B、C 两 种元素组成的一种化合物的化学式:_____________ 。 33.在下表的空格内写出相应的物质名称或化学式,并指出物质的类别(单质、氧化物、酸、 碱、盐): 物质名称 钾 氯化镁 硫酸 化学式 Cu(OH) 2 FeCl3 物质类别 +11 2 8 1 Na +12 2 8 2 Mg +13 2 8 3 Al +14 2 8 4 Si +15 2 8 5 P +18 2 8 8 Ar +16 2 8 6 S +17 2 8 7 Cl +x 2 8 18 18 7 CBA +16 2 8 6+7 2 5 +17 2 8 7 +18 2 8 8 D 专题八 化学式和化合价 一、化合价 1.一种元素一定数目的原子跟其它元素一定数目的原子相化合的性质叫做 。 2.规律 (1)化合物中元素正负化合价的代数和为 。 (2)单质中元素的化合价为 。 (3)金属元素跟非金属元素化合时,金属元素显 价,非金属元素显 价。 3.常见元素的化合价: H、K、Na、Ag、 Ca、Ba、Mg、Zn、 Al、Fe、Cu、 O、Cl(氯化物中)、S(硫化物中) 4.常见原子团的化合价 氢氧根 硝酸根 碳酸根 硫酸根 铵 根 二、化学式 1.用元素符号表示物质组成的式子叫 。 2.说出下列化学式的意义: H 2H H2 2H2 He 2Mg2+ NaCl A 组 1.今年 1 月份的雪灾对我国南方的电力.交通造成很大的危害。有一种融雪剂含有 Na2SiO3(硅 酸钠),Na2SiO3 中 Si 元素的化合价是( ) A.+1 价 B.+2 价 C.+3 价 D.+4 价 2.航天飞船常用铝粉与高氯酸铵(NH4ClO4)的混合物作为固体燃料,高氯酸铵中 Cl 元素 的化合价为 A.+1 B.+3 C.+5 D.+7 3.诺贝尔奖获得者丁肇中的著名实验中,曾用到我国研制的一种闪烁晶体材料 BGO(化学式为 Bi4Ge3O12),其中铋(Bi)元素为+3 价,则锗(Ge)元素为( ) A.+1 价 B.+2 价 C.+3 价 D.+4 价 4.硫的某氧化物中,氧元素的质量分数为 60%,则该氧化物中硫元素的化合价为 A.-2 B.+2 C.+4 D.+6 5.电脑硬盘的盘面表面涂覆一层δ—Fe2O3 磁粉。δ—Fe2O3 中铁元素的化合价的为( ) A.0 B +1 C +2 D+3 6.(07 常州)Y2BaCu6O10 是一种高温超导材料。该化合物中,Y.Ba.O 三种元素的化合价依 次为+3、+2、-2 价,则铜元素的化合价为 A.0 价 B.+1 价 C.+2 价 D.+3 价 7.法国里昂的科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称 之为“零号元素”。它与天体中的中子星构成类似。有关该粒子的说法不正确的是 A.不显电性 B.相当于一个氦(He-4)原子的质量 C.失去一个中子后显+1 价 D.由于没有质子而被称为“零号元素” 8.下列物质的化学式的读法和写法都正确的是 A.碳酸钠 NaCO3 B.硫酸 H2SO4 C.氧化铁 O3Fe2 D.氢氧化钾 K(OH)2 9.以下符号书写正确的是 A.一个二氧化碳分子:CO2 B.两个氮分子:2N2 C.三个氢原子:H3 D.正二价的镁元素:Mg2+ 10.化学科学常需要借助化学专用语言来描述,下列化学用语与其含义相符的是 A. 3N ----3 个氮元素 B. O2 ----氧气 C. Al ----铝离子 D. P----1 个氟原子 11.下列物质的名称、俗名与化学式完全对应的是 A.氯化钠 食盐 NaCl2 B.碳酸氢钠 纯碱 NaHCO3 C.氢氧化钙 熟石灰 CaO D.氢氧化钠 火碱 NaOH 12.参考下列物质的微观结构图示,其中由阴,阳离子构成的物质是 A.铜 B.干冰 C.氯化钠 D.金刚石 13.(2009.临沂市)请用元素符号或化学式表示 (1)干冰__________ (2)天然气的主要成分__________ (3)乙醇__________ (4)3 个二氧化氮分子__________ (5)2 个磷原子__________ 14.根据要求填空。 (1)用数字和化学符号表示:2 个氧原子 ,3 个钠离子 。 (2)镁的原子结构示意图为 ,Mg 原子在化学反应中容易 (填“得到”或“失去”) 个电子。 15.氯元素常见的化合价有-1、+1、+3、+5、十 7,下面五种物质都是含氯元素的酸: HC1O4(高氯酸)、______(氯酸)、HC1O2(亚氯酸)、HC1O(次氯酸)、______(氢氯酸) 16.请写出含有氮元素的常见单质、氧化物、酸、碱和盐的化学式各 1 个。 、 、 、 、 。 B 组 1.下列是小明课堂笔记中记录的有关化学用语,其中准确无误的是 A.氦的元素符号:Ha B.2 个碳酸根离子:2CO3 C.氧化铝的化学式:Al2O3 D.镁在空气中燃烧:Mg+O2= MgO2 2.化学用语是国际通用的化学语言,下列有关说法正确的是 A.2O 表示两个氧分子 B.钠离子的符号为 Na+ C.一氧化碳的化学式是 Co D.H2O 中含有氧分子 3.下列物质名称与其化学式相符合的是 A.氢气(H) B.碳酸钠(NaCO3) C.氢氧化铁[Fe(OH)2] D.五氧化二磷(P2O5) 4.一种新型高效净水剂 PAFC(聚合氯化铁铝,化学式为[AlFe(OH)nCl6-n]m),是以工业生 产废料为原料制取的,广泛应用于工业污水的处理。该净水剂中铁元素的化合价( ) A. 0 B. +2 C. +3 D.+6 5.已知碳化硅中碳元素显-4 价,硅元素显+4 价,则碳化硅的化学式为 A.SiC B.Si2C3 C.Si3C2 D.SiC2 6.今年,甲型 H1N1 流感病毒在许多国家发生,治疗该病毒的有效药物达菲是从八角茴香中 经过多道复杂工艺提炼出来的,它的有效成分是莽草酸,化学式为 C7H10O5、对莽草酸的下 列说法错误的是 A.莽草酸是有机化合物 B.莽草酸由碳、氢氧三种元素组成 C.莽草酸的相对分子质量为 174 D 莽草酸中含有 7 个碳原子、10 个氢原子和 5 个氧原子 7.氢气不仅可以在空气中燃烧,还可以在氯气中燃烧,反应方程式为 H2+Cl2 点燃 ===2HCl ,若用 “○”表示氯原子,“●”表示氢原子,则上述反应可表示为( ) 8.下列化学用语与含义相符的是 A.2O—2 个氧元素 B.P2O5 — 五氧化二磷 C.H2—2 个氢原子 D.Ca—钙离子 9.关于 SO2、CO2、MnO2 三种物质,下列说法错误的是 A.都含有氧元素 B.都是化合物 C.都是氧化物 D.都含有氧分子 10.下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是 A.O B.Zn C.N2 D.CO 11.手机中使用的锂(Li)电池是新型的高能电池,某种锂电池的总反应可表示为 Li+MnO2 =LiMnO2。此反应中锂元素的化合价变化为 0→+1,下列对锰元素的化合价变化判断正 确的是( ) A. +4→+3 B. +2→+3 C. 0→+2 D. -4→-2 12. 从 K、C、S、H、O、N 六种元素中选择适当的元素按要求填空。 (1)用适当的数字和符号填空: ①三个钾离子________;②一个碳酸根离子________;③双氧水中氧显-1 价________。 (2)写出符合下列要求的物质的化学式: ①能灭火的气体是________; ②充入食品包装袋中可防腐的单质是_________; ③可作复合肥料的是_________; ④能形成硫酸型酸雨的空气污染物是_________; ⑤溶于水使溶液温度显著降低的是__________。查看更多