- 2021-05-10 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考常见化学方程式总结
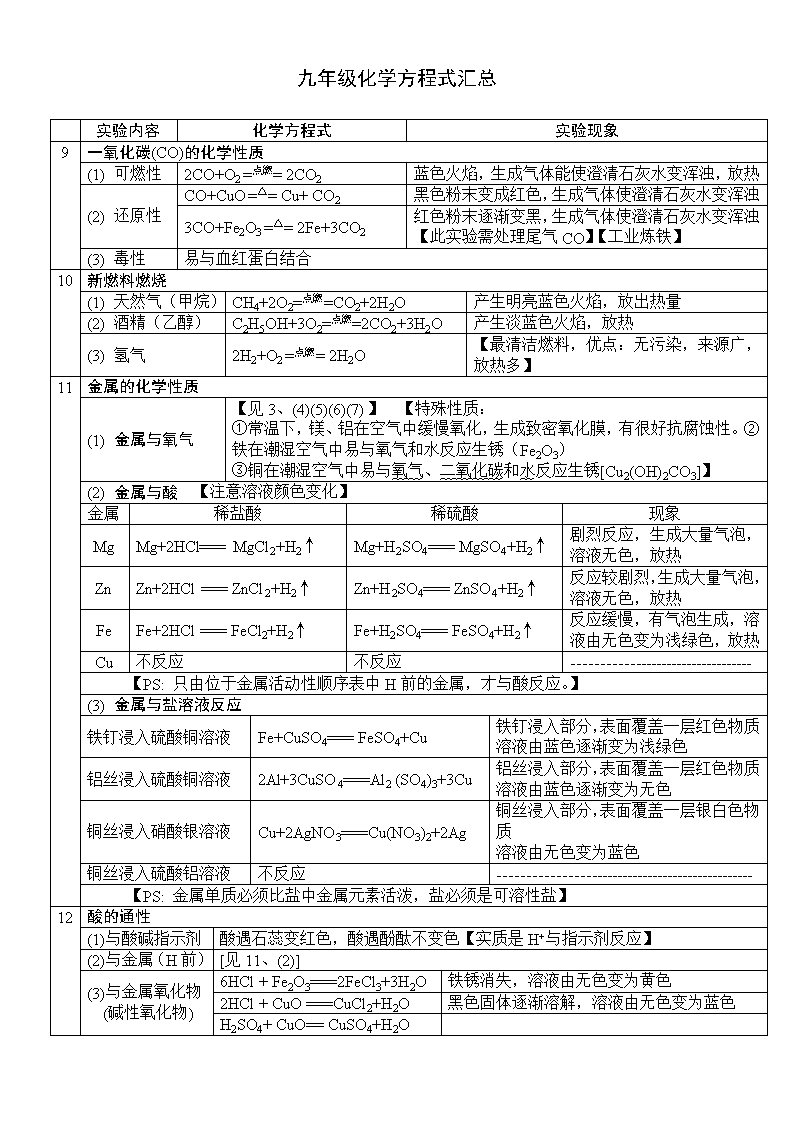
实验内容 化学方程式 实验现象 1 拉瓦锡探究空气成分实验 2Hg+O2 =△= 2HgO 液态金属汞变成红色粉末 2 用燃烧法测定空气中O2含量 4P+5O2 =点燃=2P2O5 生成大量白烟,放热 3 物质在氧气中燃烧 (1) 硫磺 S+O2 =点燃= SO2 发出蓝紫色火焰,生成有刺激性气味的气体,放热 (2) 木炭 C+O2 =点燃= CO2 发出白光,生成气体能使澄清石灰水变浑浊,放热 (3) 红磷 4P+5O2 =点燃=2P2O5 发出白光,产生大量白烟,放热 (4) 铝箔 4Al+3O2 =点燃= 2Al2O3 剧烈燃烧,发出耀眼白光,生成白色固体,放热 (5) 铁丝 3Fe+2O2 =点燃= Fe3O4 剧烈燃烧,火星四射,生成黑色固体,放热 (6) 镁条 2Mg+O2 =点燃=2MgO 剧烈燃烧,发出耀眼白光,生成白色固体,放热 (7) 铜丝 2Cu+O2 =点燃=2CuO 铜丝表面生成黑色固体,放热 (8) 蜡烛 石蜡+氧气→水+二氧化碳 干冷的玻璃片上有水雾出现,生成能使澄清石灰水变浑浊的气体,放热 【PS: 物质在氧气中燃烧比在空气中更加剧烈】 4 三大气体的制备 (1) 制备氧气(O2) a 分解过氧化氢 2H2O2 =MnO2= 2H2O+O2↑ 实验室制氧气 b 加热高锰酸钾 2KMnO4 =△= K2MnO4+MnO2+O2↑ c 加热氯酸钾和二氧化锰混合物 2KClO3 = MnO2= 2KCl+3O2↑ d 分离液态空气 工业制氧气 (2)制备二氧化碳(CO2) a 稀盐酸与大理石(主要成分碳酸钙) CaCO3+2HCl == CaCl2+H2O+CO2↑ 实验室制CO2 b 高温煅烧石灰石 CaCO3 =高温= CaO+CO2↑ 工业制CO2 (3) 制备氢气(H2) a 锌和稀盐酸 Zn+2HCl == ZnCl2+ H2↑ 实验室制H2【PS: 稀盐酸加热易挥发出HCl气体,使制得的氢气不纯,最好用稀硫酸】 b 锌和稀硫酸 Zn+H2SO4 == ZnSO4 + H2↑ 5 水的电解实验 2H2O=通电= 2H2↑+O2↑ 【PS: 正氧负氢,VH2:VO2=2:1,m H2:m O2=1:8】 6 氢气( H2)的化学性质 (1)氢气的可燃性 2H2+O2 =点燃= 2H2O 纯净的氢气在空气中安静的燃烧,发出淡蓝色火焰,放热 (2)氢气的还原性 H2+CuO =△= Cu+H2O 黑色粉末变红,试管口有水生成 7 碳单质(C)的化学性质 (1)常温下,稳定性 用碳素笔记录重要文件,用墨书写字画能长久保存 点燃或 高温 (2)可燃性 C+O2 =点燃= CO2 (O2充足) 2C+O2 =点燃= 2CO(O2不足) (3)还原性 C+2CuO =高温= 2Cu+ CO2↑ C+CO2 =高温= 2CO 8 二氧化碳(CO2)的化学性质 (1) 不燃烧,也不支持燃烧【可用于灭火】;不供给呼吸; (2) 与水反应 CO2+H2O == H2CO3 【碳酸不稳定 H2CO3 == CO2↑+H2O】 (3) 与石灰水反应 CO2+Ca(OH)2==CaCO3↓+H2O 澄清石灰水变浑浊【此反应用于检验 CO2;解释用石灰浆抹墙原理】 九年级化学方程式汇总 九年级化学方程式汇总 实验内容 化学方程式 实验现象 9 一氧化碳(CO)的化学性质 (1) 可燃性 2CO+O2 =点燃= 2CO2 蓝色火焰,生成气体能使澄清石灰水变浑浊,放热 (2) 还原性 CO+CuO =△= Cu+ CO2 黑色粉末变成红色,生成气体使澄清石灰水变浑浊 3CO+Fe2O3 =△= 2Fe+3CO2 红色粉末逐渐变黑,生成气体使澄清石灰水变浑浊 【此实验需处理尾气CO】【工业炼铁】 (3) 毒性 易与血红蛋白结合 10 新燃料燃烧 (1) 天然气(甲烷) CH4+2O2=点燃=CO2+2H2O 产生明亮蓝色火焰,放出热量 (2) 酒精(乙醇) C2H5OH+3O2=点燃=2CO2+3H2O 产生淡蓝色火焰,放热 (3) 氢气 2H2+O2 =点燃= 2H2O 【最清洁燃料,优点:无污染,来源广,放热多】 11 金属的化学性质 (1) 金属与氧气 【见3、(4)(5)(6)(7)】 【特殊性质: ①常温下,镁、铝在空气中缓慢氧化,生成致密氧化膜,有很好抗腐蚀性。②铁在潮湿空气中易与氧气和水反应生锈(Fe2O3) ③铜在潮湿空气中易与氧气、二氧化碳和水反应生锈[Cu2(OH)2CO3]】 (2) 金属与酸 【注意溶液颜色变化】 金属 稀盐酸 稀硫酸 现象 Mg Mg+2HCl=== MgCl2+H2↑ Mg+H2SO4=== MgSO4+H2↑ 剧烈反应,生成大量气泡,溶液无色,放热 Zn Zn+2HCl === ZnCl2+H2↑ Zn+H2SO4=== ZnSO4+H2↑ 反应较剧烈,生成大量气泡,溶液无色,放热 Fe Fe+2HCl === FeCl2+H2↑ Fe+H2SO4=== FeSO4+H2↑ 反应缓慢,有气泡生成,溶液由无色变为浅绿色,放热 Cu 不反应 不反应 ---------------------------------- 【PS: 只由位于金属活动性顺序表中H前的金属,才与酸反应。】 (3) 金属与盐溶液反应 铁钉浸入硫酸铜溶液 Fe+CuSO4=== FeSO4+Cu 铁钉浸入部分,表面覆盖一层红色物质 溶液由蓝色逐渐变为浅绿色 铝丝浸入硫酸铜溶液 2Al+3CuSO4===Al2 (SO4)3+3Cu 铝丝浸入部分,表面覆盖一层红色物质 溶液由蓝色逐渐变为无色 铜丝浸入硝酸银溶液 Cu+2AgNO3===Cu(NO3)2+2Ag 铜丝浸入部分,表面覆盖一层银白色物质 溶液由无色变为蓝色 铜丝浸入硫酸铝溶液 不反应 ------------------------------------------------ 【PS: 金属单质必须比盐中金属元素活泼,盐必须是可溶性盐】 12 酸的通性 (1)与酸碱指示剂 酸遇石蕊变红色,酸遇酚酞不变色【实质是H+与指示剂反应】 (2)与金属(H前) [见11、(2)] (3)与金属氧化物 (碱性氧化物) 6HCl + Fe2O3===2FeCl3+3H2O 铁锈消失,溶液由无色变为黄色 2HCl + CuO ===CuCl2+H2O 黑色固体逐渐溶解,溶液由无色变为蓝色 H2SO4+ CuO== CuSO4+H2O 九年级化学方程式汇总 实验内容 化学方程式 实验现象 12 酸的通性 (4) 与碱 HCl + NaOH===NaCl + H2O 白色固体逐溶解 2HCl + Cu(OH)2===CuCl2+2H2O 蓝色固体逐渐溶解,溶液变蓝 Cu(OH)2+H2SO4== CuSO4+2H2O 蓝色固体逐渐溶解,溶液变蓝 (5) 与部分盐 HCl+AgNO3===AgCl↓+HNO3 生成不溶于硝酸的白色沉淀 【用AgNO3检验盐酸或可溶性盐酸盐】 2HCl+CaCO3===CaCl2+H2O+CO2↑ 白色固体逐渐消失,生成气体能使澄清石灰水变浑浊【检验CO32-: ①加稀盐酸②生成气体通入澄清石灰水】 BaCl2+H2SO4===BaSO4↓+2HCl 生成不溶于硝酸的白色沉淀 【用BaCl2检验硫酸或可溶性硫酸盐】 13 碱的通性 (1) 与酸碱指示剂 碱遇石蕊变红色,碱遇酚酞变蓝色【实质是OH—与指示剂反应】 (2) 与非金属氧化物 (酸性氧化物) Ca(OH)2+CO2==CaCO3↓+H2O 2NaOH+CO2==Na2CO3+H2O 2NaOH+SO2==Na2SO3+H2O (3) 与碱 [见12、(4)] (4) 与某些盐 2NaOH+ CuSO4===Cu(OH)2↓+ Na2SO4 生成蓝色絮状沉淀 3NaOH+FeCl3===Fe(OH)3↓+ 3NaCl 生成红褐色沉淀 Ca(OH)2+Na2CO3===CaCO3↓+2NaOH 生成白色沉淀 14 盐的通性 (1)金属与盐溶液 [见11、(3)] 条件:①金属单质比盐中金属活泼;②盐可溶于水 (2)酸与盐 [见12、(5)] 条件: ①反应物中盐可溶于酸(BaSO4、AgCl是不溶于硝酸的盐) ②生成物中有水或沉淀或气体【复分解反应发生的条件】 (3)碱与盐溶液 [见13、(4)] 条件:①反应物中盐、碱均可溶于水 ②生成物有水或沉淀或气体 (4)盐与盐 NaCl+AgNO3===AgCl↓+NaNO3 生成不溶于硝酸的白色沉淀 Na2SO4+BaCl2===BaSO4↓+2NaCl 15 制火碱(NaOH) Na2CO3+Ca(OH)2===CaCO3↓+2NaOH 16 制熟石灰[Ca(OH)2] CaO+H2O=== Ca(OH)2 【生石灰可做食品干燥剂】 17 葡萄糖在酶的作用下转换,放出热量 C6H12O6+6O2酶→6CO2+6H2O 18 铵态氮肥 NH4NO3+NaOH==NaNO3+NH3↑+H2O 生成有刺激性气味的气体 NH4HCO3 =△= NH3↑+H2O+CO2↑ 生成有刺激性气味的气体 19 碳酸氢钠( NaHCO3)[ 类比:Ca(HCO3)2=△= CaCO3↓+H2O+CO2↑] NaHCO3+HCl==NaCl+H2O+CO2↑ 2NaHCO3 =△= Na2CO3+H2O+CO2↑查看更多