- 2021-05-10 发布 |
- 37.5 KB |
- 2页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学复习热点题型还原性
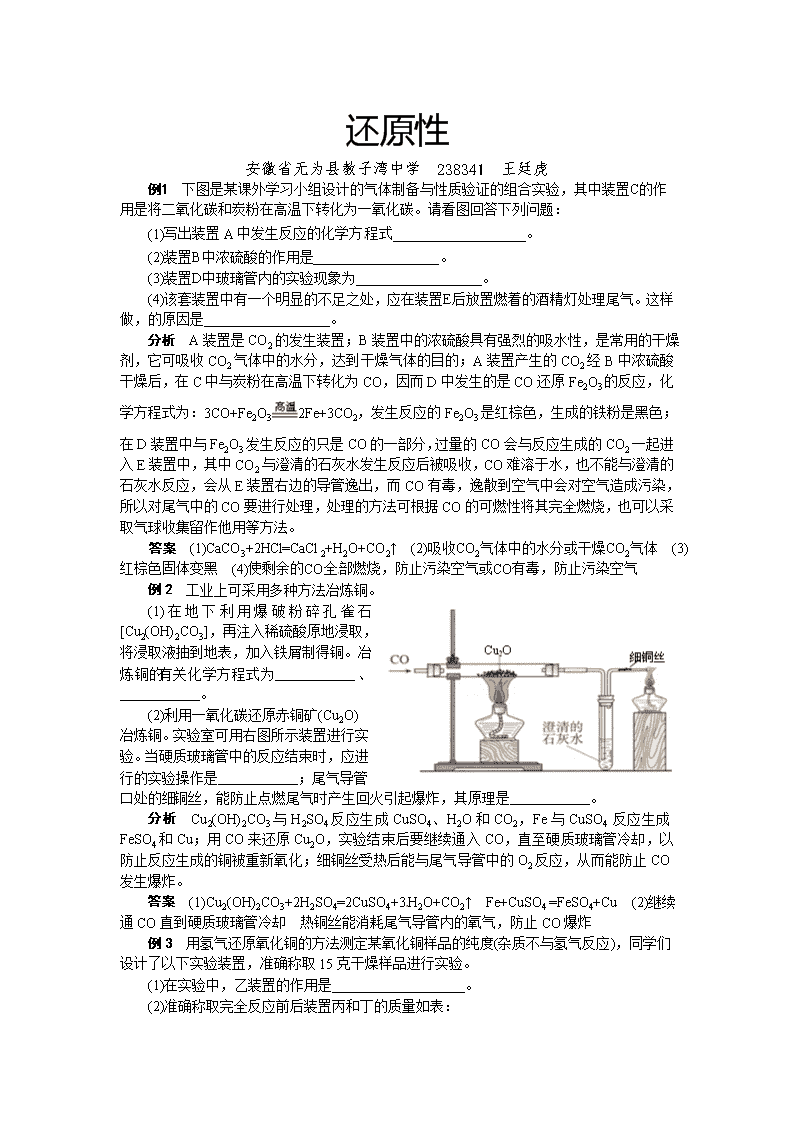
还原性 安徽省无为县教子湾中学 238341 王廷虎 例1 下图是某课外学习小组设计的气体制备与性质验证的组合实验,其中装置C的作用是将二氧化碳和炭粉在高温下转化为一氧化碳。请看图回答下列问题: (1)写出装置A中发生反应的化学方程式___________________。 (2)装置B中浓硫酸的作用是__________________。 (3)装置D中玻璃管内的实验现象为__________________。 (4)该套装置中有一个明显的不足之处,应在装置E后放置燃着的酒精灯处理尾气。这样做,的原因是__________________。 分析 A装置是CO2的发生装置;B装置中的浓硫酸具有强烈的吸水性,是常用的干燥剂,它可吸收CO2气体中的水分,达到干燥气体的目的;A装置产生的CO2经B中浓硫酸干燥后,在C中与炭粉在高温下转化为CO,因而D中发生的是CO还原Fe2O3的反应,化学方程式为:3CO+Fe2O32Fe+3CO2,发生反应的Fe2O3是红棕色,生成的铁粉是黑色;在D装置中与Fe2O3发生反应的只是CO的一部分,过量的CO会与反应生成的CO2一起进入E装置中,其中CO2与澄清的石灰水发生反应后被吸收,CO难溶于水,也不能与澄清的石灰水反应,会从E装置右边的导管逸出,而CO有毒,逸散到空气中会对空气造成污染,所以对尾气中的CO要进行处理,处理的方法可根据CO的可燃性将其完全燃烧,也可以采取气球收集留作他用等方法。 答案 (1)CaCO3+2HCl=CaCl2+H2O+CO2↑ (2)吸收CO2气体中的水分或干燥CO2气体 (3)红棕色固体变黑 (4)使剩余的CO全部燃烧,防止污染空气或CO有毒,防止污染空气 例2 工业上可采用多种方法冶炼铜。 (1)在地下利用爆破粉碎孔雀石[Cu2(OH)2CO3],再注入稀硫酸原地浸取,将浸取液抽到地表,加入铁屑制得铜。冶炼铜的有关化学方程式为__________、__________。[来源:] (2)利用一氧化碳还原赤铜矿(Cu2O)冶炼铜。实验室可用右图所示装置进行实验。当硬质玻璃管中的反应结束时,应进行的实验操作是__________;尾气导管口处的细铜丝,能防止点燃尾气时产生回火引起爆炸,其原理是__________。 分析 Cu2(OH)2CO3与H2SO4反应生成CuSO4、H2O和CO2,Fe与CuSO4 反应生成FeSO4和Cu;用CO来还原Cu2O,实验结束后要继续通入CO,直至硬质玻璃管冷却,以防止反应生成的铜被重新氧化;细铜丝受热后能与尾气导管中的O2反应,从而能防止CO发生爆炸。 答案 (1)Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑ Fe+CuSO4 =FeSO4+Cu (2)继续通CO直到硬质玻璃管冷却 热铜丝能消耗尾气导管内的氧气,防止CO爆炸 例3 用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验。 (1)在实验中,乙装置的作用是___________________。 (2)准确称取完全反应前后装置丙和丁的质量如表: 装置丙 装置丁 反应前 48.8克 161.2克 反应后 46.5克 163.9克 小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度(写出计算过程)。 (3)比较两种计算结果,请分析导致这一结果的原因可能是_____。 A.装置的气密性不好 B.空气中的水分被丁处浓硫酸吸收 C.通入的氢气量不足 D.空气中的二氧化碳被丁处浓硫酸吸收 分析 氢气通过浓硫酸是为了除去氢气中的水分,无水硫酸铜遇到水由白色变蓝,所以通过无水硫酸铜就是检验浓硫酸是否把氢气中水分除尽;装置丁增加的质量即为反应生成水的质量,所以生成水的质量为163.9g-161.2g=2.7g,设要生成2.7g水需要参加反应的氧化铜的质量为x。 H2+CuOCu+H2O 80 18 x 2.7g 80﹕18=x﹕2.7g,解得x=12g,所以氧化铜的质量分数:×100%=80%。 根据装置丁处浓硫酸质量的增加量计算,结果偏大,原因是丁处的浓硫酸与空气相连,吸收了空气中的水分。 答案 (1)检验氢气中水分是否全部被吸收 (2)80% (3)B查看更多