- 2021-05-10 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学流程图专题
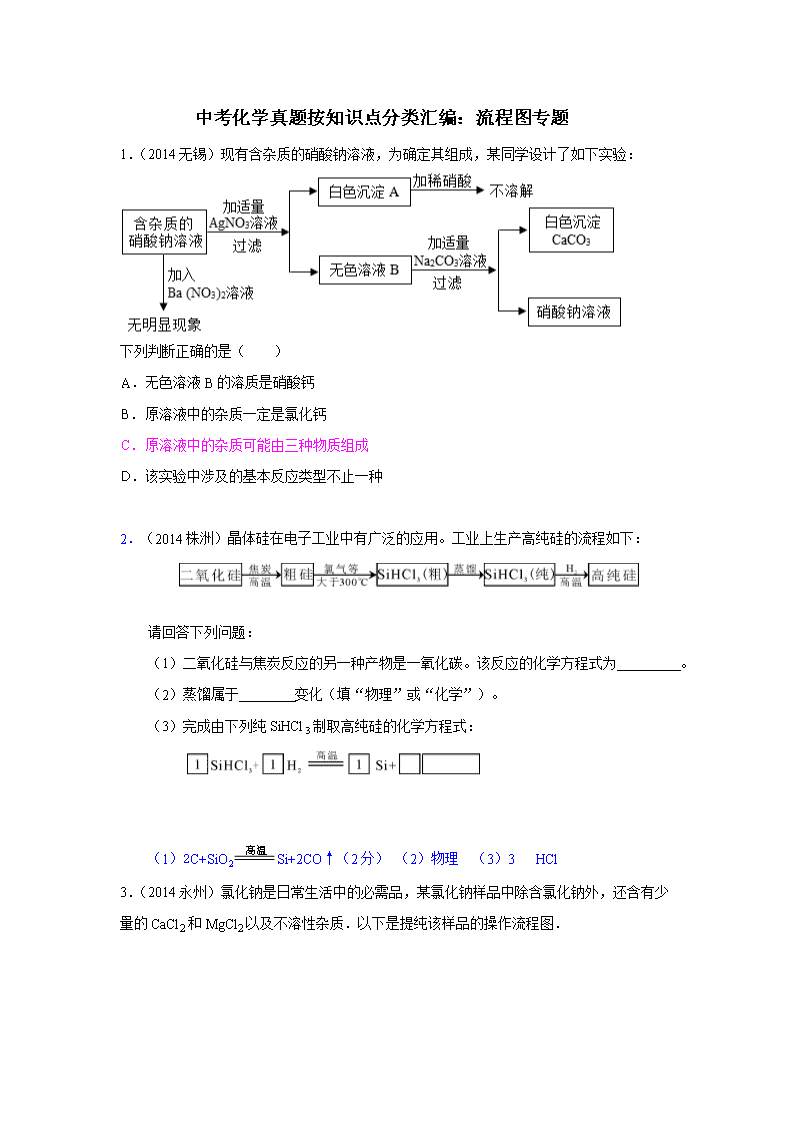
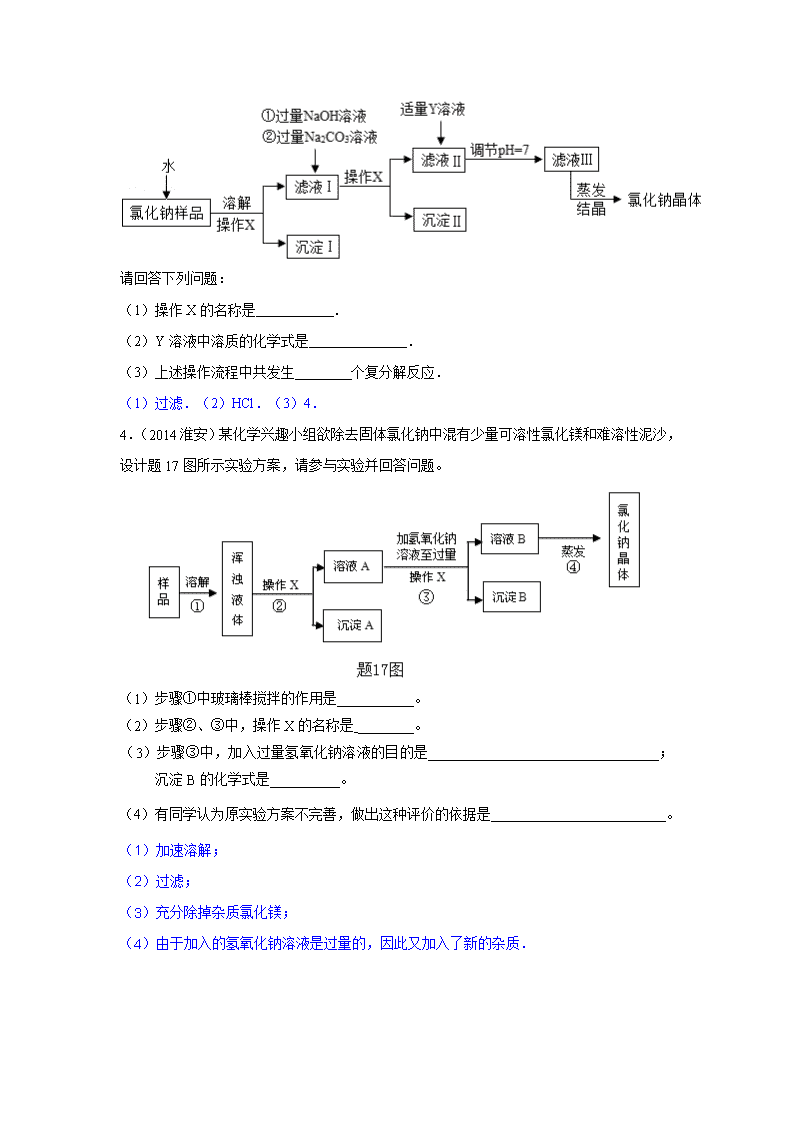
中考化学真题按知识点分类汇编:流程图专题 1.(2014无锡)现有含杂质的硝酸钠溶液,为确定其组成,某同学设计了如下实验: 下列判断正确的是( ) A. 无色溶液B的溶质是硝酸钙 B. 原溶液中的杂质一定是氯化钙 C. 原溶液中的杂质可能由三种物质组成 D. 该实验中涉及的基本反应类型不止一种 2.(2014株洲)晶体硅在电子工业中有广泛的应用。工业上生产高纯硅的流程如下: 请回答下列问题: (1)二氧化硅与焦炭反应的另一种产物是一氧化碳。该反应的化学方程式为 。 (2)蒸馏属于 变化(填“物理”或“化学”)。 (3)完成由下列纯SiHCl3制取高纯硅的化学方程式: (1)2C+SiO2Si+2CO↑(2分) (2)物理 (3)3 HCl 3.(2014永州)氯化钠是日常生活中的必需品,某氯化钠样品中除含氯化钠外,还含有少量的CaCl2和MgCl2以及不溶性杂质.以下是提纯该样品的操作流程图. 请回答下列问题: (1)操作X的名称是 . (2)Y溶液中溶质的化学式是 . (3)上述操作流程中共发生 个复分解反应. (1)过滤.(2)HCl.(3)4. 4.(2014淮安)某化学兴趣小组欲除去固体氯化钠中混有少量可溶性氯化镁和难溶性泥沙,设计题17图所示实验方案,请参与实验并回答问题。 (1)步骤①中玻璃棒搅拌的作用是___________。 (2)步骤②、③中,操作X的名称是 ________。 (3)步骤③中,加入过量氢氧化钠溶液的目的是_________________________________;沉淀B的化学式是__________。 (4)有同学认为原实验方案不完善,做出这种评价的依据是_________________________。 (1)加速溶解; (2)过滤; (3)充分除掉杂质氯化镁; (4)由于加入的氢氧化钠溶液是过量的,因此又加入了新的杂质. 5.(2014连云港)我市拥有丰富的海洋资源,开发利用这些宝贵的资源有力地促进了我市经济的发展. (1)从海水中提取出的粗盐中除了NaCl外,还含有泥沙等杂质.请完善下列实验室中除去泥沙等杂质的实验步骤,并回答相关问题:(如图1)其中操作1的名称是 ;在过滤操作中要用到的玻璃仪器有烧杯、玻璃棒、 (填仪器名称);在加热蒸发过程中,当蒸发皿中 时,停止加热 (2)上述除去泥沙后的澄清滤液中,还含有Ca2+、Mg2+等阳离子.要想知道该滤液是硬水还是软水,可加入 进行检验. (3)海水提取出粗盐后的母液中,还含有较多的氯化镁,用氯化镁可制得金属镁.工业上从母液中提取氯化镁的过程如图2:反应1的基本反应类型是 ; 物质X是 (填名称). (4)工业上可用电解饱和NaCl溶液的方法制得烧碱、氯气和氢气,请写出该反应的化学方程式: ; (1)溶解;漏斗;出现较多固体; (2)肥皂水; (3)复分解反应;盐酸; (4)2NaCl+2H2O2NaOH+Cl2↑+H2↑; 6.(2014苏州)某化工厂用石灰石和废铜屑等设计生产石青、波尔多液的工艺流程如下: (1)X的化学式为 。 (2)反应②中空气的作用是 。 (3)石青的化学式为2CuCO3·Cu(OH)2,写出反应③的化学方程式 。 (4)若反应④中硫酸铜、生石灰和水的化学计量数之比为1:1:1,则其化学方程式为 。 (1)CO2; (2)起氧化作用; (3)3CaCO3+3CuSO4+H2O2CuCO3Cu(OH)2↓+CO2↑+3CaSO4; (4)CuSO4+CaO+H2O=Cu(OH)2↓+CaSO4. 7.(2014泰州)(7分)某校化学兴趣小组的同学开展了测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验。他们设计了如下的实验方案: (1)“操作1”的名称是___________,溶液M中的溶质 (写化学式)。 (2)滴加CaCl2溶液应“过量”,否则会使测定的结果 (填“偏大”或“偏小”), 确定CaCl2溶液是否过量的方法是 __________________________________ _ 。 (3)该混合物中Na2CO3的质量分数是多少?(写出解题过程,计算结果精确到0.1%) (1)过滤;NaCl、CaCl2。 (2)偏小;取少量溶液M,滴入适量的碳酸钠,若有沉淀产生,则CaCl2溶液过量(其它正确的也可以)。 (3) 8.(2014无锡)FeSO4•7H2O是一种重要的食品和饲料添加剂.某工业废渣主要成分是Fe2O3,还含有CaCO8和SiO2(既不溶于水也不溶于稀硫酸),实验室用此废渣制备FeSO4•7H2O的流程如图1: 请根据流程图回答下列问题: (1)稀硫酸与粉末中的氧化铁反应的化学方程式为 (2)操作②所需要的玻璃仪器是:烧杯、玻璃棒和 . (3)经测定,滤渣中只含有CaSO4和SiO2,你认为实验室 (填“能”或者“不能”)用粉末状的石灰石与稀硫酸反应制二氧化碳. (4)Fe与Fe2(SO4)3反应的化学方程式为 . (5)硫酸亚铁的溶解度曲线如图2.待结晶完毕后,滤除晶体,用少量冰水洗涤2﹣3次.用冰水洗涤的目的是 Ⅰ除去晶体表面附着的杂质; Ⅱ . (1)Fe2O3+2H2SO4═Fe2(SO4)3+3H2O; (2)漏斗; (3)能; (4)Fe+Fe2(SO4)3═3FeSO4; (5)用冰水洗涤可降低洗涤过程中绿矾的损耗. 9.(2014扬州)过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法.m 已知:温度过高过氧化物会分解生成氧化物和氧气. 方法1:由Ca(OH)2为原料最终反应制得,其制备流程如图1: 方法2:由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如图2: (1)方法1中搅拌的目的是 .请将搅拌过程中发生反应的化学方程式补充完整: CaC12+H2O2+2NH3•H2O+6 ═CaO2•8H2O↓+2NH4Cl.制备过程中除水外可循环使用的物质是 (填化学式) (2)方法2中气体X是 ,实验室常用 溶液来吸收.煅烧后的反应是化合反应,也能生成CaO2•8H2O,反应的化学方程式为 . 该反应需控制温度在0~2℃,可将反应器放置在 ,获得的CaO2产品中主要含有的固体杂质是 (填化学式) (3)这两种制法均要求在低温下进行(除煅烧外),温度过高会造成氨水挥发外,还能 . (4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO2•8H2O的反应符合“绿色化学”的是 (填“方法1”或“方法2”). (1)让药品混合均匀,充分接触,H2O,NH4C1; (2)二氧化碳,氢氧化钠,Ca(OH)2+H2O2+6H2O=CaO2•8H2O,冰水混合物中,Ca(OH)2; (3)造成CaO2•8H2O分解; (4)方法2. 10.(2014呼和浩特)有一种工业废水,其中含有大量的硫酸亚铁、少量硫酸铜和污泥。某同学设计了一个既经济又合理的实验方案,制备硫酸亚铁晶体(FeSO4·7H2O)并回收铜。方案流程如下: 【查阅资料】FeSO4·7H2O受热易分解。 回答下列问题: (1)步骤①中用到的玻璃仪器有烧杯、漏斗和____________。 (2)步骤②中需加入的物质是___________,目的是_________________________。 (3)步骤③中发生反应的化学方程式是_____________________________。 (4)步骤④的操作是蒸发浓缩、____________、过滤。 (1)玻璃棒(2)铁;将硫酸铜溶液中的铜全部置换出来;(3)Fe+H2SO4═FeSO4+H2↑ (4)冷却结晶 11.(2014菏泽)粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).某班同学在粗盐提纯实验中,为把少量可溶性杂质CaCl2,MgCl2一并除去,将教材中实验方案修改设计如下,请据此回答问题: (1)实验操作A的名称是 过滤 ,该操作的目的是 除去难溶性杂质 . (2)写出步骤③中发生反应的主要化学方程式 MgCl2+2NaOH═Mg(OH)2↓+2NaCl ;步骤⑥的作用是 除去过量的氢氧化钠和碳酸钠 . (3)小刚同学认为该方案实际得到的氯化钠可能比粗盐中含有的氯化钠要多,请你为他找出理由: 因为在实验过程中有氯化钠生成 . (1)过滤 除去难溶性杂质 . (2)MgCl2+2NaOH═Mg(OH)2↓+2NaCl ; 除去过量的氢氧化钠和碳酸钠 . (3)因为在实验过程中有氯化钠生成 . 12.(2014莱芜)控制化学反应的条件可以促进或抑制化学反应,更好使化学反应为人类造福. (1)如图是科学家正在研究的二氧化碳循环利用技术: ①二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物,写出反应的化学方程式 3H2+CO2==CH3OH+H2O ,甲醇中碳元素的化合价为 ﹣2 . ②从图中分析得出的下列结论中,正确的是 AC (填序号) A.该技术符合低碳经济的理念. B.水生成氢气的过程中所用的催化剂一定是二氧化锰. C.该技术有助于缓解全球面临的能源危机. D.液化石油气、汽油、甲醇均有碳、氢、氧三种元素组成. (2)汽油燃烧时氧气浓度越大,燃烧越剧烈,试从微观角度解释这是因为 氧气浓度越大,一定体积内氧分子数目越多,氧气分子与汽油分子碰撞的次数越多,燃烧越剧烈 . (3)尿素[CO(NH2)2]对提高粮食产量具有重要的作用.人们控制条件可以使CO2和物质M发生反应:CO2+2M═CO(NH2)2+H2O,物质M的化学式为 NH3 . (1) ①3H2+CO2==CH3OH+H2O﹣2 ②AC (2)氧气浓度越大,一定体积内氧分子数目越多,氧气分子与汽油分子碰撞的次数越多,燃烧越剧烈 (3)NH3 13.(2014孝感)硬水受热后会产生水垢,水垢的主要成分是CaCO3和Mg(OH)2 ,其它成分不参与反应。实验室由水垢制取纯净CaCl2固体的流程如下: 请按要求填空: (1)酸A是人体胃酸的主要成分,酸A的化学式是 ; (2)步骤②中生成沉淀的化学反应方程式是 ; (3)步骤④加酸A的作用是 ; (4)步骤⑤是利用 的方法得到氯化钙固体。 (1)HCl (1分) (2)Ca(OH)2+MgCl2==Mg(OH)2↓+CaCl2 (2分) (3)除去过量的氢氧化钙 或 中和过量的氢氧化钙 (1分) (4)蒸发溶剂 或 蒸发结晶 (1分)查看更多