- 2021-11-12 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
徐州专版2020中考化学复习方案第5章金属的冶炼与利用课时训练11金属的冶炼防护和回收试题
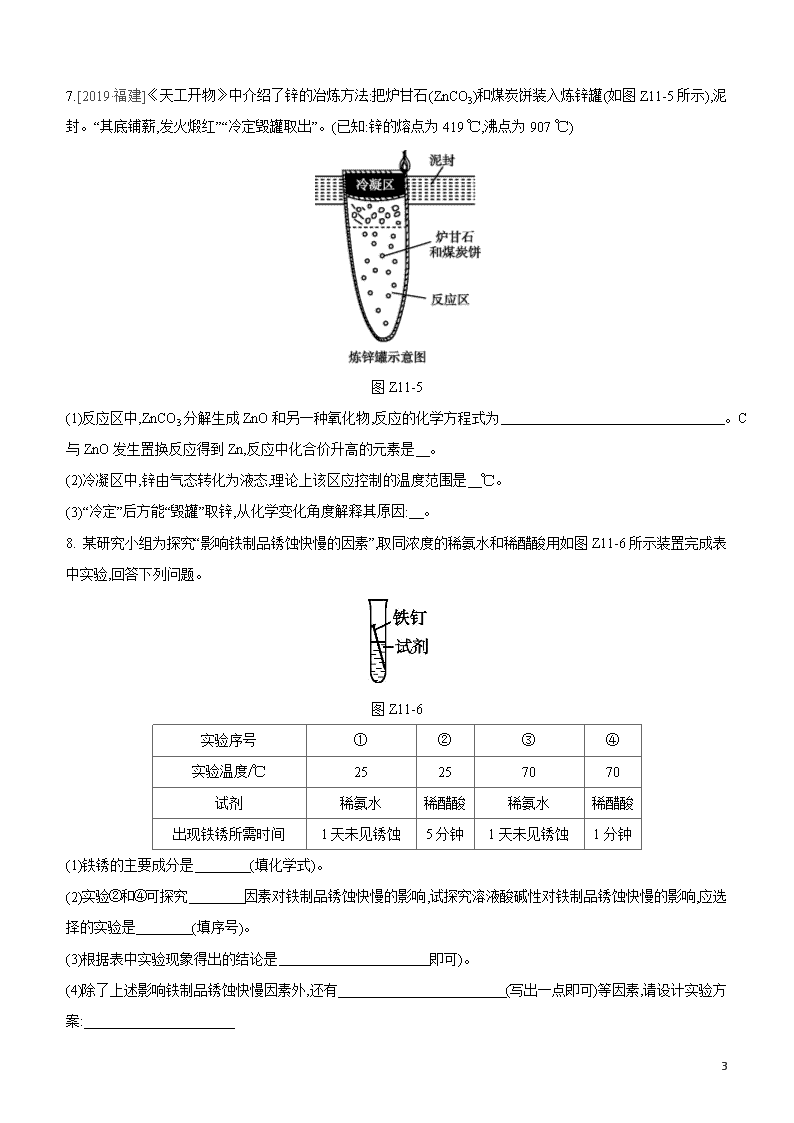
课时训练(十一) 金属的冶炼、防护和回收 |夯实基础| 1.[2019·广西北部湾]下列措施中,不能防止金属制品锈蚀的是 ( ) A.在表面刷漆 在表面涂油 表面镀铬 用湿布擦拭 2.[2019·内江]下列有关金属资源的利用与防护不合理的是 ( ) A.经常用钢丝球擦洗铝锅表面,保持洁净 B.在钢铁表面喷油漆可防止生锈 C.废旧金属的回收利用,是保护金属资源的有效途径之一 D.改变金属的组成和结构,铸造成合金材料可优化其性能 3.[2019·重庆B]为了探究铁制品锈蚀的条件,小明用普通铁钉、纯铁钉同时进行图Z11-1所示的四组实验,一段时间后只在实验Ⅰ中观察到了红褐色锈斑,其他均无明显变化。下列说法错误的是( ) 图Z11-1 A.Ⅰ和Ⅱ说明铁制品锈蚀需要O2 B.Ⅰ和Ⅲ说明铁制品锈蚀需要H2O C.Ⅰ和Ⅳ说明H2O和O2同时存在,铁制品不一定发生锈蚀 D.Ⅲ和Ⅳ说明铁制品锈蚀跟铁制品内部结构有关 4.[2019·湘潭]钢铁厂会利用焦炭产生的还原性气体来炼铁,某同学用此原理按如图Z11-2所示装置进行实验。下列说法正确的是 ( ) 图Z11-2 A.该实验不需要增加尾气处理装置 B.该实验应先通入一段时间的CO验纯后再加热 7 C.NaOH溶液可以检验气体产物 D.反应结束后,含有未反应的Fe2O3固体,可以采用加入盐酸的方法来提纯铁 5.[2019·深圳]生铁用途十分广泛。工业上利用赤铁矿(主要成分是Fe2O3,还含少量SiO2等杂质)冶炼生铁的过程如下: 图Z11-3 (1)生铁属于 (填“合成”或“金属”)材料。“高炉气体”中的 (填化学式)会导致酸雨。 (2)“煅烧”时:①生成CO的反应之一为C+CO22CO,该反应属于 (填基本反应类型)反应。 ②用化学方程式表示利用CO炼铁的原理: ③CaCO3和SiO2固体在高温条件下发生反应,生成CO2气体和CaSiO3,该反应的化学方程式为 (3)生活中铁制品锈蚀的过程,实际上是Fe与空气中 、 等发生化学反应的过程。下列措施能防止铁制品锈蚀的是 (填序号)。 A.涂油、喷漆 B.镀耐腐蚀的铬层 C.用盐水清洗 D.久置于酸性环境 |拓展提升| 6.[2019·台州]某同学对Fe2O3做了如图Z11-4所示探究活动,已知氯气在水溶液中能将Fe2+转变为Fe3+,且每一步都充分反应。下列分析正确的是 ( ) 图Z11-4 A.无色气体可以使澄清石灰水变浑浊 B.黑色粉末是Fe3O4 C.①过程Fe2O3中的氧元素全部转入无色气体 D.②过程有置换反应发生 7 7.[2019·福建]《天工开物》中介绍了锌的冶炼方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐(如图Z11-5所示),泥封。“其底铺薪,发火煅红”“冷定毁罐取出”。(已知:锌的熔点为419 ℃,沸点为907 ℃) 图Z11-5 (1)反应区中,ZnCO3分解生成ZnO和另一种氧化物,反应的化学方程式为 。C与ZnO发生置换反应得到Zn,反应中化合价升高的元素是 。 (2)冷凝区中,锌由气态转化为液态,理论上该区应控制的温度范围是 ℃。 (3)“冷定”后方能“毁罐”取锌,从化学变化角度解释其原因: 。 8. 某研究小组为探究“影响铁制品锈蚀快慢的因素”,取同浓度的稀氨水和稀醋酸用如图Z11-6所示装置完成表中实验,回答下列问题。 图Z11-6 实验序号 ① ② ③ ④ 实验温度/℃ 25 25 70 70 试剂 稀氨水 稀醋酸 稀氨水 稀醋酸 出现铁锈所需时间 1天未见锈蚀 5分钟 1天未见锈蚀 1分钟 (1)铁锈的主要成分是 (填化学式)。 (2)实验②和④可探究 因素对铁制品锈蚀快慢的影响,试探究溶液酸碱性对铁制品锈蚀快慢的影响,应选择的实验是 (填序号)。 (3)根据表中实验现象得出的结论是 即可)。 (4)除了上述影响铁制品锈蚀快慢因素外,还有 (写出一点即可)等因素,请设计实验方案: 7 9.[2019·盐城]人类历史发展的不同阶段曾以不同金属材料的使用作为标志。 图Z11-7 (1)金、银在自然界有单质形式存在,说明它们的化学性质都 。 (2)在生产生活实践中,人类逐渐掌握了多种金属的冶炼技术。 ①比较两种铁矿石磁铁矿(主要成分Fe3O4)和菱铁矿(主要成分FeCO3),从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是 。 ②近代工业上采用电解熔融氧化铝(Al2O3)的方法冶炼铝,Al2O3分解后得到两种单质,该反应的化学方程式为 (3)镁铝合金被誉为“21世纪绿色金属结构材料”。一种镁铝合金Mg17Al12是特殊的储氢材料,完全吸收氢气后得到MgH2和Al,该反应的化学方程式为 (4)钛和钛合金是21世纪的重要的金属材料。钛合金制品放在海水中数年,取出后仍光亮如新,是因为其 填序号)非常好。 A.可塑性 械性能 腐蚀性能 (5)铁在潮湿的空气中反应生成疏松的铁锈。已知:2FeCl3+Fe3FeCl2。 ①铁锈的主要成分是 (填化学式);将生锈的铁制品放入一定量的稀盐酸中充分反应,变化过程中最多涉及 种化学反应基本类型。 ②将10 g表面生锈的铁钉(杂质已忽略)浸泡在100 g溶质质量分数为7.3%的稀盐酸中充分反应,观察到铁锈已完全消失。反应停止后,取出光亮的铁钉洗涤、干燥、称量,质量为3.6 g。则原锈铁钉中铁元素的质量分数为 。 (6)利用“活泼金属”可以制得H2,H2可用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有 填序号)。 A.金属原料的成本 B.生产过程中的能耗和污染 C.金属的回收利用 7 【参考答案】 夯实基础 1.D [解析]用湿布擦拭给金属制品提供了水分,促进了金属的锈蚀。 2.A [解析]铝的化学性质较活泼,在常温下能与空气中的氧气发生反应,生成致密的氧化物保护膜,保护内部的铝不被氧化或腐蚀,常用钢丝球擦洗铝制品的表面会缩短铝制品的使用寿命;钢铁易生锈,在钢铁表面喷油漆可隔绝空气和水,防止铁制品生锈;废旧金属回收利用不仅可节约宝贵的金属资源,还可节约冶炼金属的能源、减少环境污染;合金的性能优于组成它的纯金属,将金属制成合金可优化其性能。 3.D [解析]Ⅰ、Ⅱ对比,Ⅱ中没有氧气,Ⅰ中铁钉生锈,Ⅱ中铁钉不生锈,说明铁制品锈蚀需要O2;Ⅰ、Ⅲ对比,Ⅲ中没有水,Ⅰ中铁钉生锈,Ⅲ中铁钉不生锈,说明铁制品锈蚀需要H2O;Ⅰ、Ⅳ对比两者的外界条件相同,Ⅰ中铁钉生锈,Ⅳ中铁钉不生锈,说明H2O和O2同时存在,铁制品不一定发生锈蚀;Ⅲ、Ⅳ中存在两个实验变量,不能说明铁制品锈蚀跟铁制品内部结构有关。 4.B [解析]该实验过程中,有未参加反应的CO气体排出,氢氧化钠溶液不能吸收CO且CO是有毒气体,故还需要增加尾气处理装置;CO是可燃性气体,和空气或氧气混合加热可能会发生爆炸,故加热前应先通入一段时间的CO验纯;该实验的气体产物是CO2,CO2与NaOH溶液反应生成Na2CO3和H2O,没有明显的实验现象,故不可用NaOH溶液检验;Fe2O3和Fe均能与稀盐酸反应,不能用盐酸来提纯含有Fe2O3的Fe。 5.(1)金属 SO2 (2)①化合 ②3CO+Fe2O32Fe+3CO2 ③CaCO3+SiO2CaSiO3+CO2↑ (3)水 氧气 AB [解析](1)生铁是碳和铁的合金,属于金属材料;能够引起酸雨的是SO2和氮的氧化物。(2)①CO2与C在高温下生成CO的反应属于化合反应;②CO炼铁的原理是利用CO的还原性将氧化铁还原成铁单质,化学方程式为3CO+Fe2O32Fe+3CO2;③根据题意,CaCO3和SiO2固体在高温条件下发生反应,生成CO2气体和CaSiO3,故化学反应方程式为CaCO3+SiO2CaSiO3+CO2↑。(3)铁生锈需要与氧气和水同时接触;防锈措施包括隔绝水或氧气、保持干燥等方法。 拓展提升 6.B [解析]由于氧化铁中不含碳元素,且是高温隔绝空气加热,所以不会生成二氧化碳,无色气体为氧气,不能使澄清石灰水变浑浊;由于每一步都充分反应,所以黑色粉末中不含氧化铁,根据反应前后铁元素质量守恒,可得黑色粉末中铁元素的质量为4.8 g×56×256×2+16×3×100%=3.36 g,黑色粉末中氧元素的质量为4.64 g-3.36 g=1.28 g, 7 则黑色粉末中铁原子和氧原子的个数比为3.36 g56∶1.28 g16=3∶4,所以黑色粉末是Fe3O4;根据上述分析可知,黑色粉末中也含有氧元素;②过程是四氧化三铁和盐酸反应,不属于置换反应。 7.(1)ZnCO3ZnO+CO2↑ C(或碳) (2)419~907 (3)防止生成的锌在较高温度下又被氧化成氧化锌(或2Zn+O22ZnO) [解析](1)碳酸锌加热分解生成氧化锌和二氧化碳,反应的化学方程式为ZnCO3ZnO+CO2↑;C与ZnO反应生成Zn和CO2,反应前碳元素的化合价为0,反应后碳元素的化合价变为+4,故化合价升高的元素是碳。(2)锌的熔点为419 ℃,沸点为907 ℃,故锌由气态变为液态的温度范围为419~907 ℃。(3)锌在较高温度下能和氧气反应生成氧化锌,故应冷却后再取锌。 8.(1)Fe2O3(或Fe2O3·xH2O) (2)温度 ①②(或③④) (3)相同酸性环境下,温度越高,铁生锈越快 (4)氧气浓度 向图示装置中分别通入空气和氧气,然后观察铁锈出现的时间 [解析](2)实验②和④可探究温度因素对铁制品锈蚀快慢的影响,试探究溶液酸碱性对铁制品锈蚀快慢的影响,应选择的实验是①②或③④。(3)根据表中实验现象可知在碱性环境下(实验①③),铁钉不易生锈;在酸性环境下(实验②④),温度越高,铁钉生锈越快。(4)通过分析可知,氧气浓度也会影响铁制品锈蚀的快慢,设计实验时,应采用控制变量法,分别通入空气和氧气,观察铁锈出现的时间。 9.(1)不活泼 (2)①磁铁矿中铁元素含量更高 ②2Al2O34Al+3O2↑ (3)Mg17Al12+17H217MgH2+12Al (4)C (5)①Fe2O3(或Fe2O3·xH2O) 3 ②92% (6)ABC [解析](1)金、银的金属活动性都很弱,其单质的化学性质不活泼,在自然界中能以单质形式存在。(2)①磁铁矿的主要成分Fe3O4中的铁元素的质量分数为56×356×3+16×4×100%≈72.4%,菱铁矿的主要成分FeCO3中铁元素的质量分数为5656+12+16×3×100%≈48.3%,故磁铁矿石中铁元素的含量高于菱铁矿,故选磁铁矿石作炼铁原料更具优势。(4)合金与纯金属相比有很多优良的性能,如熔点低、硬度大、抗腐蚀性能好,根据钛合金制品放在海水中数年, 7 取出后仍光亮如新,说明该合金抗腐蚀性能优良。(5)①铁锈的主要成分为氧化铁,化学式为Fe2O3。生锈的铁制品放入一定量的稀盐酸中,铁锈主要成分氧化铁与稀盐酸反应,化学方程式为Fe2O3+6HCl2FeCl3+3H2O,该反应属于复分解反应;铁和稀盐酸也发生反应,化学方程式为Fe+2HClFeCl2+H2↑,该反应属于置换反应;同时氯化铁能与铁反应,化学方程式为2FeCl3+Fe3FeCl2,该反应属于化合反应,故变化过程中共涉及3种化学反应基本类型。②根据题中信息可知,铁锈中的铁元素以及参与反应的单质铁最终都形成了氯化亚铁,设在氯化亚铁中,铁元素质量为x。 根据化学反应前后氯元素质量不变可得: Fe~FeCl2~2HCl 56 73 x 100 g×7.3% 5673=x100 g×7.3% x=5.6 g 故原锈铁钉中铁元素的质量分数为5.6 g+3.6 g10 g×100%=92%。 (6)金属原料的成本低则利于技术的推广,成本高则不利于技术的推广,故要考虑;生产过程中的能耗和污染,会对技术的推广产生负面的影响,故要考虑;金属的回收利用,能有效地节约能源和资源,以及成本,故要考虑。 7查看更多