- 2021-11-06 发布 |
- 37.5 KB |
- 36页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
徐州专版2020中考化学复习方案第5章金属的冶炼与利用第11课时金属的冶炼防护和回收课件
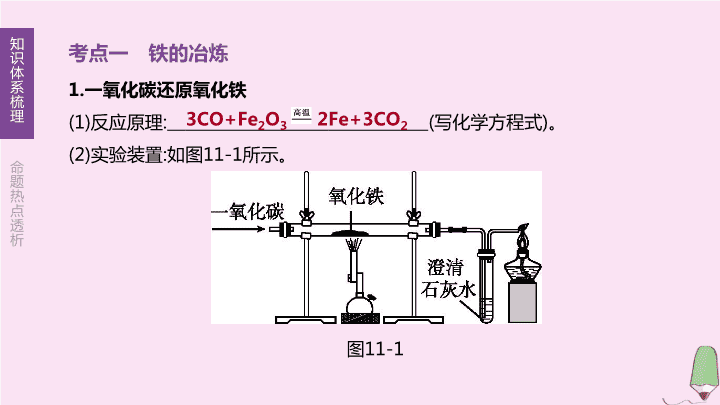
第 11 课时 金属的冶炼、防护和回收 第 5 章 金属的冶炼与利用 【 考试要求 】 1. 知道一些常见金属 ( 铁、铝等 ) 矿物。 (A) 2. 知道可用铁矿石炼铁。 (A) 3. 了解防止金属锈蚀的简单方法。 (B) 4. 认识废弃金属对环境的影响和回收金属的重要性。 (B) 考点一 铁的冶炼 1. 一氧化碳还原氧化铁 (1) 反应原理 : ( 写化学方程式 ) 。 (2) 实验装置 : 如图 11-1 所示。 图 11-1 3CO+Fe 2 O 3 2Fe+3CO 2 (3) 实验步骤 : ① 实验开始 : 通气、点灯 , 其目的是 _________________________________________ ; ② 实验结束 : 灭灯、停气 , 其目的是防止液体倒吸 , 防止炽热的铁被氧化。 (4) 实验现象 : 红棕色固体变成 色 ; 澄清石灰水 。 (5) 尾气处理 : 目的是 。可采用点燃或收集 ( 用干瘪的气球收集、排水法收集 ) 的方法处理尾气。 (6) 产物检验 : 为了检验生成的物质是否为铁 , 还要进行的操作是 _______________ , 看到 的现象 , 说明有铁生成了。 (7) 应用 :① 检验 CO;② 除去 CO 2 中的 CO 。 排尽玻璃管内空气 , 防止加热一氧化碳与 黑 变浑浊 防止有毒的 CO 排入大气中而污染环境 取样 , 滴加硫 有红色固体析出 , 溶液变为浅绿色 空气的混合物而爆炸 酸铜溶液 2. 高炉炼铁 工业炼铁时 , 把 跟 、 分别加入高炉 , 从下面通入 , 在炉内生成一氧化碳 , 把铁矿石还原成铁。以赤铁矿为例 , 写出高炉内发生反应的化学方程式 : (1) 。 (2) 。 (3) 。 铁矿石 焦炭 石灰石 热空气 C+O 2 CO 2 CO 2 +C 2CO 3CO+Fe 2 O 3 2Fe+3CO 2 易错判断 (1) 用一氧化碳还原氧化铁 , 反应前后玻璃管中固体减少的质量是生成二氧化碳的质量 ( ) (2) 工业炼铁的产品是生铁 , 实验室模拟炼铁的产品是纯铁 ( ) × √ 考点二 铁的锈蚀与防护 1. 铁生锈条件的探究 实验装置 一周后现象 无现象 无现象 生锈 严重生锈 严重生锈 实验结论 铁与氧气、水同时接触时会生锈 , 酸或 NaCl 溶液能加快铁的锈蚀 注意 装置 ② 中使用冷却后的沸水 , 目的是排出水中溶解的氧气 2. 铁生锈的条件 : 与 、 同时接触。 铁生锈的两个条件缺一不可。如果铁表面沾有酸液、氯化钠等物质时 , 往往会加快铁的锈蚀。若铁制品上有铁锈 , 因铁锈 ( 主要成分为 Fe 2 O 3 ) 疏松多孔 , 里层的铁会继续与氧气、水等反应 , 直至铁完全锈蚀。 3. 铁生锈应用 : a. 验证氧气含量 ;b. 暖宝宝原理 ;c. 脱氧剂。 4. 防锈措施 (1) 保持铁制品表面 , 如用过的菜刀洗净擦干。 (2) 在钢铁表面覆盖 , 如刷漆、涂油等。 (3) 改变金属的内部结构 , 如制成不锈钢等合金。 空气 ( 或氧气 ) 水 洁净干燥 保护层 5. 常见的金属矿物、废旧金属的回收利用 (1) 金属矿物 :① 地球上除极少数很不活泼的金属如金、银等以 形式存在外 , 其余都以 形式存在 ( 存在形式取决于金属的活动性 ) 。 ② 常见的铁矿石 : 赤铁矿 ( 主要成分的化学式为 Fe 2 O 3 ) 、磁铁矿 ( 主要成分的化学式为 Fe 3 O 4 ) 。 (2) 废旧金属的回收利用 : 废旧金属不但造成 , 还会产生镉、汞等有毒金属 , 对环境造成污染。保护金属资源的方法 : 回收利用废旧金属、防止金属锈蚀、合理开发金属资源、积极寻找金属代用品等。 单质 化合物 资源浪费 对点演练 1. 某化学兴趣小组用以下装置探究炼铁原理。关于该装置和反应过程的描述错误的是 ( ) A. 盛放药品前应先检查装置气密性 B. 加热前要先通 CO, 加热后 B 中出现浑浊 C. 已知方框中连接的是 C 和 D, 导管口的连接顺序为 a → b → c → d D. 这种方法“炼”出的铁与工业上 炼出的生铁在组成上最大的区别是不含碳 题组 1 铁的冶炼 图 11-2 [ 答案 ]C [ 解析 ] 由于有气体参加反应 , 则盛放药品前应先检查装置气密性 ; 由于 CO 有可燃性 , 与空气混合点燃时易发生爆炸 , 故加热前要先通 CO, 排净管内空气 ,CO 还原氧化铁有二氧化碳生成 ,CO2 能使石灰水变浑浊 ; 由于从 a 端出来的尾气主要是 CO,CO 有毒 , 且难溶于水 , 则需收集在 C 瓶中 , 所以导管口的连接顺序为 a→c→b→d 。 2. 某炼铁厂要冶炼 1 000 t 含杂质 3% 的生铁 , 需要含 Fe 2 O 3 80% 的赤铁矿石的质量是多少吨 ?( 计算结果精确至 0.1) 解 : 设需含 Fe 2 O 3 80% 的赤铁矿石的质量为 x 。 3CO+Fe 2 O 3 2Fe+3CO 2 160 112 80%× x 1 000 t×(1-3%) x ≈ 1 732.1 t 答 : 需要含 Fe 2 O 3 80% 的赤铁矿石的质量是 1732.1 t 。 3. 下列有关铁的锈蚀说法错误的是 ( ) A. 铁锈是一种疏松多孔的物质 , 主要成分是四氧化三铁 B. 铁的锈蚀过程能放热 , 属于缓慢氧化 C. 在干燥的空气中铁钉很难锈蚀 D. 用适量的稀盐酸除去铁钉表面的锈 题组 2 铁的锈蚀与防护 A 4. 为了减缓铁制品的锈蚀 , 下列做法不当的是 ( ) A. 在车船的表面喷涂油漆 B. 将使用后的菜刀用布擦干 C. 洗净铁制品表面的油膜 D. 在铁制品表面镀上一层锌 C 5. 下列有关金属材料的叙述错误的是 ( ) A. 回收利用废旧金属可减少对环境的污染 B. 铝块能制成铝箔是利用了铝的延展性 C. 铝比铁更容易跟氧气和其他物质反应 , 因而铝的抗腐蚀性能比铁差 D. 在铁制品表面刷漆或镀耐腐蚀性金属都可以防止铁制品锈蚀 C 6. 探究铁生锈的条件 , 有利于寻找防止铁制品锈蚀的方法。下列对比实验设计与所探究的条件 ( 蒸馏水经煮沸并迅速冷却 ), 对应关系正确的是 ( ) A. 甲和乙 : 水 B. 乙和丙 : 空气 C. 甲和丙 : 空气 D. 甲和丁 : 水 图 11-3 [ 答案 ]D [ 解析 ] 铁与氧气和水同时接触会生锈 , 探究铁生锈的条件时应用控制变量法。丁实验中铁钉生锈 , 甲和丁可探究铁钉生锈需要与水接触 , 乙 ( 或丙 ) 和丁可探究铁钉生锈需要与氧气接触。 7. 将下面五个选择项分别填在横线上 , 每项只能用一次。 A. 缓慢氧化 B. 疏松多孔 C. 与空气、水共同作用 D. 使铁器与空气隔绝 E. 没有水分存在铁不易生锈 ① 钢铁锈蚀的条件 ; ② 钢铁锈蚀的过程 ; ③ 铁锈的状态 ; ④ 使铁器保持干燥 ; ⑤ 铁器表面喷漆 。 C A B E D 8. 小林同学用相同的铁钉探究铁生锈与哪些因素有关 , 设计的实验如图 11-4 。经过一周观察到 : 试管 A 和 C 中的铁钉无明显变化 , 试管 B 中的铁钉明显锈蚀。 (1) 铁生锈是铁与 和 同时接触并发生化学反应形成的 , 铁锈的主要成分化学式为 。 (2)A 中的蒸馏水事先要煮沸 , 其目的是 ,C 中干燥剂的作用是 。 H 2 O O 2 图 11-4 Fe 2 O 3 除去溶解在水中的氧气 除去空气中的水蒸气 8. 小林同学用相同的铁钉探究铁生锈与哪些因素有关 , 设计的实验如图 11-4 。经过一周观察到 : 试管 A 和 C 中的铁钉无明显变化 , 试管 B 中的铁钉明显锈蚀。 (3) 要防止铁器生锈通常有多种措施 , 不同的铁制品所采取的防锈措施有所不同。如自行车的链条常采用 的方法防锈 , 自行车的支架常采用 的方法防锈。 (4) 回收废旧金属的意义是 _______________ ____________________________ ( 答一条 ) 。 涂油 喷漆 图 11-4 节约金属资源 ( 或减少环境污染、节约能源、 降低生产成本 ) 考向一 铁的冶炼 ( 6 年 4 考) 1. [2018 · 徐州树德一模 ] 用“ W ”形玻璃管进行微型实验 , 如图 11-5 所示。下列说法不正确的是 ( ) A.a 处红棕色粉末变为黑色 B.a 处的反应为 CO+Fe 2 O 3 2Fe+CO 2 C.b 处澄清石灰水变浑浊证明有 CO 2 生成 D. 可利用点燃的方法进行尾气处理 B 图 11-5 2. 拓展 [2019 · 巴中 ] 某化学实验小组利用以下装置测定某赤铁矿中氧化铁的纯度 : 向赤铁矿中通入纯净的一氧化碳气体 , 假设赤铁矿中杂质不参与反应。 请回答下列问题。 (1) 实验开始时 , 先进行的操作是 ( 填序号 ) 。 ① 通入一氧化碳 ② 加热 图 11-6 [ 答案 ] (1)① [ 解析 ] (1) 一氧化碳具有可燃性 , 混有空气的一氧化碳在有限空间内燃烧可能发生爆炸 , 因此实验开始前 , 先通一氧化碳 , 排尽装置中的空气 , 以免加热时发生爆炸。 2. 拓展 [2019 · 巴中 ] 某化学实验小组利用以下装置测定某赤铁矿中氧化铁的纯度 : 向赤铁矿中通入纯净的一氧化碳气体 , 假设赤铁矿中杂质不参与反应。 请回答下列问题。 (2) 实验过程中观察到装置 A 中玻璃管内发生的现象是 。 图 11-6 [ 答案 ] (2) 红色粉末变为黑色 [ 解析 ] (2) 一氧化碳和氧化铁在高温条件下反应生成铁和二氧化碳 , 氧化铁是红色粉末 , 铁粉是黑色粉末 , 所以 , 实验时观察到的现象是红色粉末变为黑色。 2. 拓展 [2019 · 巴中 ] 某化学实验小组利用以下装置测定某赤铁矿中氧化铁的纯度 : 向赤铁矿中通入纯净的一氧化碳气体 , 假设赤铁矿中杂质不参与反应。 请回答下列问题。 (3) 写出 B 装置中发生反应的化学方程式 : ; 装置 C 的作用是 。 图 11-6 [ 答案 ] (3)CO 2 +2NaOH Na 2 CO 3 +H 2 O 吸收空气中的二氧化碳 , 防止对实验产生干扰 [ 解析 ] (3) 二氧化碳和氢氧化钠溶液反应生成碳酸钠和水 ,B 中反应的化学方程式为 CO 2 +2NaOH Na 2 CO 3 +H 2 O; 空气中的二氧化碳如果进入 B 装置中 , 会使实验测得的二氧化碳质量偏大 , 导致计算出样品中氧化铁的质量分数偏大 , 因此 , 增加一个 C 装置 , 可以吸收空气中的二氧化碳 , 防止对实验产生干扰。 2. 拓展 [2019 · 巴中 ] 某化学实验小组利用以下装置测定某赤铁矿中氧化铁的纯度 : 向赤铁矿中通入纯净的一氧化碳气体 , 假设赤铁矿中杂质不参与反应。 请回答下列问题。 (4) 从环境保护的角度看此实验存在的缺陷是 。 图 11-6 [ 答案 ] (4) 没有尾气处理装置 (5)80% [ 解析 ] (4) 该实验过程中一氧化碳不能全部反应 , 最终的尾气中含有一氧化碳 , 一氧化碳有毒 , 直接排放到空气中会造成空气污染 , 需要对尾气进行处理 , 而该实验没有设置尾气处理装置。 2. 拓展 [2019 · 巴中 ] 某化学实验小组利用以下装置测定某赤铁矿中氧化铁的纯度 : 向赤铁矿中通入纯净的一氧化碳气体 , 假设赤铁矿中杂质不参与反应。 请回答下列问题。 (5) 实验前称量赤铁矿的质量为 20 g 。通入足量的一氧化碳完全反应后 ,B 装置总质量增加了 13.2 g, 则赤铁 矿中氧化铁的纯度为 。 图 11-6 [ 答案 ] (5)80% [ 解析 ] (5) 实验结束后 B 装置增加的质量就是氢氧化钠吸收的二氧化碳质量 , 已知反应生成的二氧化碳质量为 13.2 g, 设样品中氧化铁质量为 x 。 Fe 2 O 3 +3CO 2Fe+3CO 2 160 132 x 13.2 g x =16 g 样品中氧化铁的质量分数为 ×100%=80% 。 【 技法点拨 】 一氧化碳与氧化铁反应的实验步骤可简记为“气灯灯气” , 即实验开始时先通气后加热 , 实验结束后先停止加热后停止通气体。 考向二 铁的锈蚀与防护 ( 6 年 4 考) 3. [2016 · 徐州节选 ] 铁制品生锈是铁与 共同作用的结果。铁锈成分复杂 , 主要是 ( 写化学式 ), 工业上常用盐酸除去铁锈。 4. [2015 · 徐州节选 ] 铁器生锈是铁与 共同作用的结果 , 写出防止铁制品生锈的一种方法 : 。 氧气、水 Fe 2 O 3 氧气、水 刷涂油漆 ( 合理即可 ) 5. 拓展 (1) 为探究铁生锈的条件 , 小组同学设计了如图 11-7 所示的实验。 ① 实验 A 中 , ( 填“ a ”“ b ”或“ c ” ) 处最先出现铁锈。 ② 铁生锈的条件是 。 ③ 设计实验 C 的目的是 。 图 11-7 b 铁与水、空气 ( 或氧气 ) 同时接触 与实验 A 、 B 对照 , 说明铁生锈需要水和氧气 ( 合理即可 ) 5. 拓展 (2) 该小组又设计如图 11-8 所示装置 , 将一定量铁粉置于锥形瓶底部 , 塞紧瓶塞 , 滴加适量食盐水 , 开始测量容器内压强的变化。压强与时间变化关系如图 11-9 所示。 ① 实验中食盐的作用是 。 ② 锥形瓶内压强下降的原因是 。 ③ 生产、生活中铁制品的常见防锈方法有 ( 举一例 ) 。 图 11-8 加快铁粉的锈蚀速率 铁锈蚀有氧气参与 , 锥形瓶内氧气被消耗 在铁制品表面喷漆 ( 合理即可 ) 图 11-9 【 技法点拨 】 铁生锈的条件是与氧气、水同时接触 , 缺一不可 ; 由于铁锈具有疏松多孔的结构 , 它会让氧气、水渗透进来 , 继续锈蚀铁 , 这也就是“铁生锈、锈吃铁”的原因 ; 铁生锈能消耗氧气、发生缓慢氧化 , 同时放出热量 , 因此人们把铁粉用作脱氧剂、发热剂等。查看更多