- 2022-04-02 发布 |
- 37.5 KB |
- 56页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020中考化学复习方案主题三身边的化学物质第09课时金属与金属材料课件
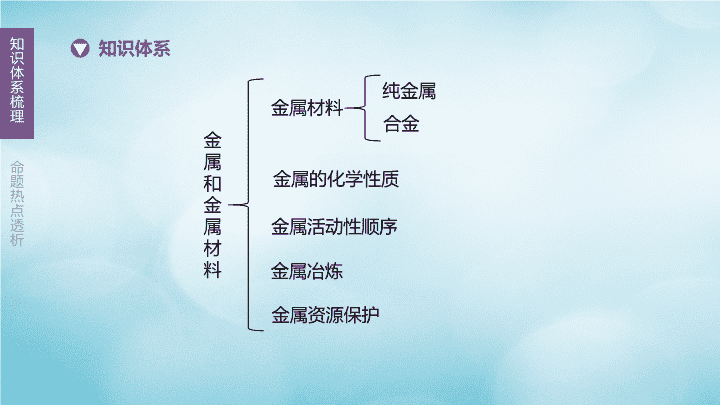
第9课时金属与金属材料主题三 身边的化学物质 金属和金属材料知识体系金属的化学性质金属活动性顺序金属冶炼纯金属合金金属材料金属资源保护 导电导热延展银白色铜固态汞CuFeAlCa 混合物大低好 MgCu强 Fe2O3提供热量,制取还原剂CO3CO+Fe2O32Fe+3CO2 O2H2OFe2O3·xH2O疏松稀盐酸清洁和干燥刷漆不锈钢防止金属锈蚀寻找金属的替代品 重点梳理1.金属的化学性质化学性质条件及通式化学方程式现象及解释注意金属与氧气反应条件:多数金属能与氧气反应,但反应的难易和剧烈程度不同通式:金属+氧气→金属氧化物(属于①反应)铝与氧气反应:②_________________________铝在常温下与氧气反应,银白色表面逐渐变暗铝的抗腐蚀性能好不是因为其化学性质稳定,而是因为铝在常温下与氧气反应生成了致密的⑤铜与氧气反应:③_______________________铜在空气中不能燃烧,加热时,生成④色固体化合4Al+3O22Cu+O2黑氧化铝薄膜2Al2O32CuO (续表)化学性质条件及通式化学方程式现象及解释注意活泼金属与稀酸反应条件:氢前金属(K、Ca、Na除外)通式:金属+酸→盐+氢气(属于⑥反应)镁与稀盐酸、稀硫酸反应:⑦______________________________;⑧_______________________________剧烈反应,产生大量⑨,放出大量热铁与稀酸反应生成的盐为亚铁盐(即铁元素的化合价为+2)金属与酸反应后,溶液的质量均增加铁与稀盐酸、稀硫酸反应:⑩______________________________;⑪______________________________反应缓慢,产生气泡,溶液由无色变为⑫色置换Mg+2HClMgCl2+H2↑Mg+H2SO4MgSO4+H2↑气泡Fe+2HClFeCl2+H2↑浅绿Fe+H2SO4FeSO4+H2↑ (续表)化学性质条件及通式化学方程式现象及解释注意金属与某些可溶性盐溶液反应条件:前置换后(K、Ca、Na除外),盐可溶通式:金属+盐→新盐+新金属(属于⑬反应)Fe与CuSO4溶液反应:⑭_______________________________铁表面有⑮色的物质生成,溶液由⑯_____色变为浅绿色铁与硫酸铜溶液的反应是我国古代湿法冶金术的先驱若金属表面有“锈”即“氧化膜”,应先用砂纸打磨干净,再做实验置换Fe+CuSO4红蓝FeSO4+Cu (续表)化学性质条件及通式化学方程式现象及解释注意金属与某些可溶性盐溶液反应条件:前置换后(K、Ca、Na除外),盐可溶通式:金属+盐→新盐+新金属(属于⑬反应)Cu与AgNO3溶液反应:⑰____________________________________铜的表面有⑱色的物质生成,溶液由无色变为⑲_____色铁与硫酸铜溶液的反应是我国古代湿法冶金术的先驱若金属表面有“锈”即“氧化膜”,应先用砂纸打磨干净,再做实验置换Cu+2AgNO3银白蓝Cu(NO3)2+2Ag (续表)化学性质条件及通式化学方程式现象及解释注意金属与某些可溶性盐溶液反应条件:前置换后(K、Ca、Na除外),盐可溶通式:金属+盐→新盐+新金属(属于⑬反应)Al与CuSO4溶液反应:⑳________________________________________铝表面有㉑_____色的物质生成,溶液由蓝色变为㉒______色铁与硫酸铜溶液的反应是我国古代湿法冶金术的先驱若金属表面有“锈”即“氧化膜”,应先用砂纸打磨干净,再做实验置换2Al+3CuSO4红无Al2(SO4)3+3Cu 2.实验室模拟炼铁实验装置实验原理㉓__________________________________3CO+Fe2O32Fe+3CO2 (续表)实验步骤(1)先通纯净的CO一段时间——原因:㉔____________________________________(2)再点燃酒精喷灯,给Fe2O3加热——目的:使氧化铁和一氧化碳发生反应(3)实验结束,先停止加热,再停止通入CO(CO早出晚归,酒精喷灯迟到早退)——原因:一是㉕二是㉖防止液体倒吸防止新生成的铁在较高温度下被空气中的氧气再次氧化排尽玻璃管内的空气,防止加热时发生爆炸 (续表)实验现象玻璃管内:㉗试管中:㉘最右端导管口:有㉙色火焰产生实验反思一氧化碳是有毒气体,本实验尾气处理方法是㉚,还可以用气囊收集该实验可验证CO的㉛、㉜(均填化学性质)红色粉末变为黑色澄清石灰水变浑浊浅蓝点燃还原性可燃性 3.铁制品锈蚀条件探究编号ⅠⅡⅢ实验图示生锈程度㉝_____________㉞_____________㉟__________不生锈不生锈生锈 (续表)编号ⅠⅡⅢ对比分析实验Ⅰ、Ⅲ说明铁生锈一定与㊱有关实验Ⅱ、Ⅲ说明铁生锈一定与㊲有关实验Ⅰ蒸馏水煮沸后使用的原因是㊳结论分析对比实验Ⅰ、Ⅱ、Ⅲ可知,铁生锈的条件是㊴O2H2O除去水中溶解的氧气Fe与O2、H2O同时接触 易错判断1.合金一定由两种或多种金属熔合而成()2.合金都是混合物,属于合成材料()3.金刚石、生铁、氧化铁、磁铁矿都是合金()4.“真金不怕火炼”说明金的化学性质稳定()5.铝具有良好的抗腐蚀性是因为铝很难与氧气发生反应()6.铁丝在氧气中燃烧生成黑色的氧化铁()7.铁与稀盐酸反应:2Fe+6HCl2FeCl3+3H2↑()8.用钢丝球擦洗铝锅表面的氧化物()9.高炉炼铁得到的产物是纯铁()×××√××××× 化学方程式网络构建图9-1 类型一 金属材料1.[2015·厦门]夏天防雷电,远离金属。这是因为金属具有()A.导电性B.导热性C.延展性D.光泽[答案]A[解析]夏天防雷电,远离金属,是因为金属具有导电性。 2.[2016·福州]下列与金属相关的说法正确的是()A.生铁和钢性能完全相同B.炼铁过程中只发生物理变化C.常温下所有金属均为固态D.铁在潮湿的空气中易生锈[答案]D[解析]生铁和钢性能不完全相同,生铁的硬度较大,钢的韧性较强;炼铁是从铁矿石中还原出铁的过程,属于化学变化;常温下金属汞为液态;铁在潮湿的空气中易生锈。 3.拓展下列有关合金说法不正确的是()A.黄铜是混合物B.黄铜和纯铜互相刻划,黄铜上会有划痕C.黄铜比纯铜的抗腐蚀性好D.银的导电性比铜好,但经常用铜作导线[答案]B[解析]所有合金都是混合物;合金的硬度比纯金属要大,所以纯铜上有划痕;合金的抗腐蚀性比纯金属要好;性质并不是决定用途的唯一因素,价格、资源等都会影响物质的用途,银的导电性虽然很好,但价格昂贵,所以不用银作导线。 类型二 金属的化学性质4.[2015·龙岩]锂常被人们誉为“金属味精”。已知锂的核电荷数为3,锂比铝活泼。下列说法错误的是()A.锂是一种金属材料B.锂原子核外有3个电子C.锂具有良好的导电性D.锂不能与盐酸反应D 5.[2016·福州]以下实验能比较出铜和银的金属活动性强弱的是()A.测定两金属的密度B.铜片放入硝酸银溶液中C.将两种金属相互刻划D.铜片、银片分别放入稀硫酸中B 6.[2014·三明]“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利。下列关于鉴别“愚人金”与黄金的实验方案,合理的是()①比较硬度,硬度小的是“愚人金”②灼烧,表面变色的是“愚人金”③浸没在稀硫酸中,表面有气泡产生的是“愚人金”④浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”A.①③B.②④C.②③D.①④[答案]C[解析]②灼烧,铜能够和氧气反应产生氧化铜,表面变黑色的是“愚人金”,无明显变化的是黄金,可以鉴别。③浸没在稀硫酸中,锌能够和稀硫酸反应产生氢气,表面有气泡产生的是“愚人金”,无明显变化的是黄金,可以鉴别。 7.[2016·三明]图9-2中“→”表示一种金属能把另一种金属从其盐溶液中置换出来。则甲、乙、丙三种金属的活动性由强到弱的顺序是()A.甲、乙、丙B.乙、丙、甲C.丙、甲、乙D.甲、丙、乙D图9-2 8.[2015·福州节选]将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式:。图9-3是实验过程中生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是(填序号)。Fe+2HClFeCl2+H2↑图9-3AC 9.[2015·龙岩]回收利用废金属是解决废金属造成的资源浪费和不同程度的环境污染的方法之一。某市一家大型化工厂处理回收含铜废料的生产流程与部分操作如下:(注:步骤Ⅰ得到的残留物不溶于水和稀硫酸)请回答下列问题。(1)黑色固体A的成分是(用化学式表示)。(2)流程图中操作①的名称是。CuO图9-4过滤 9.[2015·龙岩]回收利用废金属是解决废金属造成的资源浪费和不同程度的环境污染的方法之一。某市一家大型化工厂处理回收含铜废料的生产流程与部分操作如下:(注:步骤Ⅰ得到的残留物不溶于水和稀硫酸)请回答下列问题。(3)写出步骤Ⅲ的一个反应的化学方程式:。Fe+CuSO4Cu+FeSO4(合理即可)图9-4 9.[2015·龙岩]回收利用废金属是解决废金属造成的资源浪费和不同程度的环境污染的方法之一。某市一家大型化工厂处理回收含铜废料的生产流程与部分操作如下:(注:步骤Ⅰ得到的残留物不溶于水和稀硫酸)请回答下列问题。(4)通常在步骤Ⅲ必须加入略过量的“铁屑”,原因是_________________________。使CuSO4溶液充分反应图9-4(合理即可) 10.[2015·南平]为探究锌、铜、镍三种金属的性质,某兴趣小组进行如下实验。实验一将三种金属丝分别与一节干电池和小电珠连接,小电珠发光。实验二取粗细、长短相同的锌丝、铜丝、镍丝均与50mL稀盐酸反应,实验记录如下:实验三金属锌、铜和稀盐酸构成如图9-5所示的化学电池装置,观察到铜片表面有气泡(H2),小电珠发光。锌铜镍铜稀盐酸的质量分数3%3%15%15%反应现象少量气泡无现象许多气泡无现象图9-5 (1)实验一的现象说明三种金属都具有性。(2)镍与稀盐酸反应生成氯化镍(NiCl2)和氢气,反应的化学方程式是____________,铜不能与稀盐酸发生化学反应的原因是_____________________________________。(3)要判断三种金属活动性强弱,必须在实验二的基础上增加一个实验才能得出结论,其实验内容是________________________________________________________。导电Ni+2HClNiCl2+H2↑铜不活泼,在金属活动性顺序中排在氢把粗细、长短相同的锌丝、镍丝放入50mL15%的稀的后面盐酸中,观察反应现象(合理即可) 10.[2015·南平]为探究锌、铜、镍三种金属的性质,某兴趣小组进行如下实验。实验一将三种金属丝分别与一节干电池和小电珠连接,小电珠发光。实验二取粗细、长短相同的锌丝、铜丝、镍丝均与50mL稀盐酸反应,实验记录如下:实验三金属锌、铜和稀盐酸构成如图9-5所示的化学电池装置,观察到铜片表面有气泡(H2),小电珠发光。锌铜镍铜稀盐酸的质量分数3%3%15%15%反应现象少量气泡无现象许多气泡无现象图9-5 (4)金属活动性强弱是由金属物质的结构决定的,不会因某个实验而改变。下列关于实验三分析正确的是(填序号)。A.铜的金属活动性变得比锌强B.铜与稀盐酸发生了置换反应C.该装置将化学能转化为电能[答案](4)C[解析](4)铜的金属活动性比锌弱,A错误;铜不能和稀盐酸反应,B错误;该装置将化学能转化为电能,C正确。 11.[2014·宁德节选]黄铜是铜锌合金,铜质量分数为67%~70%。黄铜中锌含量越高硬度越大。某兴趣小组对纯铜和黄铜进行以下探究。实验Ⅲ测定黄铜中铜的质量分数方法一:利用如图9-6所示实验测定黄铜中铜的质量分数(1)将④的锥形瓶中固体和溶液分离的操作名称是,所得固体经洗涤、干燥、称量,质量为1.35g。图9-6 [答案](1)过滤[解析](1)实验室中将固体和液体分离的操作是过滤。 11.[2014·宁德节选]黄铜是铜锌合金,铜质量分数为67%~70%。黄铜中锌含量越高硬度越大。某兴趣小组对纯铜和黄铜进行以下探究。实验Ⅲ测定黄铜中铜的质量分数方法一:利用如图9-6所示实验测定黄铜中铜的质量分数(2)黄铜中铜的质量分数为。图9-6 [答案](2)67.5%[解析](2)黄铜中铜的质量分数为×100%=67.5%。 11.[2014·宁德节选]黄铜是铜锌合金,铜质量分数为67%~70%。黄铜中锌含量越高硬度越大。某兴趣小组对纯铜和黄铜进行以下探究。实验Ⅲ测定黄铜中铜的质量分数方法二:利用如图9-7所示实验测定黄铜中铜的质量分数(3)根据电子秤读数,可得黄铜样品粉末与稀硫酸反应生成氢气g。图9-7 [答案](3)0.03[解析](3)根据反应前后物质的总质量不变,产生氢气的质量为2g+10g+80g-91.97g=0.03g。 11.[2014·宁德节选]黄铜是铜锌合金,铜质量分数为67%~70%。黄铜中锌含量越高硬度越大。某兴趣小组对纯铜和黄铜进行以下探究。实验Ⅲ测定黄铜中铜的质量分数方法二:利用如图9-7所示实验测定黄铜中铜的质量分数(4)方法二测得黄铜中铜的质量分数明显偏低,可能原因是(写一种)。图9-7 [答案](4)氢气将水蒸气带出(或水蒸发)[解析](4)方法二中水蒸气被氢气带出装置,导致装置减少的质量偏大,所以计算得到锌的质量偏大,则铜的质量分数偏小。 类型三 金属的冶炼12.[2015·龙岩]如图9-8为“一氧化碳与氧化铁反应”的实验装置。该反应利用CO的还原性,将Fe2O3中的铁还原出来。(1)写出高温条件下CO与Fe2O3反应的化学方程式:。(2)实验过程中,常在实验装置末端的导管口放一盏燃着的酒精灯(灯焰处于导管口),这样做的目的是________________。(3)通过B装置可检验A中的生成物含有CO2,该反应的化学方程式为。图9-83CO+Fe2O32Fe+3CO2防止反应剩余Ca(OH)2+CO2CaCO3↓+H2O的一氧化碳逸散,污染空气 12.[2015·龙岩]如图9-8为“一氧化碳与氧化铁反应”的实验装置。该反应利用CO的还原性,将Fe2O3中的铁还原出来。(4)在此实验中,我们还认识到CO和CO2的化学性质有许多的不同。①请写出其中的一点:。②试从微观的角度分析CO和CO2化学性质不同的原因是______________________。图9-8一氧化碳可燃,二氧化碳不可燃CO与CO2分子的结构不同 13.[2019·福建]《天工开物》中介绍了锌的冶炼方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐(如图9-9所示),泥封。“其底铺薪,发火煅红”“冷定毁罐取出”。(已知:锌的熔点为419℃,沸点为907℃)(1)反应区中,ZnCO3分解生成ZnO和另一种氧化物,反应的化学方程式为。C与ZnO发生置换反应得到Zn,反应图9-9 [答案](1)ZnCO3ZnO+CO2↑C(或碳)[解析](1)碳酸锌加热分解生成氧化锌和二氧化碳,反应的化学方程式为ZnCO3ZnO+CO2↑;C与ZnO反应生成Zn和CO2,反应前碳元素的化合价为0,反应后碳元素的化合价变为+4,故化合价升高的元素是碳。 13.[2019·福建]《天工开物》中介绍了锌的冶炼方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐(如图9-9所示),泥封。“其底铺薪,发火煅红”“冷定毁罐取出”。(已知:锌的熔点为419℃,沸点为907℃)(2)冷凝区中,锌由气态转化为液态,理论上该区应控制的温度范围是℃。图9-9 [答案](2)419~907[解析](2)锌的熔点为419℃,沸点为907℃,故锌由气态变为液态的温度范围为419~907℃。 13.[2019·福建]《天工开物》中介绍了锌的冶炼方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐(如图9-9所示),泥封。“其底铺薪,发火煅红”“冷定毁罐取出”。(已知:锌的熔点为419℃,沸点为907℃)(3)“冷定”后方能“毁罐”取锌,从化学变化角度解释其原因:。图9-9 [答案](3)防止生成的锌在较高温度下又被氧化成氧化锌(或2Zn+O22ZnO)[解析](3)锌在较高温度下能和氧气反应生成氧化锌,故应冷却后再取锌。 类型四 金属的锈蚀条件及保护14.[2017·福建]下列四支试管中,铁钉锈蚀最快的是()图9-10 [答案]D[解析]铁生锈的条件是铁与氧气和水共同接触,氯化钠会加快铁生锈的速率,所以D中铁钉生锈速度最快。 15.[2014·宁德节选]黄铜是铜锌合金,铜质量分数为67%~70%。黄铜中锌含量越高硬度越大。某兴趣小组对纯铜和黄铜进行以下探究。实验Ⅰ区别纯铜和黄铜方法一:将黄铜片和纯铜片互相刻划(1)观察到纯铜表面有刻痕,说明纯铜硬度(填“大于”或“小于”)黄铜。方法二:在纯铜和黄铜中分别加入稀硫酸(2)观察到有气泡产生的是黄铜,反应的化学方程式是。小于Zn+H2SO4ZnSO4+H2↑ 15.[2014·宁德节选]黄铜是铜锌合金,铜质量分数为67%~70%。黄铜中锌含量越高硬度越大。某兴趣小组对纯铜和黄铜进行以下探究。实验Ⅱ比较黄铜与纯铜抗锈蚀能力资料:铜锈蚀是铜与空气中的O2、H2O、CO2作用生成Cu2(OH)2CO3(绿色固体)该兴趣小组设计了如图9-11所示两个实验方案:图9-11 (3)方案一存在的问题是。(4)小组同学按方案二进行实验,一段时间后发现B试管固体表面出现绿色较为明显。由此可知(填“黄铜”或“纯铜”)抗锈蚀性较强。[答案](3)没有在相同条件下进行对比实验(或其他合理答案)(4)黄铜[解析](3)比较黄铜与纯铜的抗锈蚀性能,需要采取控制变量法,即除黄铜和纯铜不同之外,其他的条件必须相同,方案一中两物质所处的环境不同,无法比较抗锈蚀性能是否相同。(4)B试管中盛放的是纯铜,表面绿色较明显说明纯铜锈蚀严重,则黄铜的抗锈蚀性较强。 16.拓展[2019·内江]下列有关金属资源的利用与防护不合理的是()A.经常用钢丝球擦洗铝锅表面,保持洁净B.在钢铁表面喷油漆可防止生锈C.废旧金属的回收利用,是保护金属资源的有效途径之一D.改变金属的组成和结构,铸造成合金材料可优化其性能[答案]A[解析]铝的化学性质较活泼,在常温下能与空气中的氧气发生反应,生成致密的氧化物保护膜,保护内部的铝不被氧化或腐蚀,常用钢丝球擦洗铝制品表面会缩短铝制品的使用寿命。查看更多