- 2021-08-24 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第三章水溶液中的离子平衡第四节难溶电解质的溶解平衡同步练习新人教版选修42
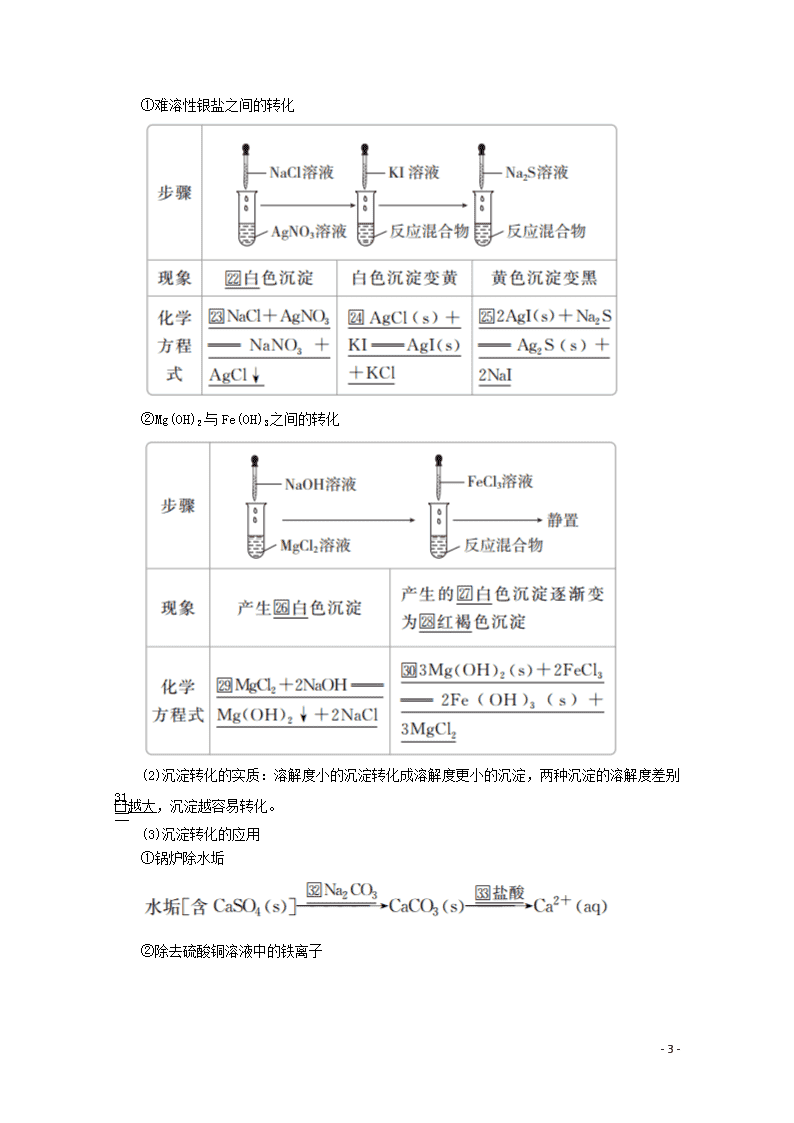
第四节 难溶电解质的溶解平衡 [明确学习目标] 1.了解难溶电解质的沉淀溶解平衡。2.了解沉淀转化的本质。3.学会用沉淀溶解平衡理论解决生产、生活中的实际问题。 一、沉淀溶解平衡 1.25 ℃时,溶解性与溶解度的关系 2.沉淀溶解平衡 (1)概念:在一定温度下,当沉淀溶解的速率和沉淀形成的速率相等时,即达到溶解平衡。 (2)图示 (3)表示方法:以AgCl为例,溶解平衡可表示为 AgCl(s)Ag+(aq)+Cl-(aq)。 (4)特征 二、沉淀反应的应用 1.沉淀的生成 (1)沉淀生成的应用 在涉及无机制备、提纯、废水处理等领域,常利用生成沉淀来达到分离或除去某些离子的目的。 - 9 - (2)沉淀生成的方法 ①调节pH法:如工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可使Fe3+转变为Fe(OH)3沉淀而除去。 ②加沉淀剂法:如以Na2S、H2S等作沉淀剂,使某些金属离子如Cu2+、Hg2+等生成极难溶的硫化物CuS、HgS等沉淀,是除去杂质常用的方法。其离子反应如下: Cu2++S2-===CuS↓ Cu2++H2S===CuS↓+2H+ Hg2++S2-===HgS↓ Hg2++H2S===HgS↓+2H+ 2.沉淀的溶解 (1)沉淀溶解的原理 根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。 (2)溶解方法 ①酸溶解法:利用较强的酸溶解较弱酸的难溶盐。如CaCO3难溶于水,却易溶于盐酸,过程可表示为 CaCO3(s)Ca2+(aq)+CO(aq),CO+H+HCO,HCO+H+H2CO3,H2CO3===H2O+CO2↑。随着CO浓度的减少,沉淀溶解平衡不断右移,CaCO3逐渐溶解。 ②盐溶液溶解法: 3.沉淀的转化 (1)沉淀转化实验 - 9 - ①难溶性银盐之间的转化 ②Mg(OH)2与Fe(OH)3之间的转化 (2)沉淀转化的实质:溶解度小的沉淀转化成溶解度更小的沉淀,两种沉淀的溶解度差别越大,沉淀越容易转化。 (3)沉淀转化的应用 ①锅炉除水垢 ②除去硫酸铜溶液中的铁离子 - 9 - 1.常温下,分别将AgCl溶于水和0.1 mol·L-1的NaCl溶液中,其溶解度相同吗?为什么? 提示:不同。在NaCl溶液中,Cl-的存在会导致AgCl(s)Ag+(aq)+Cl-(aq)向左移动,使AgCl溶解度变得更小。 2.如果要除去某溶液中的SO,你选择加入钙盐还是钡盐?为什么? 提示:加入可溶性钡盐。因为BaSO4的溶解度比CaSO4的溶解度小,用Ba2+沉淀SO更完全。 一、沉淀溶解平衡 1.沉淀溶解平衡及其影响因素 (1)沉淀溶解平衡是指固体沉淀与溶液中相关离子间的平衡关系,包含了沉淀的溶解和溶解后的电解质的电离过程。如:BaSO4(s)Ba2+(aq)+SO(aq)包含了 BaSO4(s)BaSO4(aq)和BaSO4(aq)===Ba2+(aq)+SO(aq)两个过程。因此溶解平衡的电离方程式必须标明状态(s)、(aq)。 (2)影响沉淀溶解平衡的因素 影响因素 沉淀溶解平衡 内因 电解质本身的性质 外因 温度 温度升高,向吸热方向进行 稀释 向溶解方向移动 同离子效应 加入相同离子,向生成沉淀的方向移动 2.溶度积(Ksp) (1)概念:在一定温度下,在难溶电解质的饱和溶液中,电离出的各离子浓度幂的乘积为一个常数,称为溶度积常数,简称溶度积,用符号Ksp表示。 (2)表达式:对于溶解平衡 MmAn(s)mMn+(aq)+nAm-(aq) Ksp=cm(Mn+)·cn(Am-) (3)意义 溶度积(Ksp)反映了物质在水中的溶解能力。 (4)影响因素 - 9 - 溶度积常数只与难溶性电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关。大多数物质,温度升高,溶度积增大。 [即时练] 1.在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量氧化钙固体时,下列说法正确的是( ) A.c(Ca2+)增大 B.c(Ca2+)不变 C.c(OH-)增大 D.Ca(OH)2固体的质量不变 答案 B 解析 在一定温度下,Ca(OH)2已经达到饱和(石灰乳悬浊液),当加入少量CaO固体时,CaO+H2O===Ca(OH)2,不考虑温度变化,仍为饱和溶液,故c(Ca2+)、c(OH-)均不变,Ca(OH)2固体质量增加。 2.下列说法正确的是( ) A.溶度积小的物质一定比溶度积大的物质溶解度小 B.对同类型的难溶物,溶度积小的一定比溶度积大的溶解度小 C.难溶物质的溶度积与温度无关 D.难溶物的溶解度仅与温度有关 答案 B 解析 A项,没有指明具体的温度,也没指明具体是否为同一类物质,错误;C项,溶度积显然与温度有关,当温度升高时,固体物质的溶解度一般会增大,其溶度积一般也增大,错误;D项,难溶物的溶解度不仅与温度有关,还与溶剂中是否存在难溶物中的离子有关。 规律方法 Ksp的理解 (1)Ksp反映了难溶电解质在水中的溶解能力,当物质的化学式所表示的阴、阳离子个数比相同时,Ksp越大,溶解度越大。 (2)对于化学式中阴、阳离子个数比不同的难溶电解质,不能直接用Ksp的大小来比较其溶解度的大小。 (3)可以利用Ksp来计算饱和溶液中某种离子的浓度,由溶液体积计算出溶解的溶质的物质的量 。二、沉淀反应的应用 1.沉淀的生成 (1)沉淀生成时沉淀剂的选择原则 ①使生成沉淀的反应进行得越完全越好(被沉淀离子形成沉淀的Ksp尽可能地小,即沉淀溶解度越小越好)。 如除去废水中的Cu2+,可以使Cu2+转化成CuCO3、Cu(OH)2或CuS,依据三者溶解度的大小可知,应选择沉淀剂使废水中的Cu2+转化成溶解度最小的CuS。 - 9 - ②不能影响其他离子的存在,由沉淀剂引入溶液的杂质离子要便于除去或不引入新的杂质离子。 (2)常用的沉淀方法 ①调节pH法 通过调节溶液的pH,使溶液中的杂质离子转化成沉淀而除去。 ②直接沉淀法 通过沉淀剂除去溶液中的某种指定离子或获取该难溶电解质。 2.沉淀的溶解 沉淀溶解时的关键步骤是加入的试剂能与产生沉淀的离子发生反应,生成挥发性物质(气体)或弱电解质(弱酸、弱碱或水),使平衡向沉淀溶解的方向移动,使沉淀溶解的常用方法主要有三种: (1)加入适当试剂,使其与溶液中某种离子结合生成弱电解质。 (2)加入适当氧化剂或还原剂,与溶液中某种离子发生氧化还原反应。 (3)加入适当试剂,与溶液中某种离子结合生成配合物。 3.沉淀的转化 (1)沉淀转化的实质是沉淀溶解平衡的移动。一般是溶解度小的沉淀会转化生成溶解度更小的沉淀。 (2)当一种试剂能沉淀溶液中几种离子时,生成沉淀所需试剂离子浓度越小的越先沉淀;如果生成各种沉淀所需试剂离子的浓度相差较大,就能分步沉淀,从而达到分离离子的目的。 (3)溶解度较小的沉淀在一定条件下也可以转化成溶解度较大的沉淀,如在BaSO4的饱和溶液中加入高浓度的Na2CO3溶液,也可以转化成溶解度较大的BaCO3沉淀。 4.溶度积与离子积的关系 通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积Qc的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解: Qc>Ksp,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。 Qc=Ksp,溶液饱和,沉淀与溶解处于平衡状态。 Qc查看更多