- 2021-08-24 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高中化学 第4章 材料家族中的元素
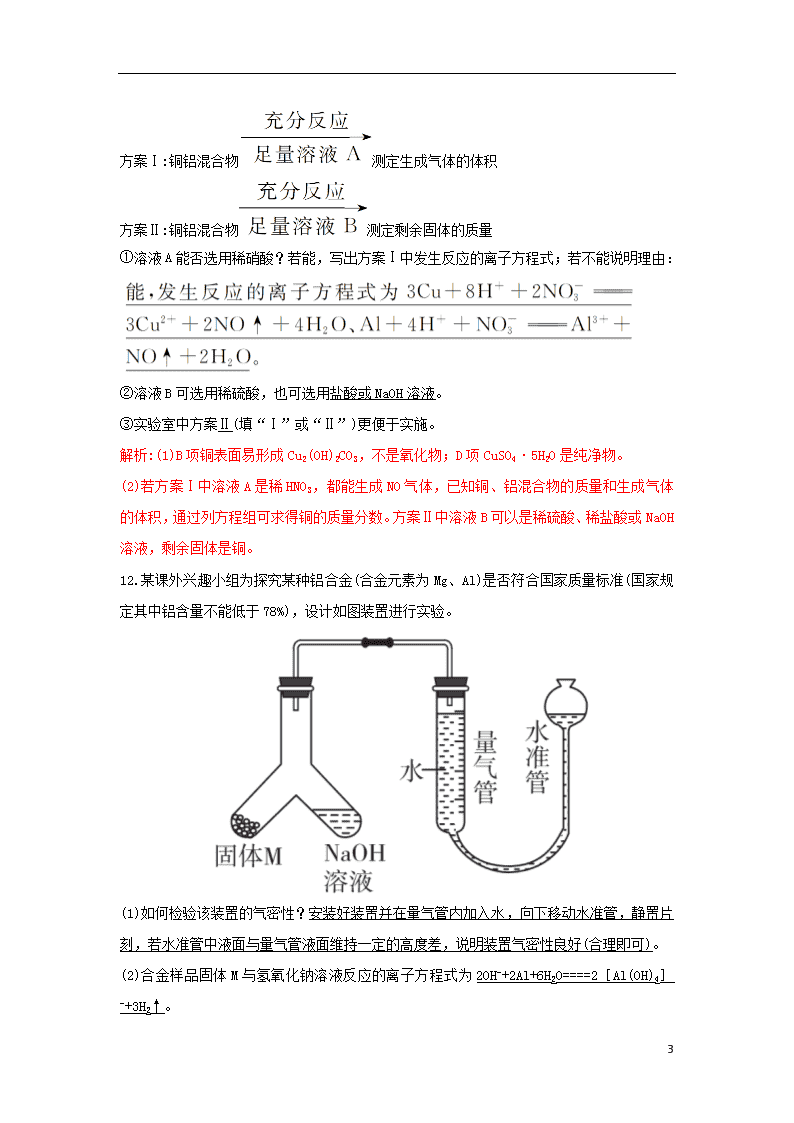
4.2.2 铝的重要化合物金属材料 1.某无色透明溶液,能与铝作用产生氢气,则此溶液中一定可以大量共存的离子组是(A) A.K+、Na+、Cl- B.K+、Cu2+、 C.Cl-、、Mg2+ D.Ba2+、、Na+ 2.下列离子方程式书写正确的是(D) A.氯化铝溶液中加入过量的氨水: Al3++4NH3·H2O====[Al(OH)4]-+4 B.澄清石灰水与小苏打溶液混合: C.Na[Al(OH)4]溶液中加入过量盐酸: [Al(OH)4]-+H+====Al(OH)3↓+H2O D.氯化亚铁溶液中通入氯气: 2Fe2++Cl2====2Fe3++2Cl- 3.现有MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl五种溶液,只用一种试剂把它们区别开,这种试剂是(C) A.氨水 B.AgNO3溶液 C.NaOH溶液 D.NaCl溶液 4.用铝包裹0.1 mol金属钠,用针扎出一些小孔,放入水中,完全反应后,用排水法收集产生的气体,则收集到的气体为(标准状况下)(C) A.O2和H2混合气体 B.1.12 L H2 C.大于1.12 L H2 D.1.12 L气体 5.下列关于铜的说法不正确的是(A) A.铜长期放置在潮湿的空气中容易生锈,生成Cu(OH)2 B.铜丝在氯气中燃烧生成CuCl2,而与硫反应生成Cu2S,说明氧化性Cl2>S C.CuO不及Cu2O稳定,高温条件下CuO可以分解生成Cu2O和氧气 4 D.蓝色的CuSO4·5H2O可以受热分解转化为白色的CuSO4 6.下列物质中既能跟稀硫酸反应,又能跟NaOH溶液反应的是(D) ①NaHCO3②(NH4)2S③Al2O3④Al(OH)3⑤Al A.③④ B.③④⑤ C.①③④⑤ D.全部 7.被严重腐蚀了的铜和铁共同放入盐酸中充分反应后,剩余残渣中只有铜,则溶液中含有的金属阳离子为(D) A.一定只含有Fe2+ B.可能只含Cu2+ C.一定有Fe2+和Cu2+ D.一定有Fe2+,可能有Cu2+ 8.有两种金属的合金12 g,与足量稀硫酸反应后,产生的气体在标准状况下体积为11.2 L,则该合金一定含有(C) A.Mg B.Fe C.Al D.Na 9.(双选)某溶液中有NH+4、Mg2+、Fe2+、Al3+四种离子,若向其中加入过量氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是(AC) A. B.Mg2+ C.Fe2+ D.Al3+ 10.有200 mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)为0.2 mol/L,c(Cl-)为1.3 mol/L,要使Mg2+全部转化为沉淀从溶液中分离出来,至少需要加4 mol/L NaOH溶液的体积为(C) A.40 mL B.70 mL C.80 mL D.128 mL 11.铜是生产生活中用量较多的金属。 (1)下列有关铜元素的说法中,不正确的是BD(填字母)。 A.青铜、不锈钢、硬铝都是合金 B.铜表面易形成致密的氧化膜 C.铜与O2反应,生成黑色的CuO D.CuSO4·5H2O是一种混合物,加热后变为白色的固体 (2)某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案: 4 方案Ⅰ:铜铝混合物测定生成气体的体积 方案Ⅱ:铜铝混合物测定剩余固体的质量 ①溶液A能否选用稀硝酸?若能,写出方案Ⅰ中发生反应的离子方程式;若不能说明理由: ②溶液B可选用稀硫酸,也可选用盐酸或NaOH溶液。 ③实验室中方案Ⅱ(填“Ⅰ”或“Ⅱ”)更便于实施。 解析:(1)B项铜表面易形成Cu2(OH)2CO3,不是氧化物;D项CuSO4·5H2O是纯净物。 (2)若方案Ⅰ中溶液A是稀HNO3,都能生成NO气体,已知铜、铝混合物的质量和生成气体的体积,通过列方程组可求得铜的质量分数。方案Ⅱ中溶液B可以是稀硫酸、稀盐酸或NaOH溶液,剩余固体是铜。 12.某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图装置进行实验。 (1)如何检验该装置的气密性?安装好装置并在量气管内加入水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装置气密性良好(合理即可)。 (2)合金样品固体M与氢氧化钠溶液反应的离子方程式为2OH-+2Al+6H2O====2[Al(OH)4]-+3H2↑。 4 (3)倾斜左边装置使氢氧化钠溶液(足量)与a g合金粉末充分反应,待反应停止后,进入量气管气体的体积为V mL(已折算成标准状况)。若量气管最大量程为],则合金中铝的质量[m(Al)]范围为0<m(Al)<0.04 g[或m(Al)<0.04 g]。 (4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积>(填“>”“<”或“=”)V mL。 (5)若a=38 mg,V=44.8 mL(标准状况),请通过计算说明该合金符合(填“符合”或“不符合”)国家标准(不写计算过程)。 解析:(3)m(Al)<×27 g·mol-1≈0.04 g。 (4)因为盐酸与Mg、Al均反应,所以生成的氢气体积大于V mL。 (5)m(Al)=×27 g·mol-1=0.036 g,铝含量=×100%≈95%。故铝含量符合国家标准。 4查看更多