- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习课时提升作业九氯溴碘及其化合物含解析苏教版
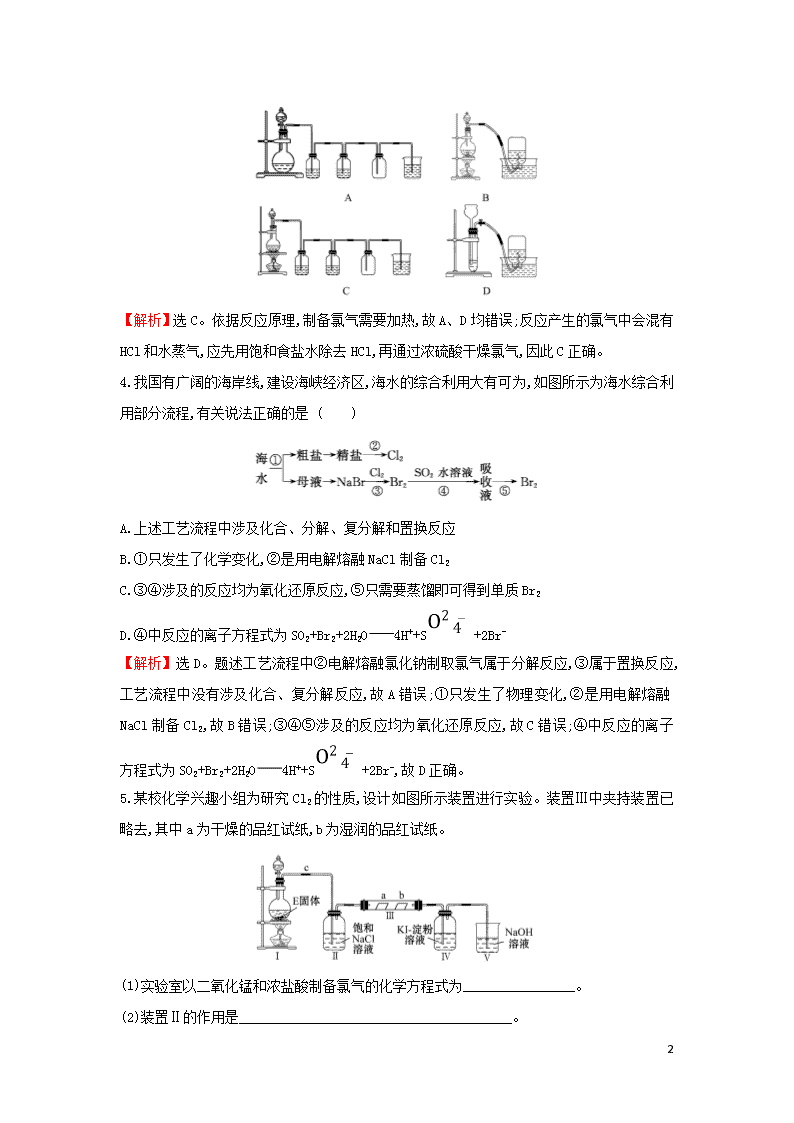
氯、溴、碘及其化合物 1.分别向盛有Cl2的五个集气瓶甲、乙、丙、丁、戊中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙、丁、戊注入的液体分别是 ( ) ①AgNO3溶液;②NaOH溶液;③水;④淀粉KI溶液;⑤NaBr溶液 A.④①②⑤③ B.①③④②⑤ C.③②④①⑤ D.②①③④⑤ 【解析】选D。氯气能被氢氧化钠溶液吸收生成氯化钠、次氯酸钠和水,因此气体和溶液都是无色的,所以甲集气瓶对应②;氯气和硝酸银溶液反应生成白色沉淀氯化银,而气体变为无色,则乙集气瓶对应①;氯气在水中的溶解度不大,氯气溶于水即得到氯水,气体颜色变浅,而氯水显浅黄绿色,则丙集气瓶对应③;氯气具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,所以集气瓶丁对应④;氯气具有氧化性,能把溴化钠氧化生成单质溴,溴水显橙黄色,则集气瓶戊对应⑤,所以答案选D。 2.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是 ( ) A.向NaHCO3固体中加入新制的氯水,有无色气泡产生(H+) B.新制氯水使红色布条褪色(HClO) C.将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-) D.向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,溶液呈红色(HCl) 【解析】选D。A项,新制氯水中存在H+,能与NaHCO3反应产生CO2;B项,新制氯水中存在HClO,具有漂白性,能使红色布条褪色;C项,Ag+与氯水中的Cl-反应生成白色沉淀AgCl;D项,因氯水中含有氧化性的HClO和Cl2,可将F氧化成F,F与SCN-反应使溶液变红色。 3.实验室制备Cl2通常采用下列反应:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;据此,从如图所示仪器装置中选择制备并收集干燥、纯净Cl2的装置是 ( ) 7 【解析】选C。依据反应原理,制备氯气需要加热,故A、D均错误;反应产生的氯气中会混有HCl和水蒸气,应先用饱和食盐水除去HCl,再通过浓硫酸干燥氯气,因此C正确。 4.我国有广阔的海岸线,建设海峡经济区,海水的综合利用大有可为,如图所示为海水综合利用部分流程,有关说法正确的是 ( ) A.上述工艺流程中涉及化合、分解、复分解和置换反应 B.①只发生了化学变化,②是用电解熔融NaCl制备Cl2 C.③④涉及的反应均为氧化还原反应,⑤只需要蒸馏即可得到单质Br2 D.④中反应的离子方程式为SO2+Br2+2H2O4H++S+2Br- 【解析】选D。题述工艺流程中②电解熔融氯化钠制取氯气属于分解反应,③属于置换反应,工艺流程中没有涉及化合、复分解反应,故A错误;①只发生了物理变化,②是用电解熔融NaCl制备Cl2,故B错误;③④⑤涉及的反应均为氧化还原反应,故C错误;④中反应的离子方程式为SO2+Br2+2H2O4H++S+2Br-,故D正确。 5.某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。 (1)实验室以二氧化锰和浓盐酸制备氯气的化学方程式为________________。 (2)装置Ⅱ的作用是_______________________________________。 7 (3)实验过程中,装置Ⅳ中的实验现象为________________;发生反应的化学方程式为_____________________________________。 (4)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置________与________之间添加如图中的________装置(填序号),该装置的作用是______________________。 (5)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式: ________________________________________________。 【解析】(1)实验室用二氧化锰和浓盐酸在加热的条件下制备氯气。(2)加热时浓盐酸中的氯化氢气体易挥发,会导致氯气中混有HCl杂质,装置Ⅱ的作用是除去氯气中的氯化氢气体。(3)氯气的氧化性大于碘,故氯气能把KI中的碘置换出来,所以装置Ⅳ中的实验现象为无色溶液变蓝色。(4)从装置Ⅱ出来的是湿润的氯气,能够使干燥的品红试纸褪色,要观察到“a无明显变化”这一预期现象,需要在Ⅱ与Ⅲ之间添加装置④来干燥Cl2。(5)防止尾气污染空气,用氢氧化钠溶液除去氯气。 答案:(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2)除去氯气中的氯化氢气体 (3)无色溶液变蓝色 Cl2+2KII2+2KCl (4)Ⅱ Ⅲ ④ 干燥Cl2 (5)Cl2+2OH-Cl-+ClO-+H2O 1.有关氯及其化合物的说法,正确的是 ( ) A.以氯气和石灰乳为原料制取漂白粉 B.氯碱工业中,阳极得到烧碱 C.可在“84”消毒液中加入洁厕灵(主要成为HCl)以增强漂白性 D.Cl2能使湿润的有色布条褪色,所以Cl2具有漂白性 【解析】选A。工业上用氯气与石灰乳反应制备漂白粉,二者反应生成氯化钙、次氯酸钙和水,故A正确;电解池的阳极上是阴离子氯离子发生失电子的氧化反应,即生成氯气, 7 阴极得到氢氧化钠和氢气,故B错误;洁厕灵(主要成分:HCl)与“84”消毒液(主要成分NaClO)混合发生反应ClO-+2H++Cl-Cl2↑+H2O,产生有毒气体氯气,可能发生中毒事故,故C错误;Cl2能使湿润的有色布条褪色,是因为氯气与水反应生成次氯酸,次氯酸具有漂白性,氯气不具有漂白性,故D错误。 2.某研究性学习小组的同学利用MnO2、浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置(数量可满足需要,不含制气装置)如下,下列说法正确的是 ( ) A.按气流流动的先后顺序,装置连接顺序依次为dacbe B.按气流流动的先后顺序,装置连接顺序依次为dabae C.装置e的主要用途是制备NaClO D.若实验中使用到装置c且布条褪色,则说明湿润的氯气有漂白性 【解析】选B。为确定氯气有无漂白性,需要进入到装置b中的氯气中不含HCl及水蒸气,故应先用饱和食盐水除去HCl,再用浓硫酸除去水,为防止装置e中的水蒸气进入装置b中,在装置b、e之间还应加装一个装置a,尾气用NaOH溶液吸收,A、C错误,B正确;由装置b中现象可判断Cl2有无漂白性,湿润有色布条褪色是因氯气与水反应生成的HClO引起的,D错误。 3.CsICl2常用于化学上的分子筛技术,CaOCl2常用于漂白、消毒。下列判断正确的是 ( ) A.CsICl2、CaOCl2中的卤族元素都显-1价 B.向CaOCl2溶液中滴加稀硫酸可能产生黄绿色气体 C.CsICl2溶液不能使酸性高锰酸钾溶液褪色 D.向CsICl2、CaOCl2溶液中分别滴加硫酸亚铁溶液,均无明显颜色变化 【解析】选B。CsICl2中碘为+1价,氯为-1价,可以看成CsCl·ICl,CaOCl2可以看成Ca(ClO)Cl,ClO-中Cl显+1价,A项错误;向CaOCl2溶液中滴加稀硫酸,反应的离子方程式为ClO-+Cl-+2H+Cl2↑+H2O,B项正确;CsICl2溶液与酸性高锰酸钾溶液可发生反应2Mn+10Cl-+16H+2Mn2++5Cl2↑+8H2O,溶液褪色,C项错误;向CaOCl2溶液中滴加硫酸亚铁溶液,ClO-与Fe2+发生氧化还原反应,产生红褐色沉淀,D项错误。 4.碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在, 7 几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是 ( ) A.可用淀粉KI试纸和食醋检验加碘盐中是否含有碘 B.足量Cl2能使湿润的淀粉KI试纸变白的原因可能是5Cl2+I2+6H2O2HIO3+10HCl C.由图可知氧化性的强弱顺序为Cl2>I2>I D.途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA 【解析】选C。加碘盐中含有I,在酸性条件下可被I-还原生成I2,淀粉KI试纸会变蓝,A正确;根据图示转化关系可知原因可能是5Cl2+I2+6H2O2HIO3 +10HCl,B正确;根据途径Ⅰ可知氧化性:Cl2>I2,根据途径Ⅱ可知氧化性:I>I2,根据途径Ⅲ可知氧化性:Cl2>I,C错误;根据关系式:2I~I2~10e-可知,若生成1 mol I2,反应中转移的电子数为10NA,D正确。 【加固训练】 下列有关Ca(ClO)2溶液的叙述正确的是 ( ) A.该溶液中,K+、Cl-、HCOOH、I-可以大量共存 B.与Na2SO3反应的离子方程式:ClO-+SS+Cl- C.不可使用pH试纸测定该溶液的pH D.1 L 0.1 mol·L-1该溶液和足量的CO2充分反应,产生10 g沉淀 【解析】选C。ClO-、I-发生氧化还原反应,不能大量共存,故A错误;与Na2SO3反应的离子方程式为C+ClO-+SCaSO4↓+Cl-,故B错误;溶液具有漂白性,则不可使用pH试纸测定该溶液的pH,可选pH计测定,故C正确;和足量的CO2充分反应,生成碳酸氢钙和HClO,则不能生成沉淀,故D错误。 5.海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-、I-、S、Na+、Mg2+、Ca2+等,都是重要资源。开发和利用海水资源是当前科学研究的一项重要任务,如图是某化工厂对海水资源综合利用的示意图: 7 请根据以上信息回答下列问题: (1)写出步骤②、⑧分离提纯的方法: ②________ ⑧________。 (2)步骤⑦分离提纯过程中需要选用的玻璃仪器除烧杯外,还需要的仪器是________。 (3)D具有杀菌消毒的作用,请写出反应④的化学方程式_________________。 (4)初步提纯后的粗盐中含有Ca2+、Mg2+、S等杂质,精制时所用的试剂为①盐酸 ②氯化钡溶液 ③氢氧化钠溶液 ④碳酸钠溶液,下列试剂添加顺序合理的是__________。 A.②③④① B.③④②① C.④③②① D.③②④① (5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是____________。 A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环 (6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有________性。 【解析】(1)步骤②为过滤,⑧为从有机溶剂中提取碘单质,需要蒸馏。(2)步骤⑦分离提纯方法为萃取,主要玻璃仪器为分液漏斗、烧杯。(3)反应④是氯气和氢氧化钠反应生成次氯酸钠、氯化钠和水,方程式Cl2+2NaOHNaCl+NaClO+H2O。(4)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,但是加入的碳酸钠要放在加入氯化钡之后,这样碳酸钠会同时除去过量的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为②③④①或③②④①。(5)若要提取Br2,反应⑤所用的氧化剂为氯气,本厂电解氯化钠溶液生产烧碱,产物中有氯气。(6)溴单质具有挥发性,所以流程⑥将溴单质从水溶液中分离出来是基于溴单质具有挥发性。 答案:(1)过滤 蒸馏 (2)分液漏斗 7 (3)Cl2+2NaOHNaCl+NaClO+H2O (4)A、D (5)C (6)挥发 7查看更多