- 2021-08-24 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学高考题型对点练十一实验综合含解析
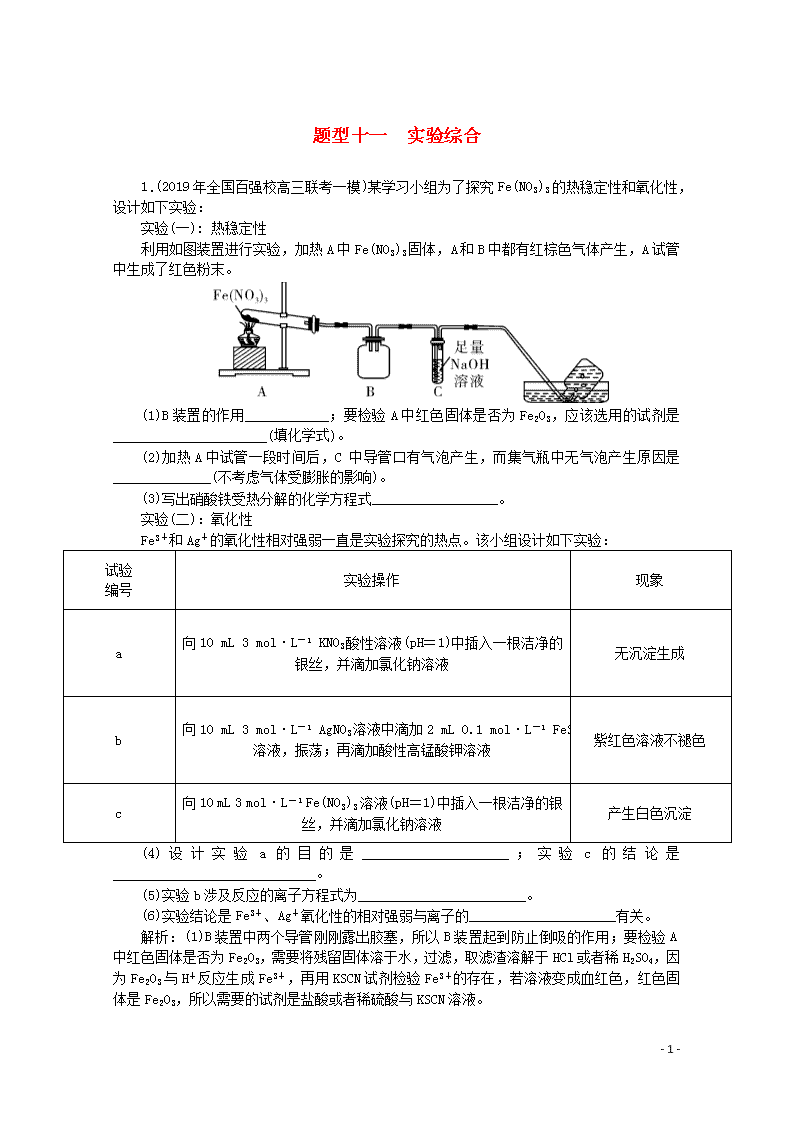
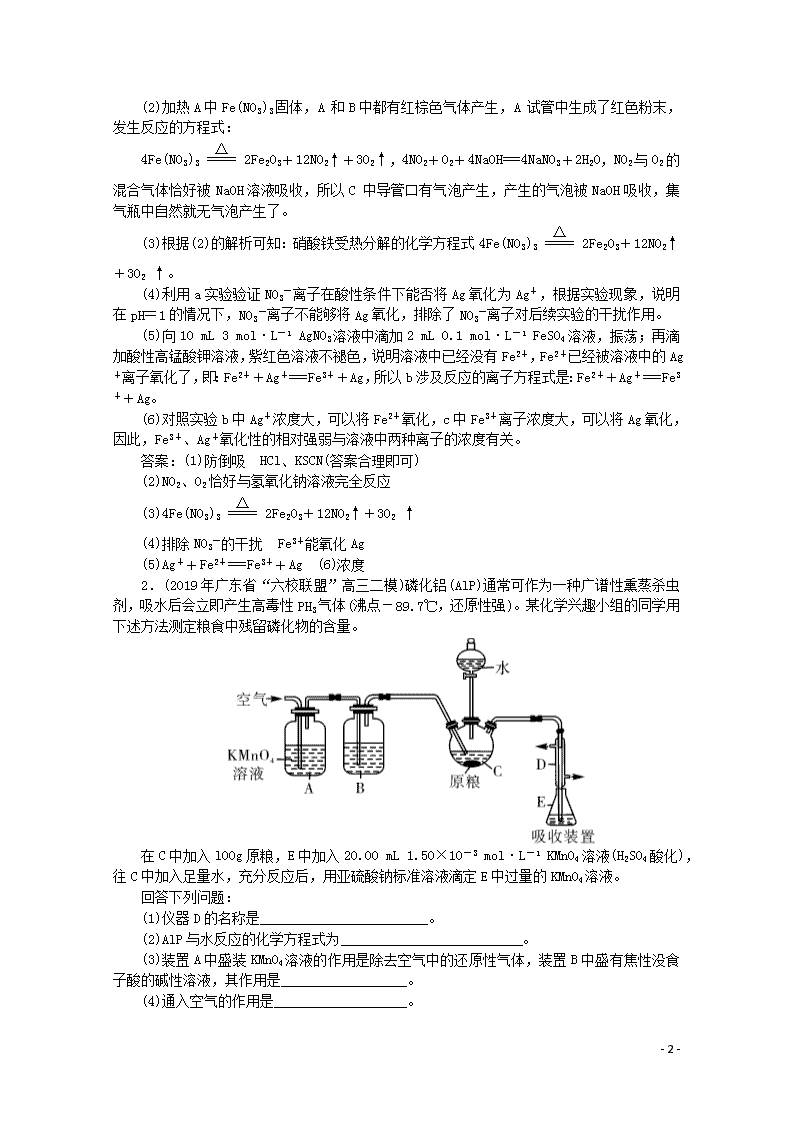
题型十一 实验综合 1.(2019年全国百强校高三联考一模)某学习小组为了探究Fe(NO3)3的热稳定性和氧化性,设计如下实验: 实验(一): 热稳定性 利用如图装置进行实验,加热A中Fe(NO3)3固体,A 和B中都有红棕色气体产生,A 试管中生成了红色粉末。 (1)B装置的作用____________;要检验A中红色固体是否为Fe2O3,应该选用的试剂是______________________(填化学式)。 (2)加热A中试管一段时间后,C 中导管口有气泡产生,而集气瓶中无气泡产生原因是______________(不考虑气体受膨胀的影响)。 (3)写出硝酸铁受热分解的化学方程式__________________。 实验(二):氧化性 Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点。该小组设计如下实验: 试验 编号 实验操作 现象 a 向10 mL 3 mol·L-1 KNO3酸性溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 无沉淀生成 b 向10 mL 3 mol·L-1 AgNO3溶液中滴加2 mL 0.1 mol·L-1 FeSO4溶液,振荡;再滴加酸性高锰酸钾溶液 紫红色溶液不褪色 c 向10 mL 3 mol·L-1 Fe(NO3)3溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 产生白色沉淀 (4)设计实验a的目的是_____________________;实验c的结论是_____________________________。 (5)实验b涉及反应的离子方程式为________________________。 (6)实验结论是Fe3+、Ag+氧化性的相对强弱与离子的_____________________有关。 解析:(1)B装置中两个导管刚刚露出胶塞,所以B装置起到防止倒吸的作用;要检验A中红色固体是否为Fe2O3,需要将残留固体溶于水,过滤,取滤渣溶解于HCl或者稀H2SO4,因为Fe2O3与H+反应生成Fe3+,再用KSCN试剂检验Fe3+的存在,若溶液变成血红色,红色固体是Fe2O3,所以需要的试剂是盐酸或者稀硫酸与KSCN溶液。 - 6 - (2)加热A中Fe(NO3)3固体,A 和B中都有红棕色气体产生,A 试管中生成了红色粉末,发生反应的方程式: 4Fe(NO3)32Fe2O3+12NO2↑+3O2 ↑,4NO2+O2+4NaOH===4NaNO3+2H2O,NO2与O2的混合气体恰好被NaOH溶液吸收,所以C 中导管口有气泡产生,产生的气泡被NaOH吸收,集气瓶中自然就无气泡产生了。 (3)根据(2)的解析可知:硝酸铁受热分解的化学方程式4Fe(NO3)32Fe2O3+12NO2↑+3O2 ↑。 (4)利用a实验验证NO3-离子在酸性条件下能否将Ag氧化为Ag+,根据实验现象,说明在pH=1的情况下,NO3-离子不能够将Ag氧化,排除了NO3-离子对后续实验的干扰作用。 (5)向10 mL 3 mol·L-1 AgNO3溶液中滴加2 mL 0.1 mol·L-1 FeSO4溶液,振荡;再滴加酸性高锰酸钾溶液,紫红色溶液不褪色,说明溶液中已经没有Fe2+,Fe2+已经被溶液中的Ag+离子氧化了,即:Fe2++Ag+===Fe3++Ag,所以b涉及反应的离子方程式是:Fe2++Ag+===Fe3++Ag。 (6)对照实验b中Ag+浓度大,可以将Fe2+氧化,c中Fe3+离子浓度大,可以将Ag氧化,因此,Fe3+、Ag+氧化性的相对强弱与溶液中两种离子的浓度有关。 答案:(1)防倒吸 HCl、KSCN(答案合理即可) (2)NO2、O2恰好与氢氧化钠溶液完全反应 (3)4Fe(NO3)32Fe2O3+12NO2↑+3O2 ↑ (4)排除NO3-的干扰 Fe3+能氧化Ag (5)Ag++Fe2+===Fe3++Ag (6)浓度 2.(2019年广东省“六校联盟”高三二模)磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒性PH3气体(沸点-89.7℃,还原性强)。某化学兴趣小组的同学用下述方法测定粮食中残留磷化物的含量。 在C中加入l00g原粮,E中加入20.00 mL 1.50×10-3 mol·L-1 KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。 回答下列问题: (1)仪器D的名称是________________________。 (2)AlP与水反应的化学方程式为__________________________。 (3)装置A中盛装KMnO4溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸的碱性溶液,其作用是__________________。 (4)通入空气的作用是___________________。 - 6 - (5)装置E中PH3被氧化成磷酸,则装置E中发生反应的氧化剂和还原剂物质的量之比为_____________。 (6)收集装置E中的吸收液,加水稀释至250 mL,取25.00 mL于锥形瓶中,用4.0×10-4 mol·L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液15.00 mL,Na2SO3与KMnO4溶液反应的离子方程式为:______________________________,则该原粮中磷化物(以PH3计)的含量为______________mg·kg-1(写计算表达式和计算结果)。 解析:(1)该装置为直形冷凝管或冷凝管。 (2)根据题目描述,AlP吸水产生高毒性的PH3↑,所以反应的化学方程式为AlP+3H2O===PH3↑+Al(OH)3。 (3)因为PH3具有很强的还原性,所以要除去空气中的氧气,故装置B中盛有的焦性没食子酸的碱性溶液的作用就是吸收空气中的O2,防止PH3被氧化。 (4)通入空气的作用是将装置内生成的PH3气体全部排出,进入装置E中,减小实验误差;(5)在装置E中,PH3作还原剂,被氧化成磷酸,P元素的化合价升高8,MnO4-作氧化剂,被还原为Mn2+,Mn元素的化合价降低5,根据电子转移守恒可得,反应的化学方程式为:5PH3+8KMnO4+12H2SO4===5H3PO4+4K2SO4+8MnSO4+12H2O,其中氧化剂和还原剂物质的量之比为8∶5。 (6) Na2SO3与酸性KMnO4溶液反应的离子方程式为5SO32-+2MnO4-+6H+===5SO42-+2Mn2++3H2O,已知KMnO4的总物质的量为n(KMnO4)=20×10-3L×1.50×10-3 mol·L-1=3×10-5 mol,则与Na2SO3反应的KMnO4的物质的量为n(KMnO4)=×n(Na2SO3)=×(15×10-3L×4.0×10-4 mol·L-1)×=2.4×10-5 mol,所以与PH3反应的n(KMnO4)=3×10-5 mol-2.4×10-5 mol=0.6×10-5 mol,又PH3与KMnO4酸性溶液反应的化学方程式为5PH3+8KMnO4+12H2SO4===5H3PO4+4K2SO4+8MnSO4+12H2O,所以原粮中磷化物(以PH3计)的含量为×0.6×10-5 mol×34 g/mol×103 mg/g-1)/(100×10-3 kg)=1.275 mg/kg。 答案:(1)直形冷凝管(或冷凝管) (2)AlP+3H2O===PH3↑+Al(OH)3 (3)吸收空气中的O2 (4)保证生成的PH3全部被酸性KMnO4溶液吸收 (5)8∶5 (6)5SO32-+2MnO4-+6H+===5SO42-+2Mn2++3H2O =1.275 3.(2019年吉林高三调研)沉淀转化广泛应用于工业生产和科学实验。为了探究AgCl、Ag2S(黑色)的溶解性及转化等相关性质,做以下实验: 步骤 现象 Ⅰ.将NaCl溶液滴入AgNO3溶液中至恰好完全反应。 产生白色沉淀。 - 6 - Ⅱ.过滤出Ⅰ中的白色沉淀置于试管中,在试管中加入过量Na2S溶液并充分振荡。 白色沉淀变为黑色。 Ⅲ.过滤出Ⅱ中的黑色沉淀置于试管中,在试管中加入过量的NaCl溶液并充分振荡后静置。 较长时间后沉淀由黑色最后完全变为乳白色。 回答下列问题: (1)Ⅰ中的白色沉淀是__________。 (2)写出Ⅱ中沉淀变黑的离子方程式______________________ ,沉淀转化的主要原因是______________。 (3)滤出步骤Ⅲ中的乳白色沉淀,加入过量的浓HNO3使之充分反应,有红棕色气体生成,尚有部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。 ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀; ⅱ.将Y与足量的KI溶液充分混合,白色沉淀最终转化为黄色沉淀。 ① 由ⅰ判断,滤液X中被检出的离子是_________。 ② 由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有__________和__________。 (4)为了证明实验步骤Ⅲ中的黑色沉淀只有在NaCl存在下,才能和氧气反应转化为乳白色沉淀,设计了如下对照实验并将实验结果记录在右侧的表格中。 装置 实验结果 B 一段时间后,出现乳白色沉淀 C 一段时间后,无明显变化 ①A中,盛有MnO2的玻璃仪器名称是_____________。 ②C中盛放的是物质W的悬浊液,W是________(填化学式)。 ③请完成B中发生反应的反应式并配平:_________ Ag2S+______+_______+___H2O===___AgCl+_______+___NaOH 解析:将NaCl与AgNO3溶液混合,产生白色沉淀为氯化银沉淀,向所得固液混合物中加Na2S溶液,沉淀变为黑色,滤出黑色沉淀,加入NaCl溶液,较长时间后,沉淀变为乳白色,O2 将Ag2S 氧化生成S时有Ag+游离出来,NaCl中大量的Cl-与游离的Ag+结合成AgCl沉淀,由于c(Ag+)减小,有利于③中反应平衡右移,B中最终出现乳白色沉淀。 - 6 - (1)将NaCl与AgNO3溶液混合发生复分解反应生成氯化银白色沉淀,Ⅰ中的白色沉淀是AgCl。 (2)向所得固液混合物中加Na2S溶液,会生成黑色沉淀,是因为硫化银溶解度小于氯化银,出现了沉淀转化,Ⅱ中能说明沉淀变黑的离子方程式是:2AgCl(s)+S2-===Ag2S(s)+2Cl-。 (3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl.用浓HNO3溶解,产生红棕色气体,是浓硝酸被还原生成的二氧化氮,部分沉淀未溶解为氯化银,则被氧化的只能为S元素,故乳白色沉淀为AgCl和S的混合物;其中S被稀硝酸氧化成硫酸根离子,则在步骤Ⅴ中向X中滴加Ba(NO3)2溶液会生成BaSO4沉淀,再结合步骤Ⅲ中黑色沉淀消失可知硫化银与空气中氧气反应生成硫单质,同时生成氯化银沉淀,过滤得到滤液X和白色沉淀Y,为S和AgCl。 ①向X中滴加Ba(NO3)2溶液,产生白色沉淀为硫酸钡,由ⅰ判断,滤液X中被检出的离子是SO42-。 ②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀为S。 (4)①A中,盛有MnO2的玻璃仪器是平底烧瓶。 ②进一步确认步骤Ⅲ中乳白色沉淀产生的原因,装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,则装置C中应该不含氯化钠溶液,即为Ag2S悬浊液,通过对比反应现象判断生成乳白色沉淀产生的原因。 ③装置B中生成的白色沉淀为氯化银和S单质,反应物应该还有氧气,产物中钠离子只能以NaOH形式存在,则未知的反应物为NaOH,再根据H元素守恒可知另一种未知反应物为水,然后根据化合价升降相等配平可得反应方程式:2Ag2S+4NaCl+O2+2H2O===4AgCl+2S+4NaOH。 答案:(1)AgCl (2)2AgCl+S2-===Ag2S+2Cl- Ag2S的溶解度小于AgCl或Ag2S更难溶 (3)①SO42- ②AgCl S (4)①平底烧瓶 ②Ag2S ③2Ag2S+4NaCl+O2+2H2O===4AgCl+2S+4_NaOH 4.(2019年全国省级联考一模)Na2S2O3·5H2O常用作冲洗照相底片的定影剂,实验室以Na2S、Na2CO3、SO2为原料,利用下图装置可制取少量Na2S2O3·5H2O,其实验原理为Na2CO3+SO2===Na2S2O3+CO2;2Na2S+3SO2===2Na2SO3+3S;Na2SO3+S=Na2S2O3。回答下列问题: (1)打开K1,关闭K2,将锥形瓶中的溶液加热至35℃,打开滴液漏斗活塞慢慢滴加浓硫酸,锥形瓶中的现象是: ①导管口有气泡冒出;②__________________。 (2)通过注射器取样,监控锥形瓶中溶液pH=7~8,锥形瓶中酸性不能过强的原因是___________________。当锥形瓶中溶液的pH接近7时,应进行的操作是________。 (3)反应结束后将锥形瓶中混合液经如下处理可Na2S2O3·5H2O粗晶体: - 6 - ①趁热过滤的目的是______________________。 ②粗晶体中含有Na2CO3、Na2SO3、Na2SO4等杂质,利用下列提供的试剂,检验粗产品中含有Na2CO3。 可选试剂: a.品红溶液 b.酸性高锰酸钾溶液 c.澄清石灰水 d.NaOH溶液 e.稀硫酸 实验方案:取适量所得粗晶体配成溶液,滴加足量的稀硫酸,将产生的气体依次通过酸性高锰酸钾溶液、_________(填试剂序号)、澄清石灰水,若________(填现象),则证明产品中含有Na2CO3。 (4)粗晶体中Na2S2O3·5H2O质量分数的测定:称取2.500 g粗晶体溶于水,配成100 mL溶液,取25.00 mL溶液于锥形瓶中,用0.400 0 mol/L的酸性高锰酸钾标准溶液滴定,消耗标准溶液的体积为10.00 mL,Na2S2O3·5H2O的质量分数为__________ (忽略杂质对滴定的影响;S2O32-被酸性高锰酸钾溶液氧化为SO42-)。 解析:(1)打开K1,关闭K2,将锥形瓶中的溶液加热至35℃,打开滴液漏斗活塞慢慢滴加浓硫酸,亚硫酸钠与浓硫酸反应生成二氧化硫气体,二氧化硫与硫化钠反应生成硫单质,2Na2S+3SO2===2Na2SO3+3S;随后有发生Na2SO3+S===Na2S2O3,溶液变澄清。 (2)通过注射器取样,监控锥形瓶中溶液pH=7~8,因为Na2S2O3在酸性较强的环境中会发生反应,会降低Na2S2O3·5H2O产率,因此锥形瓶中酸性不能过强;当锥形瓶中溶液的pH接近7时,需要关闭滴液漏斗活塞,使反应停止,同时关闭K1,打开K2,用碱液吸收多余的二氧化硫。 (3)①趁热过滤可以防止Na2S2O3因温度降低析出,而造成损失。 ②检验粗产品中含有Na2CO3:取适量所得粗晶体配成溶液,滴加足量的稀硫酸,将产生的气体依次通过酸性高锰酸钾溶液、除去二氧化硫,然后用品红溶液检验二氧化硫是否除净,再用澄清石灰水检验生成的二氧化碳,若酸性高锰酸钾溶液颜色变浅,品红溶液不褪色,澄清石灰水变浑浊,则证明产品中含有Na2CO3。 (4) 酸性高锰酸钾标准溶液滴定Na2S2O3·5H2O的反应方程式为5S2O32-+8MnO4-+14H+===10SO42-+8 Mn2++7H2O,反应消耗的高锰酸钾的物质的量为0.400 0 mol/L×0.010 0 L=0.004 mol,则n(S2O32-)=×0.004 mol=0.002 5 mol,因此Na2S2O3·5H2O的质量分数=×100%=99.2%。 答案:(1)②溶液中出现黄色浑浊(或淡黄色),后又逐渐变澄清 (2)Na2S2O3在酸性较强的环境中会发生反应,降低Na2S2O3·5H2O产率 关闭滴液漏斗活塞,关闭K1,打开K2 (3)①防止Na2S2O3因温度降低析出,而造成损失 ②a 酸性高锰酸钾溶液颜色变浅,品红溶液不褪色,澄清石灰水变浑浊 (4)99.2% - 6 -查看更多