- 2021-08-06 发布 |
- 37.5 KB |
- 4页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学高考题型对点练九电化学分析判断含解析
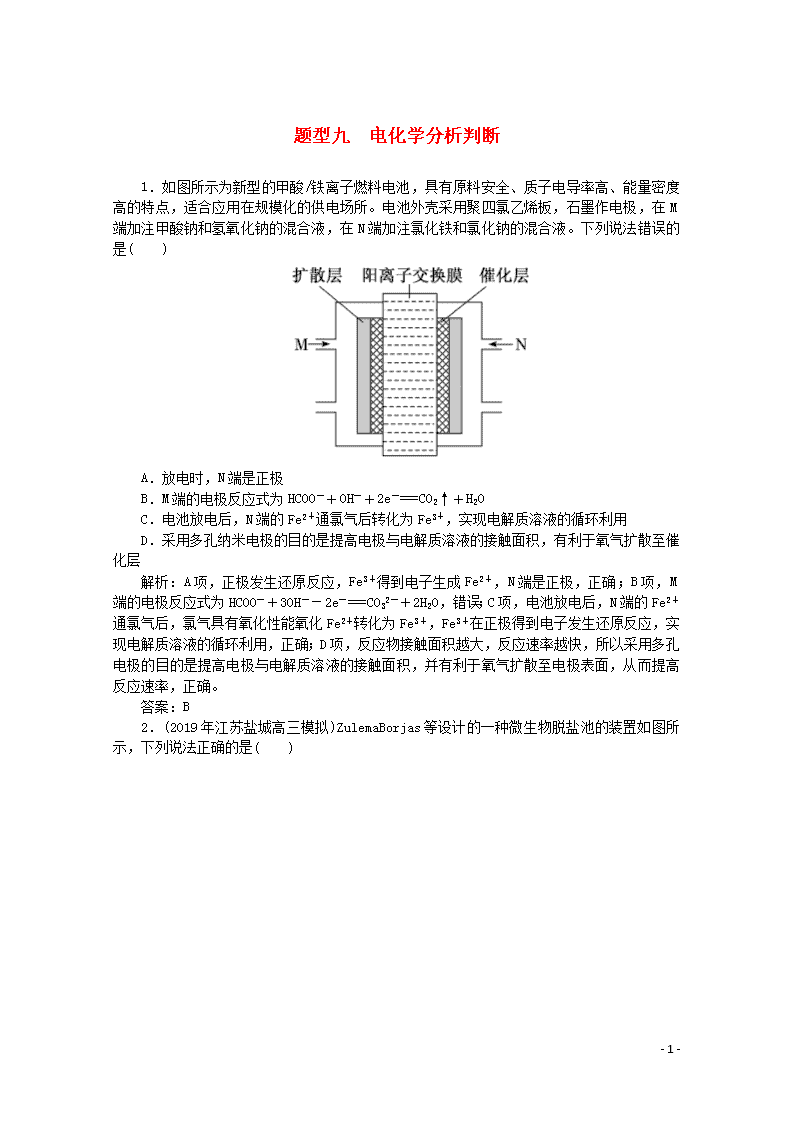
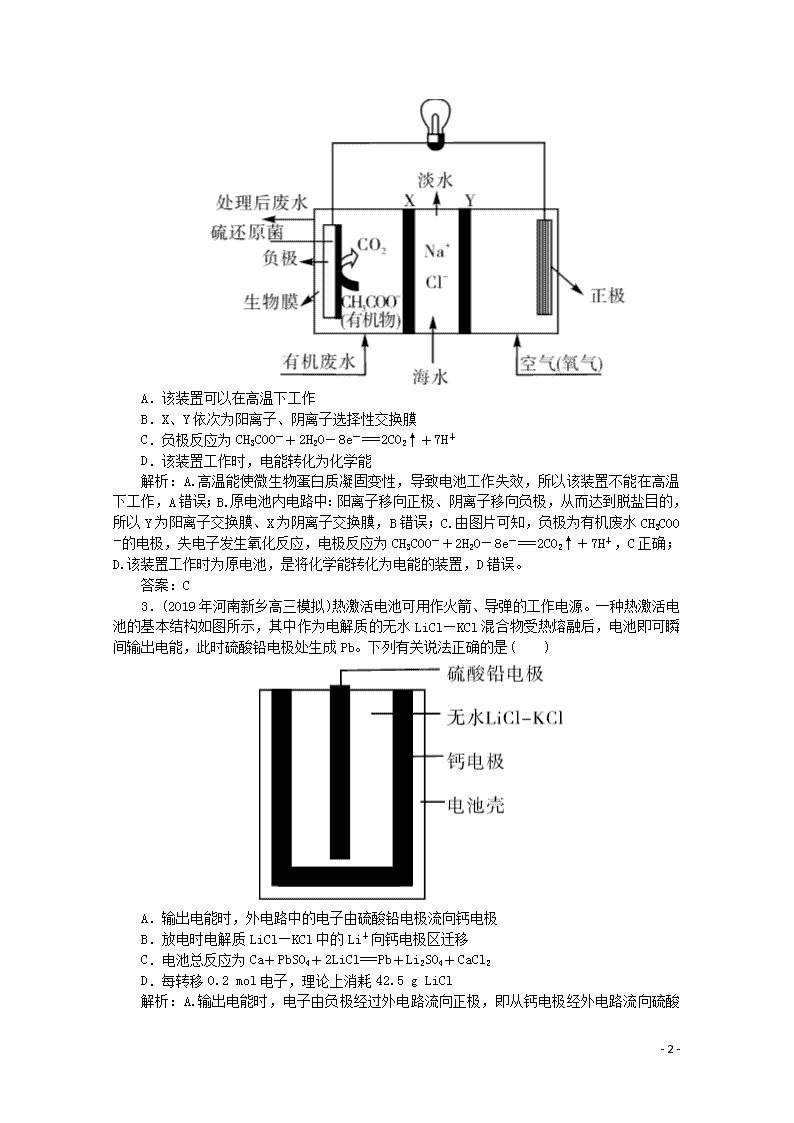
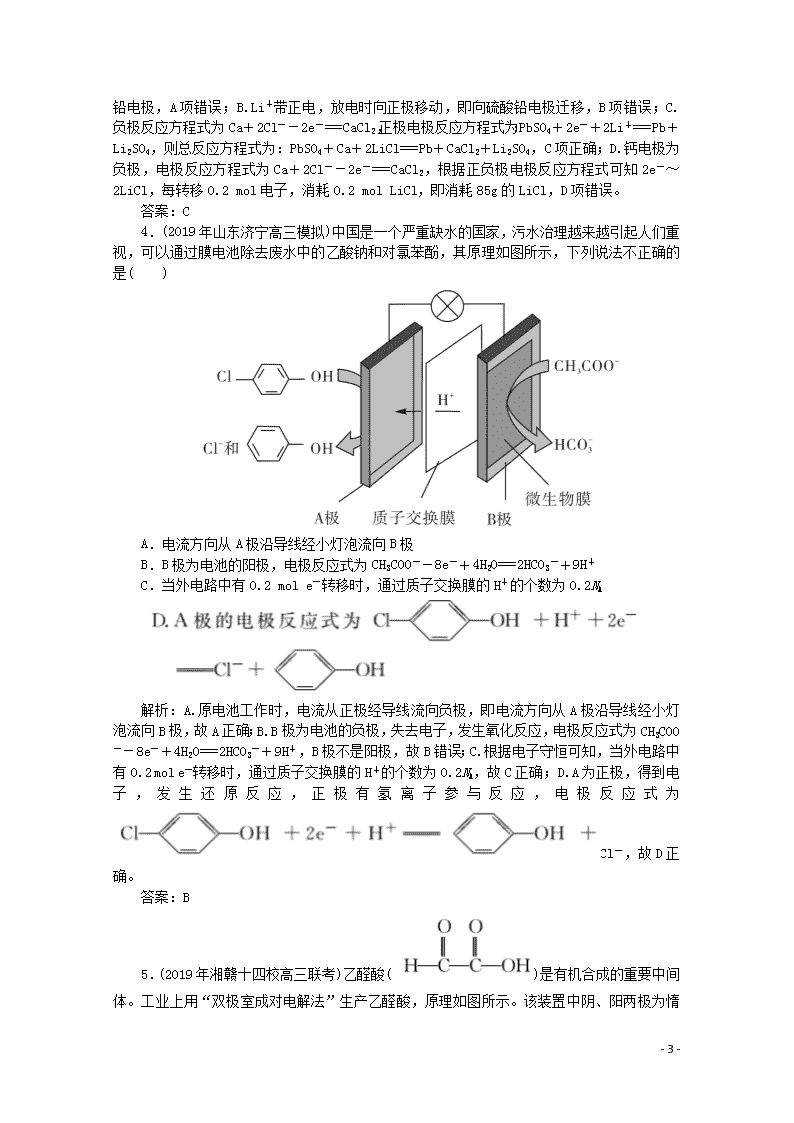
题型九 电化学分析判断 1.如图所示为新型的甲酸/铁离子燃料电池,具有原料安全、质子电导率高、能量密度高的特点,适合应用在规模化的供电场所。电池外壳采用聚四氯乙烯板,石墨作电极,在M端加注甲酸钠和氢氧化钠的混合液,在N端加注氯化铁和氯化钠的混合液。下列说法错误的是( ) A.放电时,N端是正极 B.M端的电极反应式为HCOO-+OH-+2e-===CO2↑+H2O C.电池放电后,N端的Fe2+通氯气后转化为Fe3+,实现电解质溶液的循环利用 D.采用多孔纳米电极的目的是提高电极与电解质溶液的接触面积,有利于氧气扩散至催化层 解析:A项,正极发生还原反应,Fe3+得到电子生成Fe2+,N端是正极,正确;B项,M端的电极反应式为HCOO-+3OH--2e-===CO32-+2H2O,错误;C项,电池放电后,N端的Fe2+通氯气后,氯气具有氧化性能氧化Fe2+转化为Fe3+,Fe3+在正极得到电子发生还原反应,实现电解质溶液的循环利用,正确;D项,反应物接触面积越大,反应速率越快,所以采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面,从而提高反应速率,正确。 答案:B 2.(2019年江苏盐城高三模拟)ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( ) - 4 - A.该装置可以在高温下工作 B.X、Y依次为阳离子、阴离子选择性交换膜 C.负极反应为CH3COO-+2H2O-8e-===2CO2↑+7H+ D.该装置工作时,电能转化为化学能 解析:A.高温能使微生物蛋白质凝固变性,导致电池工作失效,所以该装置不能在高温下工作,A错误;B.原电池内电路中:阳离子移向正极、阴离子移向负极,从而达到脱盐目的,所以Y为阳离子交换膜、X为阴离子交换膜,B错误;C.由图片可知,负极为有机废水CH3COO-的电极,失电子发生氧化反应,电极反应为CH3COO-+2H2O-8e-===2CO2↑+7H+,C正确;D.该装置工作时为原电池,是将化学能转化为电能的装置,D错误。 答案:C 3.(2019年河南新乡高三模拟)热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl—KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb。下列有关说法正确的是( ) A.输出电能时,外电路中的电子由硫酸铅电极流向钙电极 B.放电时电解质LiCl—KCl中的Li+向钙电极区迁移 C.电池总反应为Ca+PbSO4+2LiCl===Pb+Li2SO4+CaCl2 D.每转移0.2 mol电子,理论上消耗42.5 g LiCl 解析:A.输出电能时,电子由负极经过外电路流向正极, - 4 - 即从钙电极经外电路流向硫酸铅电极,A项错误;B.Li+带正电,放电时向正极移动,即向硫酸铅电极迁移,B项错误;C.负极反应方程式为Ca+2Cl--2e-===CaCl2,正极电极反应方程式为:PbSO4+2e-+2Li+===Pb+Li2SO4,则总反应方程式为:PbSO4+Ca+2LiCl===Pb+CaCl2+Li2SO4,C项正确;D.钙电极为负极,电极反应方程式为Ca+2Cl--2e-===CaCl2,根据正负极电极反应方程式可知2e-~2LiCl,每转移0.2 mol电子,消耗0.2 mol LiCl,即消耗85g的LiCl,D项错误。 答案:C 4.(2019年山东济宁高三模拟)中国是一个严重缺水的国家,污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的是( ) A.电流方向从A极沿导线经小灯泡流向B极 B.B极为电池的阳极,电极反应式为CH3COO--8e-+4H2O===2HCO3-+9H+ C.当外电路中有0.2 mol e-转移时,通过质子交换膜的H+的个数为0.2NA 解析:A.原电池工作时,电流从正极经导线流向负极,即电流方向从A极沿导线经小灯泡流向B极,故A正确;B.B极为电池的负极,失去电子,发生氧化反应,电极反应式为CH3COO--8e-+4H2O===2HCO3-+9H+,B极不是阳极,故B错误;C.根据电子守恒可知,当外电路中有0.2 mol e-转移时,通过质子交换膜的H+的个数为0.2NA,故C正确;D.A为正极,得到电子,发生还原反应,正极有氢离子参与反应,电极反应式为Cl-,故D正确。 答案:B 5.(2019年湘赣十四校高三联考)乙醛酸()是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸, - 4 - 原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法正确的是( ) A.若有2 mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为2 mol B.M电极上的电极反应式为:OHC—CHO+2e-+H2O===HOOC—CHO+2H+ C.M极与电源的负极相连 D.电解一段时间后,N极附近溶液的pH变小 解析:A项,2 mol H+通过质子交换膜,则电池中转移2 mol电子。阴极的电极方程式为HOOC—COOH+2e-+2H+===HOOC—CHO+H2O,阳极区的反应有2Cl--2e-===Cl2, OHC—CHO+Cl2+H2O===HOOC—CHO+2Cl-+2H+。因此,两极各生成1 mol乙醛酸,共生成2 mol乙醛酸,故A正确;B项,M电极是电解池的阳极,氯离子在阳极上失电子发生氧化反应生成氯气,电极反应式为2Cl--2e-===Cl2,然后氯气将乙二醛氧化为乙醛酸,OHC—CHO+Cl2+H2O===HOOC—CHO+2Cl-+2H+,故B错误;C项,M电极是电解池的阳极,与电源的正极相连,故C错误;D项,N极为电解池的阴极,若有2 mol H+通过质子交换膜进入阴极室,则电池中转移2 mol电子,阴极的电极反应式为HOOC—COOH+2e-+2H+===HOOC—CHO+H2O,则消耗H+与迁移过来的物质的量相等,乙二酸中羧基减少了,阴极N极附近溶液的pH不会减小、只能变大,故D错误。 答案:A - 4 -查看更多