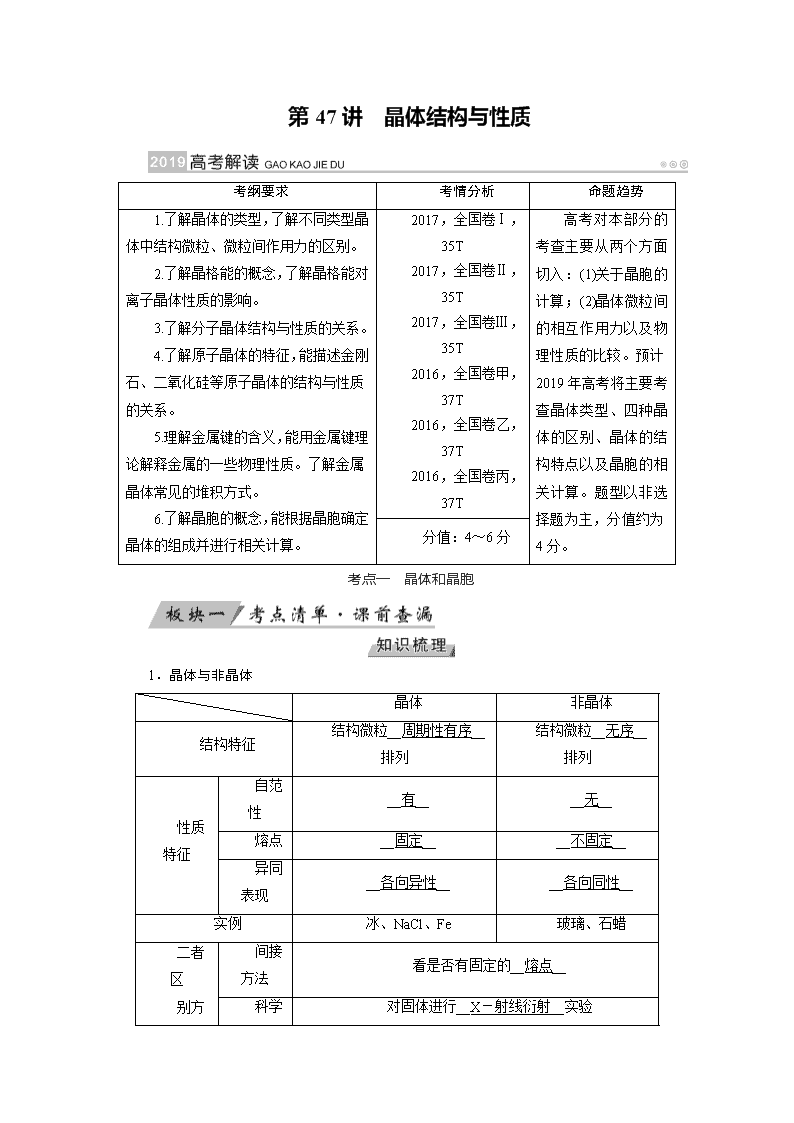
2019届一轮复习全国通用版第47讲晶体结构与性质学案
第47讲 晶体结构与性质
考纲要求
考情分析
命题趋势
1.了解晶体的类型,了解不同类型晶体中结构微粒、微粒间作用力的区别。
2.了解晶格能的概念,了解晶格能对离子晶体性质的影响。
3.了解分子晶体结构与性质的关系。
4.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
5.理解金属键的含义,能用金属键理论解释金属的一些物理性质。了解金属晶体常见的堆积方式。
6.了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关计算。
2017,全国卷Ⅰ,35T
2017,全国卷Ⅱ,35T
2017,全国卷Ⅲ,35T
2016,全国卷甲,37T
2016,全国卷乙,37T
2016,全国卷丙,37T
高考对本部分的考查主要从两个方面切入:(1)关于晶胞的计算;(2)晶体微粒间的相互作用力以及物理性质的比较。预计2019年高考将主要考查晶体类型、四种晶体的区别、晶体的结构特点以及晶胞的相关计算。题型以非选择题为主,分值约为4分。
分值:4~6分
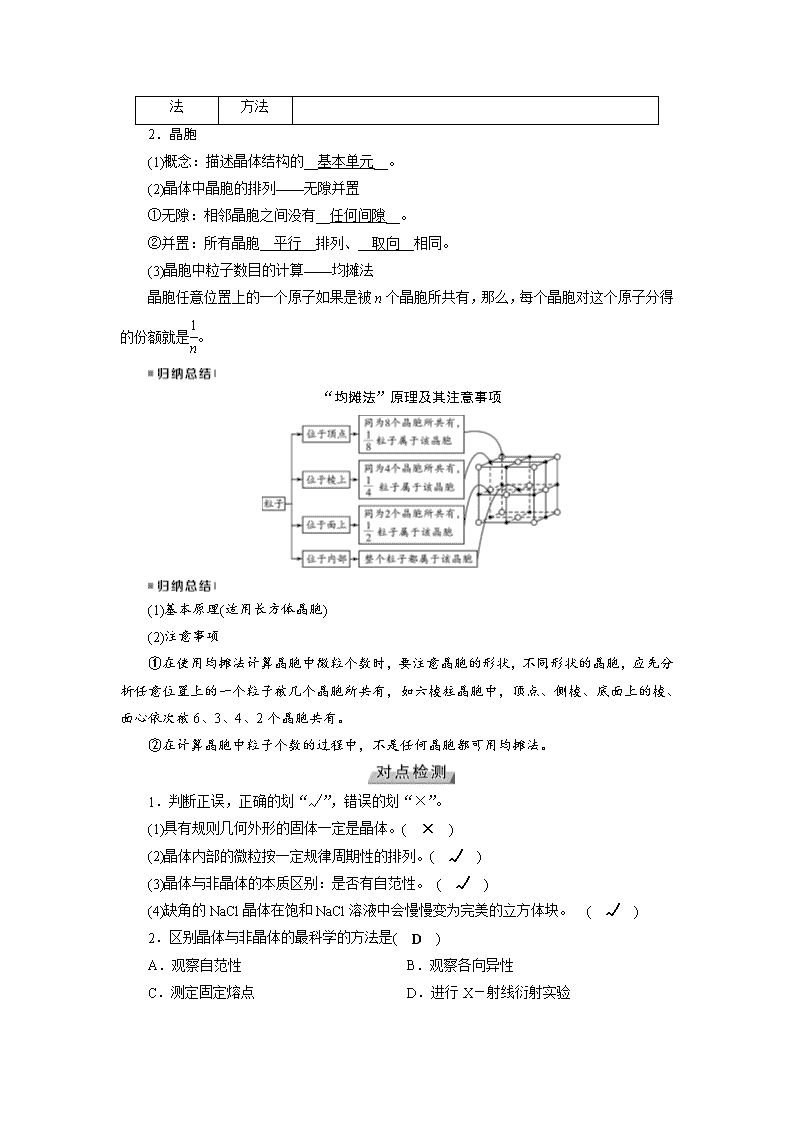
考点一 晶体和晶胞
1.晶体与非晶体
晶体
非晶体
结构特征
结构微粒__周期性有序__排列
结构微粒__无序__排列
性质特征
自范性
__有__
__无__
熔点
__固定__
__不固定__
异同表现
__各向异性__
__各向同性__
实例
冰、NaCl、Fe
玻璃、石蜡
二者区
间接方法
看是否有固定的__熔点__
别方法
对固体进行__X-射线衍射__实验
科学方法
2.晶胞
(1)概念:描述晶体结构的__基本单元__。
(2)晶体中晶胞的排列——无隙并置
①无隙:相邻晶胞之间没有__任何间隙__。
②并置:所有晶胞__平行__排列、__取向__相同。
(3)晶胞中粒子数目的计算——均摊法
晶胞任意位置上的一个原子如果是被n个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是。
“均摊法”原理及其注意事项
(1)基本原理(适用长方体晶胞)
(2)注意事项
①在使用均摊法计算晶胞中微粒个数时,要注意晶胞的形状,不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞所共有,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次被6、3、4、2个晶胞共有。
②在计算晶胞中粒子个数的过程中,不是任何晶胞都可用均摊法。
1.判断正误,正确的划“√”,错误的划“×”。
(1)具有规则几何外形的固体一定是晶体。( × )
(2)晶体内部的微粒按一定规律周期性的排列。( √ )
(3)晶体与非晶体的本质区别:是否有自范性。 ( √ )
(4)缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体块。 ( √ )
2.区别晶体与非晶体的最科学的方法是( D )
A.观察自范性 B.观察各向异性
C.测定固定熔点 D.进行X-射线衍射实验
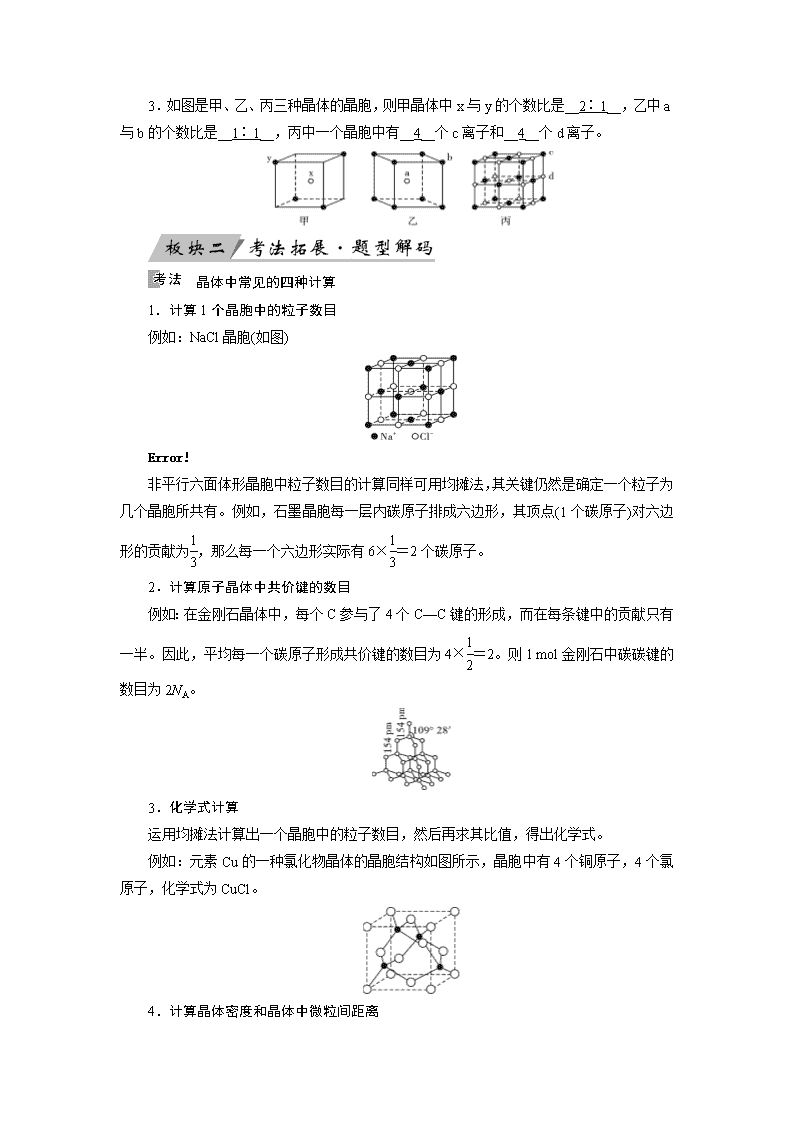
3.如图是甲、乙、丙三种晶体的晶胞,则甲晶体中x与y的个数比是__2∶1__,乙中a
与b的个数比是__1∶1__,丙中一个晶胞中有__4__个c离子和__4__个d离子。
晶体中常见的四种计算
1.计算1个晶胞中的粒子数目
例如:NaCl晶胞(如图)
非平行六面体形晶胞中粒子数目的计算同样可用均摊法,其关键仍然是确定一个粒子为几个晶胞所共有。例如,石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)对六边形的贡献为,那么每一个六边形实际有6×=2个碳原子。
2.计算原子晶体中共价键的数目
例如:在金刚石晶体中,每个C参与了4个C—C键的形成,而在每条键中的贡献只有一半。因此,平均每一个碳原子形成共价键的数目为4×=2。则1 mol金刚石中碳碳键的数目为2NA。
3.化学式计算
运用均摊法计算出一个晶胞中的粒子数目,然后再求其比值,得出化学式。
例如:元素Cu的一种氯化物晶体的晶胞结构如图所示,晶胞中有4个铜原子,4个氯原子,化学式为CuCl。
4.计算晶体密度和晶体中微粒间距离
(1)计算晶体密度的方法
若1个晶胞中含有x个微粒,则1 mol晶胞中含有x mol微粒,其质量为xM g(M为微粒的相对“分子”质量);又1个晶胞的质量为ρ a3 g(a3为晶胞的体积),则1 mol晶胞的质量为ρ a3 NA g,因此有xM=ρ a3NA。
(2)计算晶体中微粒间距离的方法
[例1](1)立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为__=4.1__g·cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为____pm(列式表示)。
(2)(2017·江苏卷节选)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fex-nCunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为__Fe3CuN__。
(3)(2017·全国卷Ⅱ节选)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。
R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为 (或×10-21) 。
解析 (1)用均摊法算出每个晶胞中含4个Zn2+和4个S2-。其质量为4× g
,其体积是(540.0×10-10 cm)3,所以其密度为=4.1 g·cm-3。每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑色之间的夹角为109°28′,两个白球之间的距离为270 pm,设S2-离子与Zn2+离子之间的距离为x,则2x2-2x2cos 109°28′=(270)2,x== pm。(2)由图2可知更稳定的Cu替代型产物为Cu替代a位置Fe型,利用均摊法可得晶胞中各原子个数Cu:8×=1,Fe:6×=3,N:1,故化学式为Fe3CuN。(3)该晶胞的体积为(a×10-7cm)3,根据×M=(a×10-7)3d,可求出y=(或×10-21)。
[例1](2017·全国卷Ⅲ)研究发现,在CO2低压合成甲醇反应(CO2+3H2===CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为______。元素Mn与O中,第一电离能较大的是______,基态原子核外未成对电子数较多的是______。
(2)CO2和CH3OH分子中碳原子的杂化形式分别为______和________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为______。原因是_______________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在______。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X-射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为__________nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为______nm。
[答题送检]来自阅卷名师报告
错误
致错原因
扣分
(3
没弄清H2O、CH3OH沸点存在差异的主要原因
-
)
3
(5)
MgO晶胞中,边长与离子半径间的定量关系(4r=a)记忆不牢导致计算错误
-4
[解析] (1)Co为第四周期第Ⅷ族的27号元素,基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2。Mn是金属元素,而O元素是非金属元素,难失去电子,所以O元素的第一电离能较大。O基态原子价电子为2s22p4,未成对电子是p轨道的2个电子,而Mn基态原子价电子排布为3d54s2,未成对电子是d轨道的5个电子,因此核外未成对电子数较多的是Mn。(2)CO2为直线形结构,碳原子为sp杂化,CH3OH分子中碳原子的价层电子对数为4,所以碳原子为sp3杂化。(3)常温下水和甲醇是液体,二氧化碳和氢气是气体,液体的沸点高于气体;水分子中有两个氢原子都可以参与形成分子间氢键,而甲醇分子中只有一个羟基上的氢原子可以形成分子间氢键,所以水的沸点高于甲醇;CO2的相对分子质量比H2大,分子间作用力较大,熔、沸点较高。(4)硝酸锰中硝酸根和锰离子之间形成离子键,硝酸根中N原子得到1个电子后共6个价电子,3个电子与3个O原子形成3个σ键,N原子剩余3个电子,与3个O原子形成π键(Π)。(5)根据晶胞结构,面对角线是O2-半径的4倍,即4r(O2-)=a,解得r(O2-)=×0.420 nm=0.148 nm;根据MgO晶胞的结构,a′=2r(O2-)+2r(Mn2+),则r(Mn2+)= nm=0.076 nm。
[答案] (1)[Ar]3d74s2 O Mn
(2)sp杂化 sp3杂化
(3)H2O>CH3OH>CO2>H2 H2O与CH3OH均为极性分子,H2O中氢键比甲醇多;CO2与H2均为非极性分子,CO2的分子量较大,范德华力较大
(4)离子键和π键(Π键)
(5)0.148 0.076
1.(2017·全国卷Ⅰ节选)(1)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为a=0.446 nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为__0.315__nm,与K紧邻的O个数为__12__。
(2)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于__体心__位置,O处于__棱心__位置。
解析 (1)二者间的最短距离为晶胞面对角线长的一半,即×0.446 nm≈0.315 nm
。与钾紧邻的氧原子有12个。(2)想象4个晶胞紧密堆积,则I处于顶角,O处于棱心,K处于体心。
1.(2017·海南卷节选)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为__K3C60__;其晶胞参数为1.4 nm,晶体密度为__2.03__g·cm-3。
解析 每个晶胞中含有K的个数为12×+9×1=12,含C60的个数为8×+6×=4,所以化合物的化学式为K3C60;每个晶胞中含有4个“K3C60”,则晶胞质量为 g,晶胞的体积为(1.4×10-7)3 cm3,所以晶体密度为 g÷(1.4×10-7)3 cm3=2.03 g/cm3。
2.(1)(2016·全国卷甲节选)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为__3∶1__。
②若合金的密度为d g·cm-3,晶胞参数a= ×107 nm(Ni的相对原子质量取59)。
(2)(2016·全国卷乙节选)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(,0,);C为(,,0)。则D原子的坐标参数为__(,,)__。
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为__×107__g·cm-3(列出计算式即可)。
考点二 四类晶体的组成和性质
1.金属键、金属晶体
(1)金属键:__金属阳离子__与__自由电子__之间的作用。
(2)本质——电子气理论
该理论认为金属原子脱落下来的__价电子__形成遍布整块晶体的“__电子气__”,被所有原子共用,从而把所有的金属原子维系在一起。
(3)金属晶体的物理性质及解释
在金属晶体中,金属离子和自由电子以__金属键__相互作用。金属都具有优良的导电性、导热性和延展性。
2.四种类型晶体的比较
类型
比较
分子晶体
原子晶体
金属晶体
离子晶体
构成粒子
__分子__
__原子__
金属阳离子、自由电子
__阴、阳离子__
粒子间的相互作用力
分子间作用力(某些含氢键)
__共价键__
__金属键__
__离子键__
硬度
__较小__
__很大__
有的__很大__,
有的__很小__
__较大__
熔、沸点
__较低__
__很高__
有的__很高__,
有的__
__较高__
很低__
溶解性
相似相溶
难溶于任何溶剂
常见溶剂难溶
大多易溶于水等极性溶剂
导电、传热性
一般不导电,溶于水后有的导电
一般不具有导电性,个别为半导体
电和热的良导体
晶体不导电,水溶液或熔融态导电
物质类别及举例
大多数非金属单质、气态氢化物、酸、非金属氧化物(SiO2除外)、绝大多数有机物(有机盐除外)
部分非金属单质(如金刚石、硅、晶体硼),部分非金属化合物(如SiC、SiO2)
金属单质与合金(如Na、Al、Fe、青铜)
金属氧化物(如K2O、Na2O)、强碱(如KOH、NaOH)、绝大部分盐(如NaCl)
3.离子晶体的晶格能
(1)定义
__气态离子__形成__1_mol__离子晶体释放的能量,通常取__正值__,单位为__kJ·mol-1__。
(2)影响因素
①离子所带电荷数:离子所带电荷数__越多__,晶格能越__大__。
②离子的半径:离子的半径越__小__,晶格能越大。
(3)与离子晶体性质的关系
晶格能越大,形成的离子晶体越__稳定__,且熔点越__高__,硬度越__大__。
1.判断正误,正确的划“√”,错误的划“×”。
(1)在晶体中只要有阳离子就一定有阴离子。( × )
(2)原子晶体的熔点一定比金属晶体的高。( × )
(3)石墨的硬度比金刚石小,所以其熔点比金刚石低。( × )
(4)干冰(CO2)晶体中包含的作用力为分子间力和共价键。( √ )
2.在下列物质中:NaCl、NaOH、Na2S、H2O2、Na2S2、(NH4)2S、CO2、CCl4、C2H2、SiO2、SiC、晶体硅、金刚石、晶体氩。
(1)其中只含有离子键的离子晶体是__NaCl、Na2S__。
(2)其中既含有离子键又含有极性共价键的离子晶体是__NaOH、(NH4)2S__。
(3)其中既含有离子键又含有极性共价键和配位键的离子晶体是__(NH4)2S__。
(4)其中既含有离子键又含有非极性共价键的离子晶体是__Na2S2__。
(5)其中含有极性共价键的非极性分子是__CO2、CCl4、C2H2__。
(6)其中含有极性共价键和非极性共价键的非极性分子是__C2H2__。
(7)其中含有极性共价键和非极性共价键的极性分子是__H2O2__。
(8)其中含有极性共价键的原子晶体是__SiO2、SiC__。
(9)不含共价键的分子晶体是__晶体氩__,只含非极性键的原子晶体是__晶体硅、金刚石__。
(1)原子晶体的熔点不一定比离子晶体高,如石英的熔点为1 710 ℃,MgO的熔点为2 852 ℃。
(2)金属晶体的熔点不一定比分子晶体的熔点高,如Na的熔点为97 ℃,尿素的熔点为132.7 ℃。
一 晶体类型的五种判断方法
1.依据构成晶体的微粒和微粒间的作用力判断
(1)离子晶体的构成微粒是阴阳离子,微粒间的作用力是离子键。
(2)原子晶体的构成微粒是原子,微粒间的作用力是共价键。
(3)分子晶体的构成微粒是分子,微粒间的作用力为分子间作用力或氢键。
(4)金属晶体的构成微粒是金属阳离子和自由电子,微粒间的作用力是金属键。
2.依据物质的分类判断
(1)金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。
(2)大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)常见的单质类原子晶体有金刚石、晶体硅、晶体硼等,常见的化合类原子晶体有碳化硅、二氧化硅等。
(4)金属单质是金属晶体。
3.依据晶体的熔点判断
(1)离子晶体的熔点较高。
(2)原子晶体的熔点很高。
(3)分子晶体的熔点低。
(4)金属晶体多数熔点高,但也有少数熔点相当低。
4.依据导电性判断
(1)离子晶体溶于水及熔融状态时能导电。
(2)原子晶体一般为非导体。
(3)分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。
(4)金属晶体是电的良导体。
5.依据硬度和机械性能判断
(1)离子晶体硬度较大、硬而脆。
(2)原子晶体硬度大。
(3)分子晶体硬度小且较脆。
(4)金属晶体多数硬度大,但也有较低的,且具有延展性。
另外,还需注意:①常温下为气态或液态的物质,其晶体应属于分子晶体(Hg除外);②石墨属于混合型晶体,但因层内原子之间碳碳共价键的键长为1.42×10-10m,比金刚石中碳碳共价键的键长(键长为1.54×10-10 m)短,所以熔、沸点高于金刚石;③AlCl3晶体中虽含有金属元素,但属于分子晶体,熔、沸点低(熔点190 ℃);④合金的硬度比其成分金属大,熔、沸点比其成分金属低。
[例1]现有几组物质的熔点( ℃)数据:
A组
B组
C组
D组
金刚石:3 550
Li:181
HF:-83
NaCl
硅晶体:1 410
Na:98
HCl:-115
KCl
硼晶体:2 300
K:64
HBr:-89
RbCl
二氧化硅:1 723
Rb:39
HI:-51
MgO:2 800 ℃
据此回答下列问题:
(1)由表格可知,A组熔点普遍偏高,据此回答:
①A组属于__原子__晶体,其熔化时克服的粒子间的作用力是__共价键__。
②二氧化硅的熔点高于硅,是由于__O的原子半径小于Si的原子半径,Si—O的键长小于Si—Si的键长,Si—O的键能大于Si—Si的键能__。
③硼晶体的硬度与硅晶体相对比:__硼晶体大于硅晶体__。
(2)B组晶体中存在的作用力是__金属键__,其共同的物理性质是__①②③④__(填序号),可以用__电子气__理论解释。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于__HF分子间能形成氢键__。
(4)D组晶体可能具有的性质是__②④__(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体中NaCl、KCl、RbCl的熔点由高到低的顺序为__NaCl>KCl>RbCl__,MgO晶体的熔点高于三者,其原因解释为__MgO晶体为离子晶体,离子所带电荷数越多,半径越小,晶格能越大,熔点越高__。
二 晶体熔、沸点高低的比较
1.不同类型晶体熔、沸点的比较
(1)不同类型晶体的熔、沸点高低的一般规律:原子晶体>离子晶体>分子晶体。
(2)金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
2.同种类型晶体熔、沸点的比较
(1)原子晶体
→→→
如熔点:金刚石>碳化硅>硅。
(2)离子晶体
①一般地说,离子所带的电荷数越多,离子半径越小,熔、沸点就越高,如熔点:MgO>NaCl>CsCl。
②衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。
(3)分子晶体
①具有氢键的分子晶体熔、沸点反常得高。如熔、沸点:H2O>H2Te>H2Se>H2S。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如熔、沸点:SnH4>GeH4>SiH4>CH4。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如熔、沸点:CO>N2。
④对于烷烃的同分异构体,支链越多,熔、沸点越低。
(4)金属晶体
金属离子半径越小,价电子数越多,其金属键越强,金属熔、沸点越高,如熔、沸点:Na
晶体硅>二氧化硅>碳化硅
B.CI4>CBr4>CCl4>CH4
C.Cl2>MgO>N2>CH4
D.金刚石>生铁>纯铁>钠
三 五类晶体结构模型
晶体
晶体结构
晶体详解
原子晶体
金刚石
(1)每个碳原子与相邻4个碳原子以共价键结合,形成正四面体结构;
(2)键角均为109°28′;
(3)最小碳环由6个碳原子组成且碳环上的原子不在同一平面内;
(4)每个碳原子参与4条C—C键的形成,碳原子个数与C—C键数之比为1∶2
SiO2
(1)每个Si原子与4个O原子以共价键结合,形成正四面体结构;
(2)晶体中,n(Si)∶n(O)=1∶2;
(3)最小环上有12个原子,即6个O,6个Si
分子晶体
干冰
(1)8个CO2分子构成立方体且在6个面心又各占据1个CO2分子;
(2)每个CO2分子周围等距离紧邻的CO2分子有12个
混合晶体
石墨
石墨层状晶体中,层与层之间的作用是分子间作用力,平均每个正六边形拥有的碳原子个数是2,C原子采取的杂化方式是sp2
金属晶体
简单立方堆积
典型代表:Po,配位数为6,空间利用率为52%
面心立方最密堆积
又称为A1型或铜型,典型代表:Cu、Ag、Au,配位数为12,空间利用率为74%
体心立方堆积
又称为A2型或钾型,典型代表:Na、K、Fe,配位数为8,空间利用率为68%
立方最密堆积
又称为A3型或镁型,典型代表:Mg、Zn、Ti,配位数为12,空间利用率为74%
离子晶体
NaCl型
(1)每个Na+(Cl-)周围等距离且紧邻的Cl-(Na+)有6个,每个Na+周围等距离且紧邻的Na+有12个;
(2)每个晶胞中含4个Na+和4个Cl-
CsCl型
(1)每个Cs+周围等距离且紧邻的Cl-有8个,每个Cs+(Cl-)周围等距离且紧邻的Cs+(Cl-)有8个;
(2)如图为8个晶胞,每个晶胞中含1个Cs+、1个Cl-
[例3]下面有关晶体的叙述不正确的是( B )
A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围距离相等的Na+共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
[例1]A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______(填元素符号),其中C原子的核外电子排布式为______。
(2)单质A有两种同素异形体,其中沸点高的是______(填分子式),原因是______________________________________;
A和B的氢化物所属的晶体类型分别为________________和______________。
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为______,中心原子的杂化轨道类型为______。
(4)化合物D2A的立体构型为______,中心原子的价层电子对数为______,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为______。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566 nm,F的化学式为______;晶胞中A原子的配位数为______;列式计算晶体F的密度(g·cm-3)______。
[答题送检]来自阅卷名师报告
错误
致错原因
扣分
(3)
价层电子对数计算公式弄错了
-2
(5)
求算密度忽略了单位间的换算
-2
[解析] C的核外电子总数是最外层电子数的3倍,则C可能是Li或P元素,但是A、B、C、D原子序数依次增大,所以C应为P元素,D的最外层只有一个未成对电子,所以D为Cl元素。A2-和B+的电子层结构相同,则A为O元素,B为Na元素。(1)电负性最大,也即非金属性最强的为O。P为15号元素,核外电子排布式为1s22s22p63s23p3。(2)氧的两种同素异形体分别为O2和O3,均为分子晶体,分子晶体中相对分子质量越大,沸点越高。H2O为分子晶体,NaH为离子晶体。(3)PCl3中P有一对孤电子对,价层电子对数为1+3=4,所以P为sp3杂化,PCl3的空间构型为三角锥形。(4)Cl2O中O有两对孤电子对,价层电子对数为2+2=4,所以O为sp3杂化,Cl2O的空间构型为V形。Cl2O中Cl为+1价,Cl2发生歧化反应生成Cl2O和NaCl。(5)由晶胞图知,小球有8个,大球有8×1/8+6×1/2=4个,所以化学式为Na2O。小球为Na,大球为O,面心上的1个O连有4个钠,在相邻的另一个晶胞中,O也连有4个钠,故O的配位数为8。1个晶胞中含有4个Na2O,根据密度公式有:ρ====2.27 g·cm-3。
[答案] (1)O 1s22s22p63s23p3{或[Ne]3s23p3}
(2)O3 O3的相对分子质量较大,范德华力大 分子晶体 离子晶体
(3)三角锥形 sp3
(4)V形 4 2Cl2+2Na2CO3+H2O===Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3===Cl2O+CO2+2NaCl)
(5)Na2O 8 =2.27 g·cm-3
1.(2018·河南百校联盟3月联考)磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外价电子排布式为__4s24p3__。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为__Cl>P>S__,电负性由大到小的顺序为__Cl>S>P__。
(3)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为__sp__,所含共价键的类型为__σ键和π键(写“极性键”也可)__,写出一种与COS
键合方式相同且空间构型也相同的微粒:__CO2(或CS2、BeF2等)__。
(4)H2O与H2S为同族元素的氢化物,H2O可以形成H9O或H3O+,而H2S几乎不能形成类似的H9S或H3S+,其原因是__氧的电负性大且原子半径小,H2O分子间及与H+可形成氢键,而硫的电负性较小且原子半径大,几乎不能形成氢键__。
(5)已知AlP的熔点为2 000 ℃,其晶胞结构如图所示。
①磷化铝的晶体类型为__原子晶体__。
②A、B点的原子坐标如图所示,则C点的原子坐标为____。
③磷化铝的晶胞参数a=546.35 pm,其密度为 g·cm-3(列出计算式即可,NA表示阿伏加德罗常数的数值)。
解析 (3)COS中C原子的孤电子对数是=0,价层电子对数是1+1+0=2,所以碳原子的杂化轨道类型是sp,COS的空间结构是直线形,结构式是O===C===S,含有2个σ键和2个π键;与COS键合方式相同且空间构型也相同的微粒应与COS是等电子体,如CO2和CS2。(4)H3O+是由H2O和H+通过配位键形成的,H9O是由(H2O)4和H+通过配位键形成的,其中(H2O)4是H2O分子间通过氢键形成的缔合分子,因此应从氢键的形成条件去考虑H2S不能形成H9S或H3S+的原因。(5)①磷化铝的晶胞结构类似金刚石,且其熔点很高,因此磷化铝属于原子晶体。②由磷化铝的晶胞结构可以看出,Al原子位于立方体的体对角线的处,因此C点的原子坐标为。③1个AlP晶胞中含有的P原子数是8×+6×=4,Al原子数也是4,因此一个晶胞的质量m= g,而晶胞的体积V=(a×10-10)3 cm3=(5.463 5×10-8)3 cm3,所以磷化铝的密度ρ== g·cm-3。
关于晶体计算的一些重要关系和公式
(1)空间利用率=。
(2)金属晶体中体心立方堆积、面心立方堆积中的几组公式(设棱长为a)。
①面对角线长=a。
②体对角线长=a。
③体心立方堆积4r=a(r为原子半径)。
④面心立方堆积4r=a(r为原子半径)。
1.(2017·全国卷Ⅰ节选)K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是__K原子半径较大且价电子数较少,金属键较弱__。
解析 K和Cr都是金属晶体,其熔点、沸点与金属键的强弱有关,K和Cr处于同一周期,且核外最外层电子构型相同,但K的原子半径比Cr大,且K的价电子数比Cr少,则K的金属键比Cr弱,因此K的熔点、沸点比Cr低。
2.(2017·海南卷节选)(1)碳的一种单质的结构如图1所示。该单质的晶体类型为__混合晶体__,原子间存在的共价键类型有__σ键、π键__,碳原子的杂化轨道类型为__sp2__。
(2)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图2所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是__均为分子晶体,相对分子质量越大,沸点越高__。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中化学键的离子性__减弱__、共价性__增强__(填“增强”“减弱”或“不变”)。
3.(1)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253 K,沸点为376 K,其固体属于__分子__晶体。
(2)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个C原子连接__3__个六元环,每个六元环占有__2__个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接__12__个六元环,六元环中最多有__4__个C原子在同一平面。
课时达标 第43讲
1.(2018·石家庄调研)铜及其化合物在生产生活中有着广泛的用途。
(1)基态铜原子的核外电子排布式为__1s22s22p63s23p63d104s1__,其晶体的堆积方式为__
面心立方最密堆积__,其中铜原子的配位数为__12__。
(2)向硫酸铜溶液中滴加氨水,首先形成蓝色沉淀;继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液;继续向溶液中加入乙醇,会析出深蓝色晶体[Cu(NH3)4SO4·H2O]。
①氨水中各元素原子的电负性由大到小的顺序为__O>N>H__(用元素符号表示)。
②NH3中N原子的杂化轨道类型为__sp3__,与其互为等电子体的阳离子为__H3O+__。
③向蓝色沉淀中继续滴加氨水,沉淀溶解是因为生成了四氨合铜配离子,四氨合铜配离子的结构式为__ 降低溶剂极性,使Cu(NH3)4SO4·H2O析出(答案合理即可)__。
(3)CuCl2和CuCl是铜的两种常见的氯化物。
①如图表示的是__CuCl__(填“CuCl2”或“CuCl”)的晶胞。
②原子坐标参数表示晶胞内部各原子的相对位置,图中各原子坐标参数:A为(0,0,0),B为(0,1,1),C为(1,1,0),则D原子的坐标参数为____。
③晶胞中C、D两原子核间距为298 pm,阿伏加德罗常数为NA,则该晶体密度为 g·cm-3(列出计算式即可)。
解析 (1)③在铜氨配离子中,NH3中的N提供孤电子对、Cu2+提供空轨道形成配位键,故铜氨配离子的结构式为;加入乙醇后析出晶体是因为降低溶剂极性,使Cu(NH3)4SO4·H2O析出。(3)①利用“均摊法”知,每个晶胞中含有Cu、Cl的数目均为4,因此图示晶胞为CuCl;②晶胞可认为由8个等体积小晶胞组成,D原子恰好处于小晶胞的体心,因此D原子的坐标为;③连接晶胞中A、C两原子,过D原子作AC的垂线,交AC于E点,设晶胞的边长为x cm,则依据CD的长度和D原子的坐标和直角三角形CDE可得2+2=(298×10-10)2,解得x=×10-10,则可求出晶胞的体积为3×10-30 cm3,故该晶胞的密度为 g·cm-3。
2.2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应的离子萃取,如La2+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:__1s22s22p63s23p63d1或[Ar]3d1__,其中电子占据的轨道数为__10__个。
(2)对叔丁基杯 [4] 芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为__sp3__。羟基间的相互作用力为__氢键__。
(3)不同大小的杯芳烃能识别某些离子,如N、SCN-等。根据等电子体原理判断N的空间构型为__直线形__;一定条件下,SCN-与MnO2反应可得到(SCN)2。试写出(SCN)2的结构式:__N≡C—S—S—C≡N__。
(4)已知C60分子结构和C60晶胞示意图如下所示:
则一个C60分子中含有的σ键个数为__90__,与每个C60分子距离最近且相等的C60分子有__12__个,C60晶体的密度为__1.67__g/cm3(计算结果保留两位小数)。
解析 (2)羟基氧原子有2个σ键,2对孤电子对,价层电子对数是4,因此杂化方式是sp3杂化;4个羟基之间无共价键相连,但符合形成氢键的条件,因此羟基间的相互作用力是氢键。(3)N与CO2互为等电子体,因此N的空间构型为直线形;SCN-与MnO2反应可得到(SCN)2,说明SCN-的性质与Cl-类似,则(SCN)2也应具有类似Cl2的结构,结合(SCN)2中N是-3价,C是+4价,S是-1价可知(SCN)2的结构式是N≡C—S—S—C≡N。(4)从图Ⅱ可以看出,C60分子中每个C原子与其他3个C原子形成2个碳碳单键和1个碳碳双键,共3个σ键,根据均摊法,一个C原子实际含有的σ键个数为,所以一个C60分子中含有的σ
键个数为60×=90;C60的晶胞是面心立方结构,所以与每个C60分子距离最近且相等的C60分子有12个;1个C60晶胞中含有的C60分子个数是8×+6×=4,晶胞的质量m= g,而晶胞的体积V=(1.42×10-7)3 cm3,所以C60晶体的密度ρ==≈1.67 g/cm3。
3.有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是__H2O分子间存在氢键__。
(2)A、B、C三种元素的氢化物稳定性由强到弱的顺序为__HF>H2O>NH3__(用化学式表示)。
(3)A的最简单氢化物分子的空间构型为__三角锥形__,其中A原子的杂化类型是__sp3__杂化。
(4)A的单质中σ键的个数为__1__,π键的个数为__2__。
(5)写出基态E原子的价电子排布式:__3d104s1__。
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm(用含ρ、NA的计算式表示)。
解析 由题干信息可推出A、B、C、D、E五种元素分别是N、O、F、Ca、Cu。(6)C和D形成的化合物是CaF2,一个晶胞中有4个“CaF2”,所以一个晶胞的质量是 g,一个晶胞的体积是a3 cm3,根据ρ== g·cm-3,则a= cm。
4.(2018·湖南三湘名校第三次联考)已知A、B、C、D都是周期表中的短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中都有两个未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号为__M__,该能层具有的原子轨道数为__9__。
(2)E2+的价层电子排布图是____,F原子的电子排布式是__1s22s22p63s23p63d104s1或[Ar]3d104s1__。
(3)A的最高价氧化物对应的水化物分子结构式为____,其中心原子采取的轨道杂化方式为_sp2杂化__,B的气态氢化物的VSEPR模型为__四面体__。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为____。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6。甲的水溶液可以用于实验室中E2+的定性检验,检验E2+的离子方程式为__3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓__。
(6)某种化合物由D、E、F三种元素组成,其晶胞如图所示,则其化学式为__CuFeS2__。该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:ρ=__≈4.32__g/cm3。
解析 由题中信息可推出A是C元素,B是N元素,C是O元素,D是S元素,E是Fe元素,F是Cu元素。(4)CO2的结构式是O===C===O,SCN-与CO2是等电子体,结构相似。(6)晶胞中F(Cu)原子的数目是8×+4×+1=4,E(Fe)原子的数目是4×+6×=4,D(S)原子全部位于晶胞内部,数目是8,所以Cu、Fe、S原子的数目之比是4:4:8=1:1:2,故其化学式为CuFeS2;一个晶胞中有4个“CuFeS2”,晶胞质量m= g,晶胞体积V=(524×10-10)2×1 030×10-10 cm3,所以晶体的密度ρ==≈4.32 g/cm3。
5.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大。
其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子。请根据以上信息,回答下列问题:
(1)A、B、E的第一电离能由小到大的顺序为__NaSiCl4。(3)氢化物N2H4分子中N原子形成2个N—H键、1个N—N键,还含有1对孤电子对,故N原子采取sp3杂化。(4)按原子的外围电子排布分区,元素Cu在ds区,Cu2+与过量的氨水反应的离子方程式为Cu2++4NH3·H2O===[Cu(NH3)4]2++4H2O。(5)元素N和Al可形成具有很高的硬度和熔点的AlN,该化合物属于原子晶体,其化合物中所含的化学键为共价键。小球数目为8×=1,大球数目为12×=3,其中N显-3价,则小球为N原子,大球为Cu原子,则其化学式为Cu3N。晶胞质量为 g,距离最近的两个Cu原子的核间距为a cm,则晶胞棱长为a cm×2=a cm,则该化合物的晶胞密度为= g/cm3。
6.硫元素价态众多,可与卤素、氮等元素化合形成许多复杂的化合物,
在科学技术和生产中有着重要的应用。
(1)六氟化硫(SF6)具有良好的电绝缘性能及优异的灭火性能。其分子中有__6__对完全相同的成键电子对。基态S原子有__2__个未成对电子。
(2)二氯化二硫是广泛用于橡胶工业的硫化剂,分子结构为,其中S原子轨道的杂化类型是__sp3__,它是__极性__(填“极性”或“非极性”)分子。
(3)S4N4是亮橙色固体,不溶于水,溶于苯等有机溶剂,是一种重要的金属有机化学反应物。S4N4与Ag在一定条件下反应,失去N2而缩合成(SN)x。(SN)x合成于1910年,过了五十年,才发现它在0.26 K的低温下,可转变为超导体。(SN)x的结构式如图所示:
已知1.20×105 mol S4N4与Ag发生缩合,生成了1.20×105 mol N2,生成二百聚物(SN)200和三百聚物(SN)300。若测得缩合产物中二百聚物的质量分数为0.50,则:
①S4N4的晶体类型是__分子__(填“分子”“原子”或“离子”)晶体。
②缩合产物中三百聚物的物质的量为__400_mol__;若Ag的实际使用量为8.64 kg,则Ag的循环使用次数(缩合时生成Ag2S需要消耗Ag的物质的量与实际使用Ag的物质的量的比值)为__6_000__。
(4)Ag单质为面心立方晶体,其晶胞参数a=4.08×10-10m,晶胞中Ag原子的配位数为__12__。列式计算Ag单质的密度:____g·cm-3(不必计算出结果)。
解析 (3)②设(SN)200、(SN)300的物质的量分别为x mol、y mol,则46×200x÷(46×200x+46×300y)=0.5,根据氮原子守恒,200x+300y=1.20×105×4-1.20×105×2,解得x=600 mol,y=400 mol,即(SN)200为600 mol,(SN)300为400 mol。根据硫原子守恒,生成600 mol (SN)200和400 mol (SN)300,失去了1.20×105 mol N2,同时有2.4×105 mol S减少,生成了2.4×105 mol Ag2S,需要消耗4.8×105 mol Ag,所以Ag的循环使用次数为4.8×105 mol÷(8.64×1 000÷108) mol=6 000次。(4)Ag单质为面心立方晶体,Ag的配位数为12。每个晶胞中含有的Ag原子数目为8×+6×=4,晶胞参数a=4.08×10-8 cm,则Ag单质的密度为÷(4.08×10-8 cm)3=。