- 2021-08-24 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习化学实验常用仪器和基本操作作业
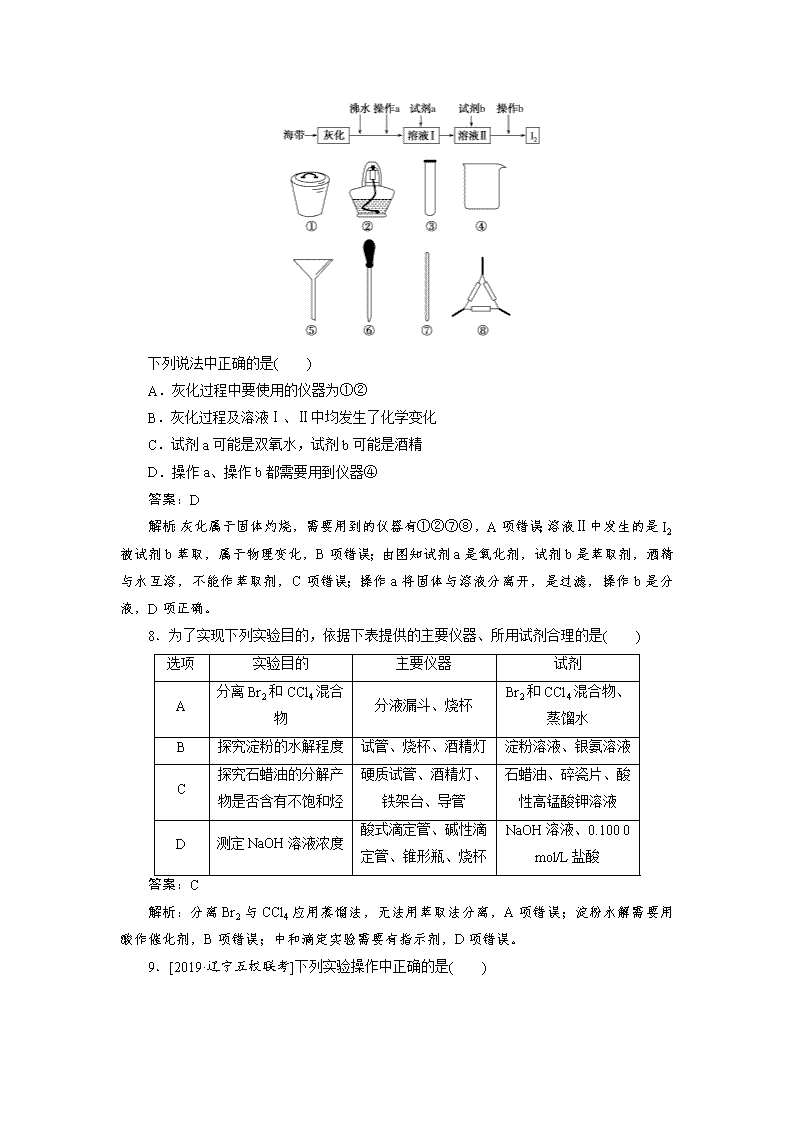
课练29 化学实验常用仪器和基本操作 小题狂练 1.实验室加热约150 mL液体时,可以使用的仪器是( ) A.①③④⑥ B.②③④⑥ C.①③④⑤ D.②③⑤⑥ 答案:A 解析:实验室加热约150 mL液体时,需在烧杯中进行,热源用酒精灯,烧杯不能直接加热,需要垫石棉网,A项正确。 2.[2019·清华中学上学期考试]下列有关仪器的使用方法或实验操作正确的是( ) A.洗净的锥形瓶和容量瓶可以放进烘箱中烘干 B.用容量瓶配制溶液时,若加水超过刻度线,立即用滴管吸出多余液体 C.测定新制氯水的pH,用玻璃棒蘸取液体点在pH试纸上,再对照标准比色卡读数 D.酸碱中和滴定时,滴定管使用前需用待装液润洗而锥形瓶不用 答案:D 解析:容量瓶不可以放进烘箱中烘干,A项错误;用容量瓶配制溶液时,若加水超过刻度线,应重新配制,B项错误;新制氯水具有强氧化性,因此不能用pH试纸测定新制氯水的pH,C项错误;酸碱中和滴定时,滴定管使用前需用待装液润洗,而锥形瓶不能用待装液润洗,D项正确。 3.下列药品的保存方法正确的是( ) A.氢氟酸保存在棕色细口玻璃瓶中 B.镁条能与氧气反应,所以必须保存在煤油中 C.硅酸钠的水溶液保存在带有玻璃塞的细口玻璃瓶中 D.碘单质保存在带有玻璃塞的棕色广口玻璃瓶中 答案:D 解析:氢氟酸能与玻璃中的二氧化硅发生反应,A项错误;镁在空气中会被氧化为氧化镁,这层保护膜能阻止内层的镁继续被氧化,所以镁条无需保存在煤油中,B项错误;硅酸钠溶液具有黏性,能使玻璃塞与瓶口黏在一起,C项错误;碘易升华,所以要避光密封保存,由于是固体药品,所以使用广口瓶(带玻璃塞),D项正确。 4.分离四氯化碳与水组成的混合物可选用的装置或仪器是( ) 答案:B 解析:四氯化碳与水互不相溶,可用分液漏斗进行分离。 5.下列是某同学在实验报告中记录的数据,其中正确的是( ) A.用25 mL量筒量取12.36 mL盐酸 B.用托盘天平称取8.75 g食盐 C.用红色石蕊试纸测得某溶液的pH为12 D.用标准NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10 mL 答案:D 解析:量筒只能精确到0.1 mL,A错误;托盘天平只能精确到0.1 g,B错误;红色石蕊试纸只能检验碱性气体,不能检测溶液的pH,C错误。 6.下列说法正确的是( ) A.配制一定浓度的稀硫酸,用量筒量取浓硫酸后,未将蒸馏水洗涤量筒后的洗涤液转移至容量瓶中,使配制的溶液浓度偏小 B.pH试纸使用时不需要润湿,红色石蕊试纸检测气体时也不需要润湿 C.蒸发时将蒸发皿放置在铁架台的铁圈上,并垫石棉网加热 D.石油的蒸馏实验中,忘记加沸石,可以先停止加热,待溶液冷却后加入沸石,再继续加热蒸馏 答案:D 解析:量取液体时,量筒不能洗涤,否则配制的溶液浓度偏大,A错误;检测气体时,试纸需要润湿,B错误;加热时,蒸发皿不需要垫石棉网,C错误;沸石防止液体暴沸,忘记加入沸石,可以先停止加热,待溶液冷却后再加入沸石,继续加热蒸馏,D正确。 7.从海带(碘元素以I-形式存在)中提取碘(I2)的流程及可能用到的仪器如下(夹持类仪器省略): 下列说法中正确的是( ) A.灰化过程中要使用的仪器为①② B.灰化过程及溶液Ⅰ、Ⅱ中均发生了化学变化 C.试剂a可能是双氧水,试剂b可能是酒精 D.操作a、操作b都需要用到仪器④ 答案:D 解析:灰化属于固体灼烧,需要用到的仪器有①②⑦⑧,A项错误;溶液Ⅱ中发生的是I2被试剂b萃取,属于物理变化,B项错误;由图知试剂a是氧化剂,试剂b是萃取剂,酒精与水互溶,不能作萃取剂,C项错误;操作a将固体与溶液分离开,是过滤,操作b是分液,D项正确。 8.为了实现下列实验目的,依据下表提供的主要仪器、所用试剂合理的是( ) 选项 实验目的 主要仪器 试剂 A 分离Br2和CCl4混合物 分液漏斗、烧杯 Br2和CCl4混合物、蒸馏水 B 探究淀粉的水解程度 试管、烧杯、酒精灯 淀粉溶液、银氨溶液 C 探究石蜡油的分解产物是否含有不饱和烃 硬质试管、酒精灯、铁架台、导管 石蜡油、碎瓷片、酸性高锰酸钾溶液 D 测定NaOH溶液浓度 酸式滴定管、碱性滴定管、锥形瓶、烧杯 NaOH溶液、0.100 0 mol/L盐酸 答案:C 解析:分离Br2与CCl4应用蒸馏法,无法用萃取法分离,A项错误;淀粉水解需要用酸作催化剂,B项错误;中和滴定实验需要有指示剂,D项错误。 9.[2019·辽宁五校联考]下列实验操作中正确的是( ) 答案:B 解析:向试管中滴加液体,胶头滴管尖端不能伸入到试管中,A项错误;用手捂热试管,烧杯中导管口有气泡冒出,松开手后导管内形成一段水柱,则证明装置气密性良好,B项正确;中和滴定实验中,滴定时应该用手握住滴定管的旋塞,C项错误;蒸发Cu(NO3)2溶液的过程中,Cu2+易水解,生成的HNO3受热挥发,得不到纯净的无水Cu(NO3)2,D项错误。 10.下列实验操作或对事故的处理方法正确的是( ) A.配制0.1 mol·L-1NaCl溶液,定容时不小心加水超过刻度线,立即将水吸出 B.实验室制取氧气并用排水法收集,出现倒吸现象,立即停止加热 C.少量浓硫酸沾在皮肤上,立即用大量水冲洗,并涂上稀NaHCO3溶液 D.蒸馏石油时,加热一段时间后发现未加碎瓷片,立即拔开橡皮塞并投入碎瓷片 答案:C 解析:配制溶液时将水吸出会导致溶液浓度偏低,A错误;制取氧气时出现倒吸现象,应立即将导气管从水槽中取出,若停止加热会使倒吸速度更快,B错误;蒸馏石油时,加热一段时间后发现未加碎瓷片,立即拔开橡皮塞并投入碎瓷片会引起液体暴沸,发生危险,应待冷却至室温后再加入碎瓷片,D错误。 11.下列实验装置(部分夹持装置略)或操作设计正确且能达到实验目的的是( ) 答案:C 解析: 容量瓶只能用于配制溶液,不能在容量瓶中稀释浓硫酸,A错误;向沸水中滴加饱和氯化铁溶液,继续加热至红褐色透明状,即可得到氢氧化铁胶体,不能用玻璃棒搅拌,B错误;碱式滴定管带有橡皮管,该图装置正确,C正确;称量NaOH固体应用小烧杯或表面皿,用托盘天平称量时应遵循“左物右码”的原则,D错误。 12.[2019·辽宁五校协作体模拟]下列化学药品的保存方法合理的是( ) A.金属钾保存在乙醇中 B.常温下浓硫酸可存放在铁质容器中 C.NaOH溶液保存在带玻璃塞的试剂瓶中 D.FeCl3溶液中加入少量还原铁粉存放 答案:B 解析:金属钾能与乙醇反应,不能保存在乙醇中,A项不合理;常温下铁在浓硫酸中钝化,故常温下浓硫酸可存放在铁质容器中,B项合理;玻璃中含有SiO2,能与NaOH发生反应生成具有黏性的Na2SiO3,故NaOH溶液应该保存在带橡皮塞的试剂瓶中,C项不合理;铁离子能和铁粉发生氧化还原反应生成亚铁离子,故FeCl3溶液中不能加入还原铁粉存放,D项不合理。 13.下列选用的仪器和药品能达到实验目的的是( ) A B C D 制乙炔的发生装置 蒸馏时的接收装置 除去SO2中的少量HCl 准确量取一定体积K2Cr2O7标准溶液 答案:C 解析:制备乙炔时常用饱和食盐水代替水以减缓反应速率,A项错误;牛角管与锥形瓶之间是直接相连的,不必用橡皮塞,B项错误;HCl可以与NaHSO3反应放出SO2,而SO2不能与NaHSO3反应,C项正确;K2Cr2O7具有强氧化性,会氧化碱式滴定管下端的橡皮管,K2Cr2O7标准溶液应盛放于酸性滴定管中,D项错误。 14.下列各项操作所选仪器或装置正确的是( ) A.①比较Cl、C、Si的非金属性强弱 B.②除去CO2中的SO2 C.③量取20.00 mL NaOH溶液 D.④分离苯和溴苯的混合物 答案:B 解析:比较元素的非金属性强弱,可比较其最高价氧化物对应的水化物的酸性强弱,A错误;二氧化硫能被酸性高锰酸钾溶液氧化为硫酸,从而将二氧化碳中的二氧化硫除去,B正确;量取氢氧化钠溶液必须用碱式滴定管,C错误;苯与溴苯互溶,不能用分液的方法进行分离,D错误。 15.[2019·西安八校联考]下列实验操作正确且能达到相应实验目的的是( ) 选项 实验目的 实验操作 A 配制FeCl3溶液 将FeCl3固体溶解于适量蒸馏水中 B 称取2.0 g NaOH固体 先在托盘上各放一张滤纸,然后在右盘上添加2 g砝码,左盘上添加NaOH固体 C 检验溶液中是否含有NH 取少量溶液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 D 验证铁的吸氧腐蚀 将铁钉放入试管中,用盐酸浸没 答案:C 解析:配制FeCl3溶液的实验操作为将FeCl3固体溶于浓盐酸,并加蒸馏水稀释至所需浓度,A项错误;NaOH具有腐蚀性,且容易潮解,应放在烧杯中称量,B项错误;检验NH时,向溶液中加入NaOH溶液并加热,将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则证明含有NH,C项正确;用盐酸浸没铁钉,铁发生析氢腐蚀,D项错误。 16.下列实验操作正确的是( ) A.图1用于制备CO2 B.图2用于配制一定物质的量浓度的溶液 C.图3用于证明浓硫酸有脱水性、强氧化性 D.图4用于测量KClO3分解时生成O2的体积 答案:C 解析:硫酸与石灰石反应生成的微溶性盐CaSO4会覆盖在石灰石表面导致反应很快停止下来,A项错误;定容时应使用胶头滴管,B项错误;可根据蔗糖在加入浓硫酸后会变黑判断浓硫酸有脱水性,根据品红溶液褪色可确定有SO2生成,浓硫酸表现出强氧化性,C项正确;由于图4装置在气体恢复到室温的过程中,易造成水倒吸而导致测量不准确,可用量气管准确测量生成O2的体积,D项错误。 17.实验室从含氯化钠、硝酸钾混合液中提取KNO3的过程如图所示。下列分析正确的是( ) 选项 操作1 操作2 操作3 操作4 A 溶解 结晶 蒸发 过滤 B 蒸发 过滤 冷却 过滤 C 蒸发 结晶 结晶 蒸发 D 过滤 结晶 冷却 结晶 答案:B 解析:氯化钠的溶解度受温度的影响小,蒸发浓缩可析出晶体;硝酸钾的溶解度受温度的影响大,降低温度可析出大量晶体,所以蒸发结晶可得到氯化钠,冷却结晶可得到硝酸钾,故B正确。 18.[2019·郑州模拟]已知草酸晶体(H2C2O4·2H2O)的熔点为101 ℃,170℃分解。下列选用的装置和药品能达到实验目的的是( ) A B C D 制取SO2 制取NO2 H2C2O4·2H2O分解 分离苯与溴苯 答案:D 解析:铜片和稀硫酸加热时不反应,应该用铜片和浓硫酸加热制取SO2 ,A项错误;常温下浓硝酸使铝钝化,不能在常温下用浓硝酸和Al反应制取NO2,B项错误;根据提供的信息可知,草酸晶体的分解温度高于熔点,即草酸晶体先熔化后分解,故试管口不能向下倾斜,C项错误;苯和溴苯互溶,且沸点相差较大,故可以用蒸馏的方法分离二者,实验过程中需要加入碎瓷片以防止暴沸,冷凝管中的冷却水从下口进,从上口出,D项正确。 课时测评 1.[2018·全国卷Ⅲ]下列实验操作不当的是( ) A.用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率 B.用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂 C.用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+ D.常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二 答案:B 解析:加几滴CuSO4溶液后,Zn与CuSO4反应生成Cu,从而形成无数细小的原电池,加快了生成H2的速率,A项不符合题意;酚酞的变色范围为8.2查看更多