- 2021-08-24 发布 |
- 37.5 KB |
- 18页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习专题十二物质性质除杂制备含解析
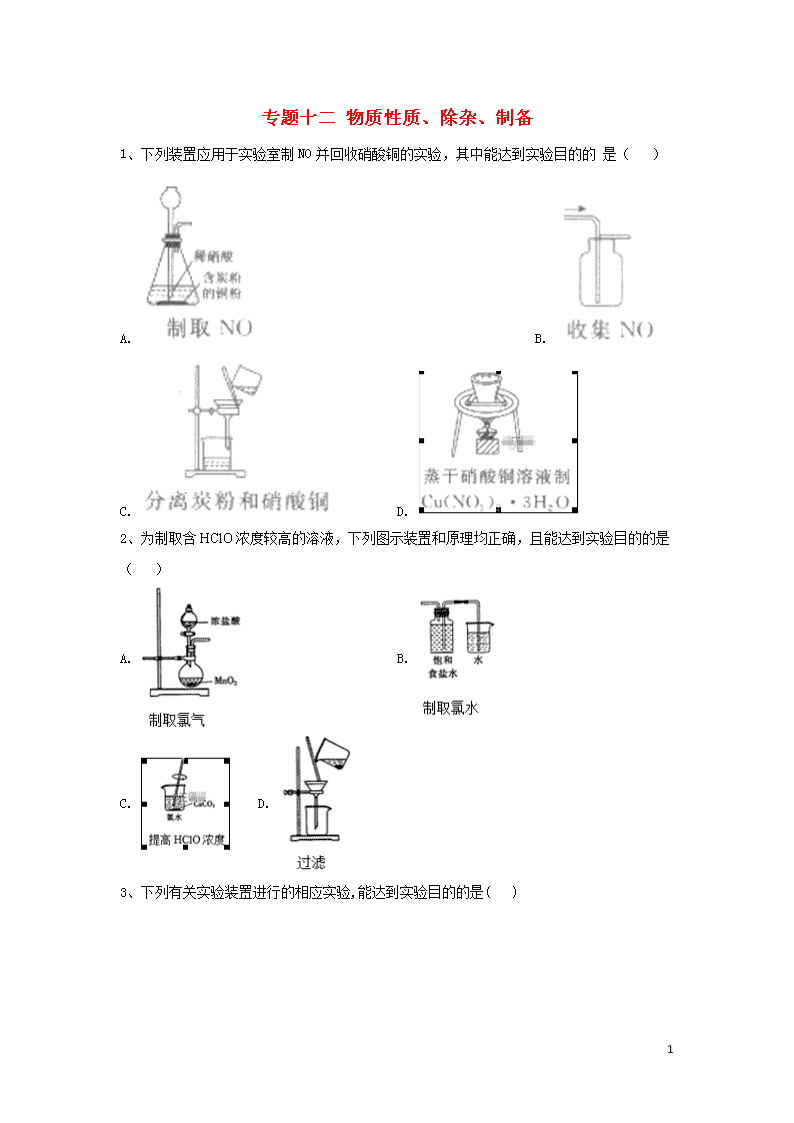
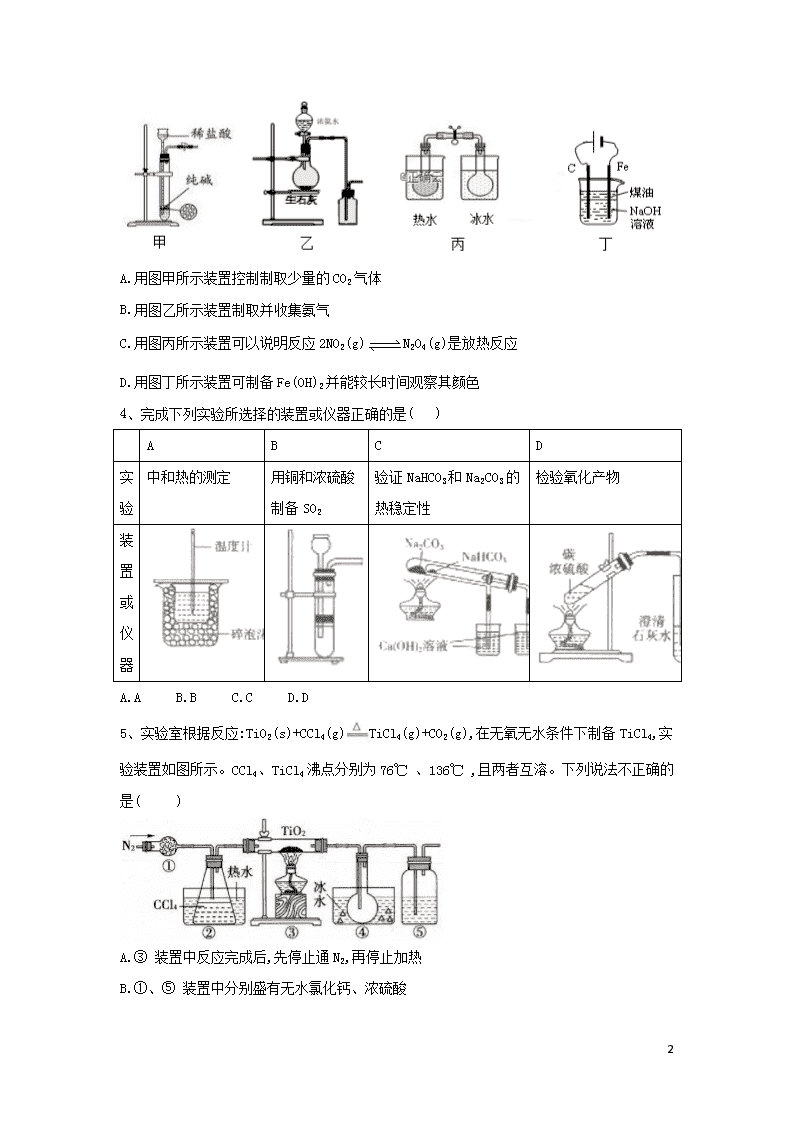
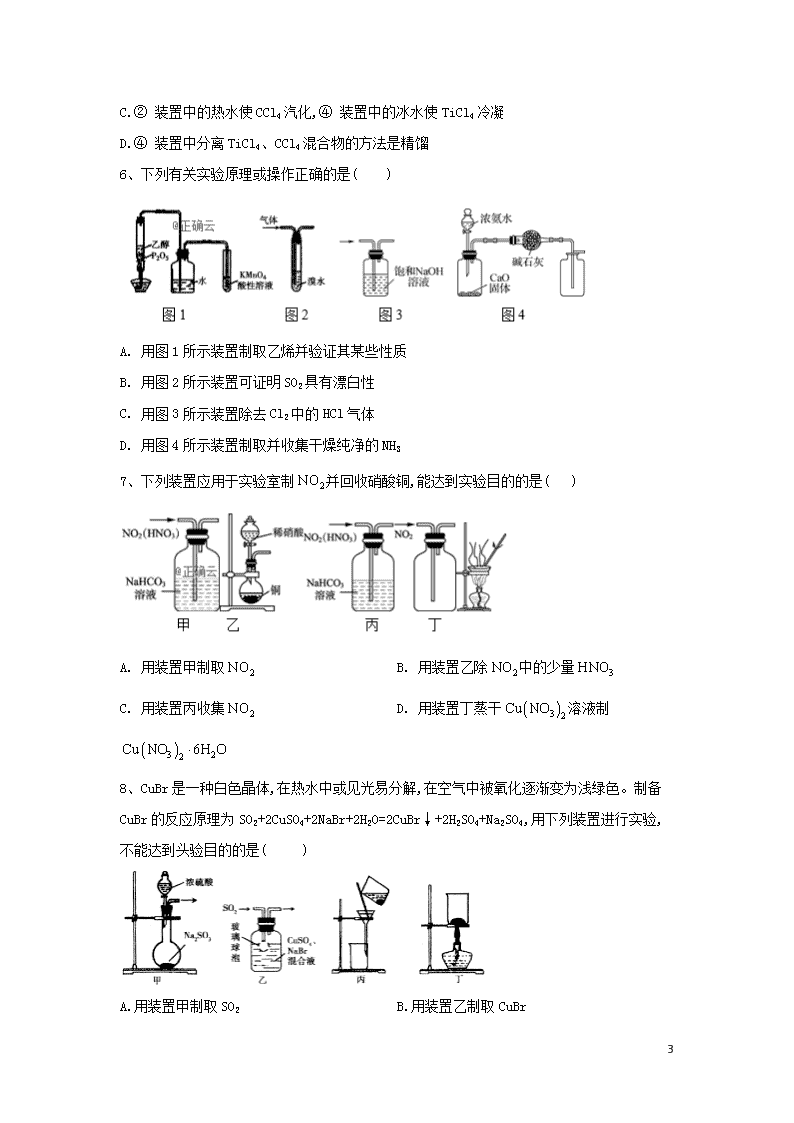
专题十二 物质性质、除杂、制备 1、下列装置应用于实验室制NO并回收硝酸铜的实验,其中能达到实验目的的 是( ) A. B. C. D. 2、为制取含浓度较高的溶液,下列图示装置和原理均正确,且能达到实验目的的是( ) A. B. C. D. 3、下列有关实验装置进行的相应实验,能达到实验目的的是( ) 18 A.用图甲所示装置控制制取少量的CO2气体 B.用图乙所示装置制取并收集氨气 C.用图丙所示装置可以说明反应2NO2(g)N2O4(g)是放热反应 D.用图丁所示装置可制备Fe(OH)2并能较长时间观察其颜色 4、完成下列实验所选择的装置或仪器正确的是( ) A B C D 实验 中和热的测定 用铜和浓硫酸制备SO2 验证NaHCO3和Na2CO3的热稳定性 检验氧化产物 装置或仪器 A.A B.B C.C D.D 5、实验室根据反应:TiO2(s)+CCl4(g)TiCl4(g)+CO2(g),在无氧无水条件下制备TiCl4,实验装置如图所示。CCl4、TiCl4沸点分别为76℃ 、136℃ ,且两者互溶。下列说法不正确的是( ) A.③ 装置中反应完成后,先停止通N2,再停止加热 B.①、⑤ 18 装置中分别盛有无水氯化钙、浓硫酸 C.② 装置中的热水使CCl4汽化,④ 装置中的冰水使TiCl4冷凝 D.④ 装置中分离TiCl4、CCl4混合物的方法是精馏 6、下列有关实验原理或操作正确的是( ) A. 用图1所示装置制取乙烯并验证其某些性质 B. 用图2所示装置可证明SO2具有漂白性 C. 用图3所示装置除去Cl2中的HCl气体 D. 用图4所示装置制取并收集干燥纯净的NH3 7、下列装置应用于实验室制并回收硝酸铜,能达到实验目的的是( ) A. 用装置甲制取 B. 用装置乙除中的少量 C. 用装置丙收集 D. 用装置丁蒸干溶液制 8、CuBr是一种白色晶体,在热水中或见光易分解,在空气中被氧化逐渐变为浅绿色。制备CuBr的反应原理为SO2+2CuSO4+2NaBr+2H2O=2CuBr↓+2H2SO4+Na2SO4,用下列装置进行实验,不能达到头验目的的是( ) A.用装置甲制取SO2 18 B.用装置乙制取CuBr C.用装置丙避光将CuBr与母液分离 D.用装置丁干燥CuBr 9、用如图装置制取并收集气体,对应的装置和试剂均正确的是( ) Ⅲ收集气体 Ⅰ中试剂a,b Ⅱ中试剂c Ⅳ中试剂d A SO2 稀硫酸与铜片 浓硫酸 NaOH溶液 B Cl2 浓盐酸与二氧化锰 饱和氯化钠溶液 NaOH 溶液 C HBr 浓硫酸与溴化钠 浓硫酸 水 D CO 甲酸与浓硫酸 浓硫酸 酸性KMnO4溶液 A. A B. B C. C D. D 10、实验室可用如图装置制取少量氮气。下列说法正确的是( ) A.②中盛放的是五氧化二磷 B.实验开始时先点燃③中的酒精灯,再点燃①中的酒精灯 C.③中玻璃管中的反应: D.实验结束时先熄灭①③中的酒精灯,再将导管从水槽中拿出 11、用如图装置制备并检验Cl2的性质,下列说法正确的是( ) 18 A.图甲中:如果MnO2过量,浓盐酸能全部反应完 B.图乙中:生成蓝色的烟,加入少量水,溶液呈红棕色 C.图丙中:充分光照后,量筒中剩余气体约15 mL(条件相同) D.图丁中:干燥的有色布条不褪色.湿润的有色布条褪色 12、Cl2O是黄棕色、具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示。 已知: Cl2O的熔点为-116℃,沸点为3.8 ℃;Cl2的沸点为-34.6℃ ;HgO+2Cl2=HgCl2+Cl2O 下列说法中不正确的是( ) A.装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸 B.通入干燥空气的目的是将生成的Cl2O稀释降低爆炸危险 C.从装置⑤中逸出气体的主要成分是Cl2O 18 D.装置④与⑤之间不用橡胶管连接,是为了防止燃烧和爆炸 13、氮化铬(CrN)是一种良好的耐磨材料,实验室可用无水氯化铬(CrCl3)与氨气在高温下反应制备,反应原理为CrCl3+NH3高温CrN+3HCl.回答下列问题: 1.制备无水氯化铬。氯化铬有很强的吸水性,通常以氯化铬晶体(CrCl3·6H2O)的形式存在。直接加热脱水往往得到Cr2O3,有关反应的化学方程式为______________,以氯化铬晶体制备无水氯化铬的方法是_____________________________。 2.制备氮化铬。某实验小组设计制备氮化铬的装置如下图所示(夹持与加热装置省略): ①装置A中发生反应的化学方程式为_____________________。 ②实验开始时,要先打开装置A中活塞,后加热装置C,目的是___________________。 ③装置B中盛放的试剂是____________,装置D的作用是_____________________。 ④有同学认为该装置有一个缺陷,该缺陷是_______________________。 3.氯化铬的纯度测定。制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN的质量分数为_____________(结果保留3位有效数字)。 14、二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点为-105,沸点为79,140以上时易分解,并且Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应表示为 4LiAlCl4-SOCl2=4LiCl+S+SO2 (1) 组装该电池必须在无水、无氧的条件下进行,原因是 。 (2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为 。用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量之比为 。 (3)甲同学设计如图所示的装置用ZnCl2 • xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。 18 ① 用原理解释SOCl2在该实验中的作用: ② 装置的连接顺序为A→B→ 。 ③实验结束后,为检测ZnCl2•xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为 (填序号)。 a.加入足量硝酸酸化的硝酸银溶液,充分反应 b.称得固体为n克 c.干燥 d.称取蒸干后的固体m克溶于水 e.过滤 f.洗涤 (4)乙同学认为SOCl2还可用作FeCl3 • 6H2O制取无水FeCl3 • 6H2O的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。 ① 可能发生的副反应的离子方程式为 。 ②两同学设计了如下实验方案判断副反应的可能性: Ⅰ.取少量FeCl3 • 6H2O于试管中,加入足量SOCl2,振荡使两种物质充分反应; Ⅱ.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。 (供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6 ] 溶液、溴水) 方案 操作 现象 结论 方案一 往一支试管滴加 。 若有白色沉淀生成 则发生了上述副反应 方案二 往另一支试管滴加 。 。 则没有发生上述副反应 15、二氧化氯()是极易溶于水且不与水发生化学反应的黄绿色气体, 沸点为 18 11 ℃,可用于处理部分含硫废水。某小组在实验室中利用下列装置制备 (此制备方法中经空气稀释的与不反应): 回答下列问题 (1)仪器X的名称是 。 (2)欲选择上图中的装置收集,其连接顺序为a→ (按气流方向,小 写字母表示)。 (3)装置C的作用是 ,装置E中反应的离子方程式为 。 (4)处理含硫() 碱性废水时,与 反 应(被氧化为)的离子方程式 为 ;处理含硫碱性废水时,相同条件下同体积的相对于的优 点 是 。 (5) 很不稳定,需现用现配,为测定所得溶液中的含量进行下列实验: 步骤1:准确量取mL溶液加人锥形瓶中。 步骤2:用稀硫酸调节溶液的,再加入足量KI品体,静置片刻。 步骤3:加入指示剂,用的标准溶液滴定至终点时,消耗mL 标准溶液。(已知:;) ①配制,标准溶液时,用到的玻璃仪器有烧杯、量筒、玻 璃 棒、胶 头滴管和 。 ②原溶液中的 含量为 (用含c、、的代数式表示)。 16、亚硝酰氯(NOCl,熔点:-64.5℃ ,沸点:-5.5℃ )遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。常用于合成清洁剂、触媒剂及中间体等。实验室中可由氯气与一氧化氮在常温常压下合成。其制备装置如图甲、乙所示: 18 (1)用图甲中装置制备纯净干燥的原料气,补充下表中所缺少的药品。 装置Ⅰ 装置Ⅱ 烧瓶中 分液漏斗中 制备纯净Cl2 MnO2 浓盐酸 ①_____ 制备纯净NO Cu 稀硝酸 ②_____ (2)将制得的NO和Cl2通入图乙对应装置制备NOCl。 ①装置连接顺序为a→_______(按气流方向,用小写字母表示)。 ②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。 ③有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、Cl2通入装置Ⅴ中,你因意此观点吗?_____(填“同意”或“不同意”),原因是__________________。 ④实验开始的时候,先通入Cl2,再通入NO,原因为_________________。 (3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用于储存氯气的装置:_______。 (4)装置Ⅷ吸收尾气时,NOCl发生反应的化学方程式为_________________。 18 (5)有人认为装置Ⅷ通中氢氧化钠溶液只能吸收Cl2和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅷ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出产生黑色沉淀反应的离子方程式:____________________。 (6)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.6625g样品溶于50.00mL NaOH溶液中,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.40mol/L AgNO3溶液滴定至产生砖红色沉淀,消耗AgNO3溶液50.00mL。 ① 样品的纯度为______%(保留1位小数)。 ② 已知常温下,Ksp(AgCl)=2.0×10-10,Ksp(Ag2CrO4)=2.0×10-12,若在滴定终点时测得溶液中的浓度是5.0×10-3mol/L,此时溶液中Cl-浓度是______。 答案以及解析 1答案及解析: 答案:C 解析:A.生成气体从长颈漏斗逸出,且NO易被 氧化,则不能制备NO,应选分液漏斗,故A项错误;B.NO的密度与空气密度相差不大,且与02反应。 不能用排空气法收集,应选排水法收集,故B项错误;C.炭粉不溶于水,硝酸铜溶于水,则利用图中过滤装 置可分离,故C项正确;D.蒸发时促进铜离子水解, 生成的硝酸易挥发,导致蒸发操作不能制备得到 Cu (NO3)2 • 3H2O,且蒸发结晶应用蒸发皿,不用坩 埚,应选冷却结晶法,故D项错误;答案选C。 18 2答案及解析: 答案:C 解析: MnO2与浓HCl制Cl2要加热,A错误;洗气时气体应该长进短出,B错误;CaCO3+Cl2+H2O CaCl2+2HClO+CO2,所以,向氯水中加入碳酸钙能提高次氯酸的浓度,C正确;过滤是把不溶于液体的固态物质跟液体分离的一种方法,漏斗尖嘴要紧贴烧杯内壁,D错误。答案选C。 【解题指导】本题考查氯及其化合物的性质等知识。 3答案及解析: 答案:C 解析: 4答案及解析: 答案:C 解析:A.图中缺少环形玻璃搅拌棒.故A错误;B.Cu与浓硫酸常温下不反应,不能制备气体,故B错 误;C.碳酸氣钠加热易分解,小试管中为碳酸氢钠, 可对比,故C正确;D. C与浓硫酸反应生成二氧化 碳、二氧化硫,均使石灰水变浑浊,不能检验氧化产 物.故D错误。 5答案及解析: 答案:A 解析:通入N2的目的是隔绝空气,当③装置中反应完成后,应先停止加热,待体系冷却至室温后再停止通化,可以防止倒吸及外界空气与TiCl4反应,A错误;①、⑤均为干燥装置,防止水蒸气影响实验,①为固体,⑤为液体,所以分别盛有无水氯化钙和浓硫酸,B正确;CCl4、TiCl4的沸点分别为76℃、136℃,②装置中的热水使CCl4汽化,进入③装置中与TiO2反应,④装置中的冰水使生成的TiCl4冷凝,收集产品,C正确;常温下,TiCl4、CCl4为液体,两者沸点(76℃、136℃)相差较大,可以采用精馏分离,D正确。 6答案及解析: 答案:A 解析: 7答案及解析: 18 答案:C 解析: 8答案及解析: 答案:D 解析:因为SO2易溶于水,所以用浓硫酸与Na2SO3反应制备SO2,A项正确;根据题干制备CuBr的反应原理可知,可采用装置乙制取CuBr,玻璃球泡既可以增大SO2与混合液的接触面积,又可以在液面处防止倒吸,B项正确;用装置丙避光将CuBr与母液分离,可防止CuBr见光分解,C项正确;不能用装置丁干燥CuBr,因为CuBr见光易分解,且在空气中会被氧化,D项错误。 9答案及解析: 答案:B 解析: A.Cu与稀硫酸不反应,不能制备二氧化硫,故A错误; B.浓盐酸与二氧化锰反应生成氯气,氯气的密度比空气密度大,氯气与NaOH反应,图中装置可制备、收集氯气,且NaOH可吸收尾气,故B正确; C.浓硫酸与HBr发生氧化还原反应生成溴,不能制备和干燥HBr,故C错误; D.甲酸与浓硫酸反应生成CO、H2O,CO不能与高锰酸钾反应,且CO不能选向上排空气法收集,高锰酸钾不能吸收尾气,故D错误; 答案:B 10答案及解析: 答案:C 解析:湿的能与反应,故A错误;反应开始时,应先点燃①中酒精灯产生氨气以除去体系内的空气,B错误;氨气在加热条件下能被氧化铜氧化,③中玻璃管中的反应:,故C正确;实验结束时,应先将导管从水槽中拿出,否则会引起倒吸,故D错误。 11答案及解析: 答案:D 18 解析:二氧化锰只能与浓盐酸反应,当盐酸浓度降低时, 反应会停止,即盐酸不能完全反应,A项错误;氯气与铜反 应生成棕黄色的烟,加少量水后所得溶液呈蓝色,B项错 误;量筒中剩余气体约为10 mL,C项错误;干燥的氯气不 具有漂白性,氯气与水反应生成的HClO具有漂白性,所以只有湿润的有色布条褪色,D项正确。 12答案及解析: 答案:C 解析:制取Cl2O需要干燥纯净的氯气,所以②、③中盛装 的试剂依次是饱和食盐水和浓硫酸,A项正确;高浓度的 Cl2O易爆炸,所以通入干燥空气可以将生成的Cl2O稀释降低爆炸危险,B项正确;装置⑤是为了得到纯净的Cl2O, 从装置⑤逸出的气体是空气和未反应的氯气,C项错误;Cl2O与有机物接触会发生燃烧并爆炸,装置④与⑤之间不 用橡胶管连接,是为了防止燃烧和爆炸,D项正确。 13答案及解析: 答案:1. 2CrCl3·6H2OCr2O3+9H2O+6HCl↑;在HCl的气氛中加热 2.①CaO+NH3·H2O=Ca(OH)2+NH3↑(或NH3·H2OCaONH3↑+H2O) ②用生成的氨气排除装置内的空气 ③碱石灰;防止空气中的水分进入装置C ④没有尾气处理装置 3.91.8% 解析: (1)加热CrCl3 • 6H2O晶体时,CrCl3水解,氯化氢受热挥发,使水解平衡右移,CrCl3完全水解得到Cr(OH)3,Cr(OH)3受热分解生成Cr2O3,反应的化学方程式为 2CrCl3 • 6H2O=Cr2O3 +9H2O+6HCl↑;为防止CrCl3水解,在HC1的气氛中加热 CrCl3 • 6H2O晶体,脱水制得无水氯化铬; (2)①装置A中,农氨水滴入到锥形瓶中.來氨水中 水与CaO反应生成氢氧化钙并放出大量的热,溶液中氢氧根浓度增大,使氨水的电离平衡左移,反应放 出的热量升高温度,有利于氨气逸出.反应的化学方程式为 CaO + NH3 • H2O=Ca(OH)2+NH3 ↑; ②实验开始时,先打开装置A中活塞,浓氨水与 CaO反应制得氨气,生成的氨气排除装罝内的空 气,在无氧条件下,无水氯化铬(CrCl3)与氨气在高 温下反应生成CrN;③装置B中盛放的试剂是城石 18 灰,目的是千燥氨气,防止水蒸气进入装置C中,氯化铬水解干扰CrN制备;装置D中的无水氯化钙可以吸收空气中的水蒸气,防止水蒸气进入装置C 中,氯化铬水解千扰CrN制备;④该装置有一个缺陷,没有氨气的尾气吸收装置,氨气排入到空气中, 会污染环境; (3)设 14. 38 g 样品中 CrN 为x mol,Cr2N 为y mol, 固体残渣Cr2O3的质量为16. 72g,Cr2O3的物质的量为,由x原子个数守恒得 关系式①:x+2y=0.22,由样品质量的关系式②66x + 118y=14.38,解关系式得:x =0.2mol,y = 0.01 mol,则样品中CrN的质量分数为 14答案及解析: 答案:(1)锂是活泼金属,易与H2O、O2反应;SOCl2 也可与水反应 (2) SOCl2 + H2O=SO2↑+2HCl↑; 2:3:1 (3)①SOCl2作脱水剂,与水反应生成HC1可以抑制氯化锌的水解②D→E→F→C:③daefcb (4)①SOCl2 + 2 Fe3++3 H2O=+6H+ +2Fe2++2Cl- ②BaCl2 溶液; K5[Fe(CN)6]溶液;若无蓝色沉淀出现 解析:(1)锂性质活泼,易与H2O、O2反应,SOC12 也可与水反应,组装该电池必须在无水、无氧的条件下 进行,故答案为:锂是活泼金属,易与H2O、O2反应, S0C12也可与水反应; (2)SOCl2与水反应生成SO2和 HCl,反应的方程式 为 SOCl2 + H2O=SO2 ↑ +2HCl↑;由硫黄(S)、 液氨和三氧化硫为原料在一定条件合成二氯亚砜的原子利用率达100%可知.该反应为化合反应,反应的化学才程式为2S+3Cl2 + SO3=3SOCl2,則三 者的物盾的量之比为2 : 3 : 1,故答案为:SOC12 +H2O=SO2↑+2HCl↑;2:3:1 (3)实验中SOCl2与ZnCl2•xH2O中的结晶水作用,生成无水ZnCl2及SO2和HC1气体,SOCl2吸水, 生成的HC1抑制ZnCl2水解,故答案为:SOC12作脱 水剂,与水反应生成HC1可以抑制氯化锌的水解; 18 ②A中SOCl2吸收结晶水得到SO2与HC1,用冰水 冷却收集SOCl2,农硫酸吸收水蒸气,防止溶液中水 蒸气加入B中,用品红溶液检验二氧化硫.用氩氧化 钠溶液吸收尾气中二氧化硫与HC1,防止污染环境,E装置防止倒吸,装置的连接顺序为A→B→D→E→F→C,故答案为:D→E→F→C; ③检测ZnCl2 • H2O晶体是否完全脱水,可以测定 一定质量的样品与足量的硝酸银反应生成氯化银沉淀的质量,从而确定是否为纯净的氯化锌,具体操作 步骤为:称取蒸干后的固体mg溶于水,加入足量稀 硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为 n g,故答案为:daefcb; (4)①SOCl2中+4价硫元素,FeCl3中铁元素具有氧化性,脱水过程中Fe3+会被还原为Fe2+,而SOCl2 会被氧化为H2SO4,反应的离子方程式为:SOCl2 + 2Fe3+ +3H2O=+6H+ +2Fe2+ +2Cl-,故答案为:SOCl2 + 2Fe3+ +3H2O=+6H+ + 2Fe2++2Cl ; ②方案一为检验加水溶解的溶液中是否含有硫酸 根,检验硫酸根的试剂是氯化钡溶液,若滴加BaCl2 溶液,若生成白色沉淀则证明脱水过程发生了氧化 还原反应,故答案为:BaCl2溶液; 方案二为检验加水溶解的溶液中是否含有亚铁离 子,检验亚铁离子时,因为氯离子检验干扰,不能选 用酸性KMnO4溶液,应该选用K3[Fe(CN)6]溶液, 若滴加K3 [Fe(CN)6]溶液,若没有生成蓝色沉淀则 证明脱水过程没有发生氧化还原反应,故答案为: K3[Fe(CN)6]溶液;若无蓝色沉淀出现。 15答案及解析: 答案:(1)分液漏斗 (2)d→e→g→h→b→c→f(d和 e可互换装置) (3)防倒吸 (4)除硫效采更好,在水中的溶解度大、剩余的不会产生二次污染、均被还原为氯离子时,得到的电子数是氯气的2.5倍 (5)①100 容量瓶② 解析: ( 1 ) 仪 器 X 18 与橡皮管连接,平衡内外气压,便于液体顺利流下,该仪器的名称是分液漏斗。 (2)二氧化硫从a进入装置E中反应,为防止倒吸, 故成在之前有安全瓶,则a→d→e,再连接E装置中的g,氧化氯沸点较低,故在B中冰水浴收集,为充分冷却,便于收集,故连接b,最后用氢氧化钠吸收未反应完的二氧化硫,防止污染空气,连接顺序为:d→e→g→h→b→c→f (3)二氧化硫从a若进入装置E中反应,可能会倒吸,故在A与E之间安装C装置,其作用是防止倒吸,而E为发生装置,其中二氧化硫与反应的离子方程式为:。 (4) 被氧化为,会被还原为稳定的 根据氧化还原反应中得失电子数守恒可知,该离子方程式为与氯气相比,除硫效果彻底,氧化产物硫酸根更稳定,在水中的溶解度大、剩余的不会产生二次污染、均被还原为氯离子时,得到的电子数是氯气的2. 5倍。 (5)①称量后在烧杯中溶解,并用玻璃棒搅拌.移入100 mL容量瓶中,加水至距离容量瓶刻度线1—2 cm处改用胶头滴管定容; ②由反应可得关系式:,可知, 则,则其含量为,故答案为g/L。 16答案及解析: 答案:(1)①饱和食盐水;②H2O (2)f→c→b→d(e,f可互换);②通过观察气泡的多少调节两种气体的流速;③不同意;NO与Cl2反应生成的NOCl易溶于浓硫酸;④用Cl2排尽装凳内的空气,以防NO与氧气反应(3)A (4)NOCl+2NaOH=NaCl+NaNO2+H2O (5) 18 (6)①78.8 ②1.0×10-5mol/L 解析:(1)①用MnO2与浓盐酸制备纯净干燥的氯气,需要除去氯气中的氯化氢杂质,装置Ⅱ中的试剂是饱和食盐水; ②用Cu与稀硝酸制备纯净干燥的NO,需要除去NO中的NO2杂质,装置Ⅱ中的试剂是水。 (2)①NOCl的熔点为-64.5℃,沸点为-5.5℃,用冰盐冷凝;亚硝酰氯遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸,要防止亚硝酰氯水解,且用氢氧化钠溶液进行尾气处理,连接顺序是a→e(f)→f(e)→c→b→d; ②通过观察装置Ⅳ、Ⅴ气泡的多少调节两种气体的流速; ③氯气与一氧化氮在常温常压下反应生成NOCl,NOCl易溶于浓硫酸,所以不能直接将NO、Cl2通入装置Ⅴ中; ④用Cl2排尽装置内的空气,以防NO与氧气反应,所以实验开始的时候,先通入氯气,再通入NO。 (3)装置A中氯气进入下面的容器时,下面容器中的液体排入上面的容器中,需要氯气时打开右侧活塞,液体在重力作用下进入下面容器,将氯气排出,所以装置A可以用于储存氯气。 (4)装置Ⅷ吸收尾气时,NOCl与氢氧化钠反应生成水、亚硝酸钠和氯化钠,反应方程式是NOCl+2NaOH=NaCl+NaNO2+H2O。 (5)向装置Ⅵ的氢氧化钠溶液中加入高锰酸钾,NO与高锰酸钾反应产生黑色沉淀MnO2和硝酸钾,反应的离子方程式是。 (6)①设样品中NOCl的质量为x g, NOCl~AgNO3 65.5g 1mol x g 0.40mol/L×0.05L 则,解得x=1.31,样品的纯度为; ②已知常温下,Ksp(Ag2CrO4)=2.0×10-12,滴定终点时,的浓度是5.0×10-3mol/L,所以,根据Ksp(AgCl)=2.0×1010,。 18 18查看更多